Перейти к:
Хроническая болезнь почек как фактор риска инсульта
https://doi.org/10.21886/2308-6424-2025-13-4-97-106
Аннотация
Хроническая болезнь почек (ХБП) представляет собой наиболее значимый фактор риска в развитии инсульта, последний остаётся одной из ведущих причин заболеваемости и смертности в мировом масштабе. Пациенты с ХБП, особенно на стадии терминальной почечной недостаточности, имеют очень высокий риск инсульта (в 5 – 30 раз), с уровнем летальности, достигающим почти 90%. ХБП ассоциируется как с ишемическим, так и с геморрагическим инсультом. Помимо общих факторов риска, повышенный цереброваскулярный риск обусловлен несколькими механизмами, связанными с ХБП, такими как дисфункция тромбоцитов, нарушения свёртывания крови, эндотелиальная дисфункция, воспаление и повышенный риск фибрилляции предсердий. Кроме того, ХБП может существенно влиять на эффективность лечения и профилактики инсульта. Поэтому важно изучить факторы, способствующие развитию инсульта в этой уязвимой группе населения для более эффективного применения профилактических стратегий. В данной статье рассмотрены эпидемиология и патофизиология связи ХБП и инсультов, а также влияние ХБП на исходы инсульта. Цель данного исследования заключается в проведении анализа научных статей, опубликованных за последние двадцать лет, по взаимосвязи между ХБП и риском инсульта. Для достижения этой цели был использован поиск по ключевым словам «хроническая болезнь почек», «инсульт», «риск», «факторы риска инсульта» в базах данных «PubMed», «Google Scholar» и «eLIBRARY».
Ключевые слова
Для цитирования:
Юсупов Ф.А., Юсупов А.Ф., Юлдашев А.А. Хроническая болезнь почек как фактор риска инсульта. Вестник урологии. 2025;13(4):97-106. https://doi.org/10.21886/2308-6424-2025-13-4-97-106
For citation:
Yusupov F.A., Yusupov A.F., Yuldashev A.A. Stroke risk associated with chronic kidney disease. Urology Herald. 2025;13(4):97-106. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-97-106
Введение
В клинической медицине одной из актуальных проблем, находящихся на стыке неврологии и нефрологии, являются ведение и лечение инсульта у пациентов с хронической болезнью почек (ХБП). Изучение общих и специфических факторов, ответственных за высокую распространённость инсульта у больных с ХБП, позволит разработать особенности ведения и лечения данной категории больных и тем самым выработать эффективные методы профилактики острых цереброваскулярных катастроф. Цереброваскулярные заболевания всё чаще связывают с общим состоянием сосудов [1]. Было показано, что патологические состояния, такие как диабет, гипертония и заболевания почек, способствуют нарушению функции нервной системы [2].
Цель исследования: анализ научных статей, опубликованных за последние двадцать лет и посвящённых взаимосвязи между ХБП и риском инсульта. Для достижения этой цели был использован поиск по ключевым словам «хроническая болезнь почек», «инсульт», «риск», «факторы риска инсульта» в базах данных «PubMed», «Google Scholar» и «eLIBRARY».
Сравнительная анатомия и физиология сосудов головного мозга и почек
Головной мозг является главным контролирующим и координирующим центром нашего организма, отвечающим за передачу электрических импульсов и координацию различных функций. Почки являются частью нашей выделительной системы и имеют несколько основных функций. Они играют решающую роль в удалении отходов и излишков веществ из нашего организма, регулировании уровня воды и электролитов, а также в поддержании кислотно-щелочного баланса. Установлено, что нервная система и почки взаимодействуют друг с другом через множество механизмов. Один из таких механизмов — это регуляция кровяного давления. Нервная система контролирует сокращение сосудов в почках, что помогает регулировать приток и отток крови в них. В свою очередь почки контролируют объём крови в организме путём обеспечения выделения мочи и реабсорбции веществ. Кроме того, оба этих органа играют важную роль в регуляции электролитов в организме.
Мозг и почки имеют сходство в своей сосудистой структуре и функции (табл.). Вот некоторые особенности схожести:
- Кровоснабжение. Мозг и почки являются органами с высокой потребностью в кровоснабжении. Оба органа имеют обширные сети капилляров, которые обеспечивают их питание и оксигенацию (рис.1) [3].
- Ауторегуляция. Мозг и почки обладают механизмами ауторегуляции кровотока для поддержания оптимального уровня поступления крови независимо от изменений в системном давлении, что позволяет обеспечить непрерывное кровоснабжение и функционирование этих органов [4].
- Барьерная функция. Мозг и почки имеют специальные барьеры, которые контролируют проницаемость сосудистых структур. Это гематоэнцефалический барьер между кровью и мозгом, который ограничивает проникновение многих веществ из крови в мозг. Аналогично почечный барьер регулирует фильтрацию и реабсорбцию веществ в почках, избегая потери полезных ресурсов [5][6].
- Обратная связь с нервной системой. В отличие от других органов мозг и почки имеют богатую иннервацию нервными волокнами. В обоих органах сосуды иннервированы вегетативным отделом нервной системы, в частности симпатической нервной системой, которая обеспечивает регуляцию сосудистого тонуса и кровотока, а также важную роль в поддержании гомеостаза и регуляции функций мозга и почек [7].
Таблица. Характеристики сосудов почек и головного мозга
Table. Characteristics of the cerebral and renal vessels
Параметры | Головной мозг | Почка |
Артериолы (анатомия) | Высокое давление по отношению к длине | Высокое давление по отношению к длине |
Артериолы (регуляция) | Миогенный (основной) | Миогенный (основной) |
Кровоток | Константа, 100 мл/мин./100 г | Постоянная, 360 мл/мин./100 г |
Кровяной барьер | Плотный/ограниченный проход | Оконный/проницаемый |
Повреждённые микрососуды | + | + |
Признаки гипертонического поражения сосудов | Липогиалиноз | Гиалиноз |
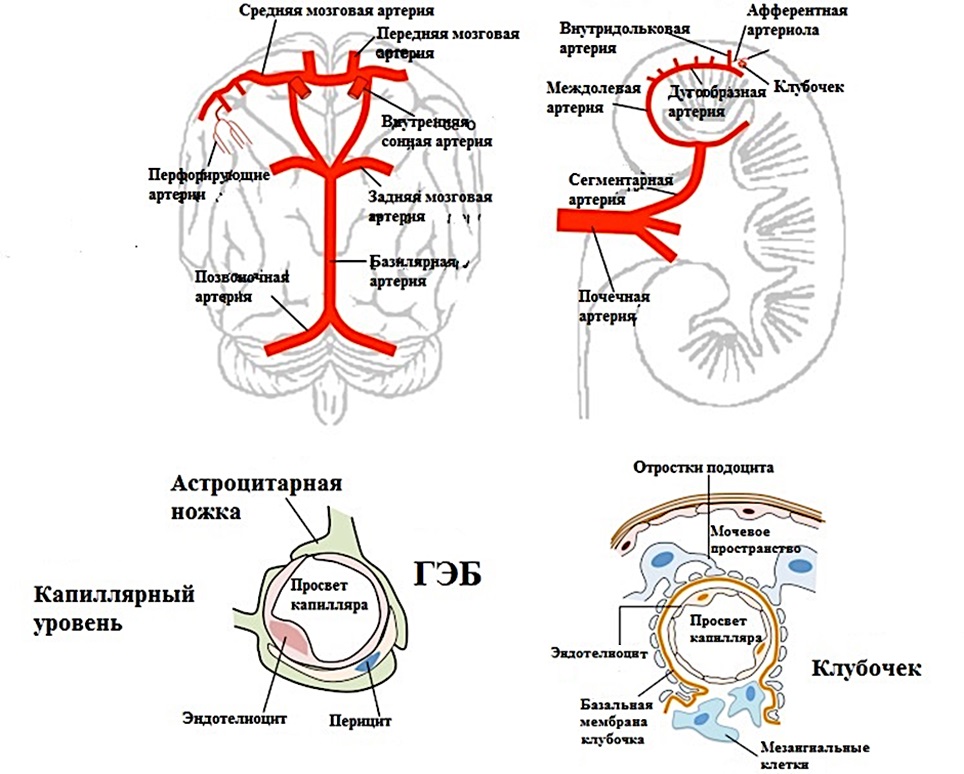
Рисунок 1. Сравнительная анатомия сосудов головного мозга и почек
Figure 1. Comparative anatomy of cerebral and renal vessels
Эпидемиология и патогенетические механизмы инсульта при ХБП
Патология нервной системы и почек во многом имеет общие традиционные факторы риска, такие как возраст, артериальная гипертензия (АГ), сахарный диабет (СД), атеросклероз, гиперхолестеринемия наряду с этим образуется порочный круг взаимоусугубляющего влияния этих факторов [8]. В последнее десятилетие взаимодействие почек и головного мозга вызвало большой интерес, что привело к многочисленным эпидемиологическим и клиническим исследованиям. Почки и головной мозг имеют общие анатомические и функциональные характеристики, что делает их уязвимыми к аналогичным сосудистым факторам риска. Например, этим органам необходим непрерывный и стабильный высокий кровоток в системе с низким сосудистым сопротивлением.
Имеется два механизма, объясняющих поражение нервной системы при ХБП (рис. 2, 3):
- Сосудистый механизм. Головной мозг и почки имеют высокую степень перфузионного кровотока при низком сосудистом сопротивлении, что обусловливает протекание большого количества крови через них. Взаимовлияние традиционных и почечных факторов поражения нервной системы в разы ускоряет повреждение центральной нервной системы. Основными патогенетическими механизмами поражения центральной нервной системы при ХБП считаются метаболические расстройства, нейровоспаление, изменения свертывающей системы крови, эндотелиальная дисфункция, ускорение атеросклеротических изменений церебральных артерий, гиперфосфатемия, снижение концентрации тиамина и фолиевой кислоты. Выявлена прямая корреляция уровней поражения белого вещества головного с уровнями альбуминурии и скоростью клубочковой фильтрации (СКФ). Весомую долю среди факторов занимает и ренальная анемия [9].
- Нейродегенеративный механизм. По сей день изучается механизм повреждающего действия на центральную нервную систему мочевой кислоты, индоксил сульфата, сульфат паракрезола, интерлейкина-1-бета (IL-1β), интерлейкина-6 (IL-6), фактора некроза опухоли-α (TNF-α). Исследования последних лет показывают, что высокие концентрации цистатина С независимо от возраста, расы и сопутствующих заболеваний снижают когнитивные функции и могут служить биомаркером ранней диагностики почечной дисфункции. Имеются данные о том, что цистатин С влияет на образование амилоидных бляшек в сосудах головного мозга [10][11].
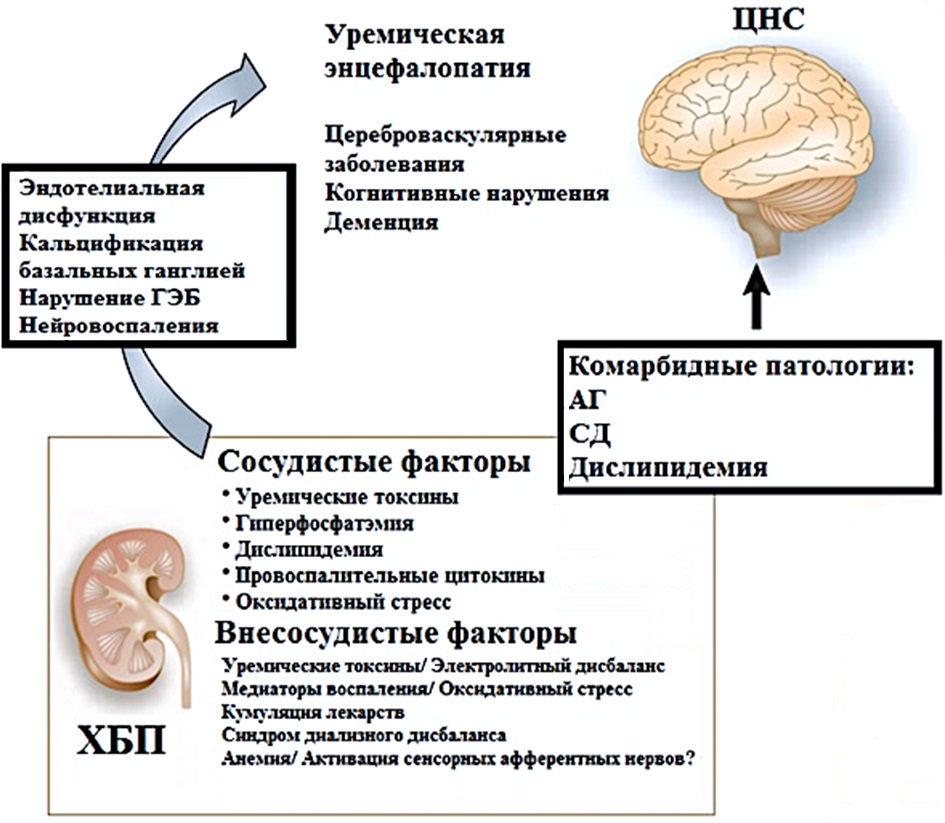
Рисунок 2. Структурное и функциональное повреждение головного мозга при ХБП
Figure 2. Structural and functional brain damage in CKD
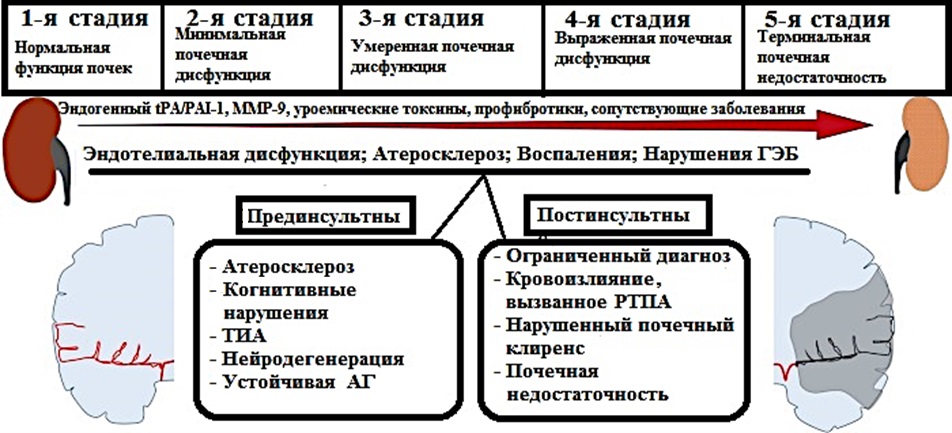
Рисунок 3. Патогенетические факторы пред- и постинсультных осложнений при ХБП
Figure 3. Pathogenetic factors of pre– and post-stroke complications in CKD
Острые и хронические патологии почек представляют собой различные сосудистые поражения, которые могут неблагоприятно влиять на головной мозг [12]. Артериальная гипо- и гипертензия, диабетическая васкулопатия являются известными факторами риска цереброваскулярных заболеваний, связанных с ХБП [13]. Эндотелиальная дисфункция, кальцификация сосудов из-за нарушения регуляции метаболизма кальция и фосфора, а также уремические токсины представляют собой новую точку приложения в патогенезе цереброваскулярных расстройств при ХБП [14].
Всё больше данных свидетельствует о том, что у пациентов с ХБП ишемические инсульты (ИИ) встречаются чаще, чем геморрагические инсульты (ГИ) [15]. ХБП протекает бессимптомно до поздней стадии, но ХБП лёгкой и средней степени тяжести запускают различные патогенетические механизмы, такие как воспаление, окислительный стресс, нейрогормональный дисбаланс, образование уремических токсинов и кальцификацию сосудов, которые повреждают эндотелий и кровеносные сосуды [16]. Когнитивная дисфункция, деменция, транзиторные инфаркты и поражения белого вещества широко распространены у пациентов с ХБП лёгкой и средней степени тяжести [17]. Уремические токсины, образующиеся при хроническом заболевании почек, могут проникать через гематоэнцефалический барьер и вызывать когнитивную дисфункцию и нейродегенерацию. Кроме того, хроническое заболевание почек провоцирует сосудистые факторы риска, которые могут привести к атеросклерозу, гипертонии, мерцательной аритмии и диабету [18]. ХБП также усугубляет патогенез инсульта, ухудшает исходы выздоровления и ограничивает возможности пациентов к адекватной терапии инсульта [19].
У больных моложе 40 лет, особенно с терминальной стадией ХБП, риск инсульта более чем в 11 раз выше, чем у их сверстников того же возраста [20]. Риск также варьируется в зависимости от лечения ХБП с пиком риска для тех, кто начинает диализ, но снижается после первого месяца лечения [21]. Предполагаемыми механизмами повышенного риска, как было указано выше, являются уремия, нарушение регуляции мозгового кровотока, кальцификация сосудов, жёсткость артерий, хроническое воспаление, нарушение сосудистого доступа [22][23].
Метаанализ, включающий данные 33 исследований, сообщил о 43%-м независимом риске инсульта с расчётной СКФ < 60 мл/мин. по сравнению с неазиатским населением (ОР 1,96 против 1,26; p < 0,0001) [24]. Наличие протеинурии само по себе является важным фактором риска инсульта даже при отсутствии сниженной СКФ и после коррекции других сосудистых факторов риска [16].
У пациентов с терминальной стадией хронической почечной недостаточности (ХПН), находящихся на диализе, частота инсульта в 8 – 10 раз выше, чем в общей популяции, при этом показатели варьируются от 10 до 33 случаев на 1000 пациентов [24 – 26]. У диализных пациентов заболеваемость в 10 раз выше, а летальность достигает 90%. Важно понимать, что сосуществование нескольких вышеперечисленных сосудистых факторов прямо коррелирует с тяжестью почечной патологии и наличием диализной терапии, где пик частоты инсульта составляет 10 – 35 случаев на 1000 пациентов, а геморрагический инсульт составляет 20 – 30% всех событий. Пожилой возраст, АГ, СД, особенно в начале диализа, являются факторами наивысшего риска. Пациенты с ХБП стадии 3 – 5 имеют худшую выживаемость, а также ухудшение функциональных исходов после инсульта. Тромболитическая терапия острого инсульта кажется безопасной на всех стадиях ХБП, хотя терапевтический эффект может быть низким. Контроль АГ и использование антитромбоцитарных препаратов составляют основу профилактики инсульта. Польза от антитромбоцитарной терапии и пероральных антикоагулянтов должна быть сбалансирована с реальным риском кровотечения, который наиболее очевиден у больных с терминальной ХПН, получающих диализную терапию [11][27 – 28].
У пациентов с ХБП, и особенно в терминальной стадии поражения сосудов, значительно прогрессируют по сравнению с общей популяцией. В частности, сообщается о более тяжёлом атеросклеротическом поражении сонных артерий у пациентов с терминальной почечной недостаточностью, чем у лиц с нормальной функцией почек. Риск геморрагического инсульта повышается при наличии АГ, СД и при рутинном введении гепарина во время гемодиализа. Ни в одном исследовании не оценивался риск инсульта у реципиентов почечного трансплантата. Первичная и вторичная профилактика инсульта у пациентов с ХБП достигается за счёт коррекции контролируемых факторов риска, таких как лечение гипертонии, вторичного гиперпаратиреоза, анемии, дислипидемии, нарушений свёртывания крови, водно-электролитного и кислотно-щелочного дисбаланса, воспаления, СД и фибрилляции предсердий [9].
В последние несколько лет внимание было сосредоточено на различных показателях ХБП и их прогностическом влиянии у лиц с цереброваскулярными заболеваниями или с риском их развития. Всё больше данных свидетельствуют о том, что наличие ХБП даже на лёгких стадиях связано с суррогатными маркёрами цереброваскулярных заболеваний, обусловливает более высокий риск цереброваскулярных событий в будущем и предсказывает неблагоприятные клинические исходы.
С глобальной точки зрения, бремя ХБП растёт с распространённостью от 11% до 13% [29] для всех стадий ХБП. Распространённость ХБП колеблется от 20 до 35% у больных с острым ишемическим инсультом и от 20 до 46% у больных с внутримозговым кровоизлиянием. Даже у пациентов с лёгкой и умеренной ХБП частота смерти от цереброваскулярных заболеваний намного выше, чем частота почечной недостаточности [30 – 32]. У людей с ХБП риск развития инсульта на 40 – 70 % выше, чем у людей без ХБП. Различия в риске инсульта среди людей с терминальной ХПН по сравнению с общей популяцией могут быть объяснены более высокой распространённостью традиционных факторов риска инсульта, включая АГ, СД и мерцательную аритмию [30]. Повреждение микрососудов почек и головного мозга вызывает все больший интерес из-за сходства их кровоснабжения, в результате чего оба являются конечными органами с низким сопротивлением, подвергающимися воздействию большого объёма крови. Увеличенные периваскулярные пространства в головном мозге встречаются часто, но обычно остаются незамеченными, с не до конца изученным механизмом патофизиологии инсульта [31]. Расширенные периваскулярные пространства являются новым маркёром субклинической болезни малых сосудов головного мозга, связанной с ишемическим и геморрагическим инсультом и деменцией [32].
Анализ связи между ХБП и расширением периваскулярных пространств может в будущем выявить неизученные связи между болезнью почек и цереброваскулярными заболеваниями [33][34]. Было высказано предположение, что церебральная болезнь малых сосудов может быть частью мультисистемного заболевания, поражающего другие сосудистые русла включая сосуды почек [34][35]. Имеются противоречивые эпидемиологические данные о том, является ли низкая расчётная СКФ фактором риска инсульта, независящим от традиционных сердечно-сосудистых факторов риска [36]. В объединённом анализе 22 634 участников исследований, включая исследование риска атеросклероза в группах исследования Framingham и исследование Framingham Offspring, повышенный риск инсульта с более низкой расчётной СКФ не был статистически значимым после коррекции традиционных сердечно-сосудистых факторов риска [37]. Однако в более крупных метаанализах, в которых были объединены относительные риски, скорректированные по нескольким параметрам, риск возникновения инсульта увеличился на 43% у пациентов с расчётной СКФ ниже 60 мл/мин. на 1,73 м² с увеличением риска инсульта на 7% на каждые 10 мл/мин. на 1,73 м² снижения СКФ [38].
Однако повышенный сосудистый риск у лиц с ХБП может быть в основном связан с сосуществующей или предшествующей гипертонией, наиболее распространённым сопутствующим заболеванием у лиц с ХБП, встречающимся у 67 – 92% пациентов. Это ведущий модифицируемый фактор риска инсульта среди населения в целом, независимо от возраста, пола или подтипа инсульта [13][39 – 41].
И реноваскулярное, и цереброваскулярное русло одинаково восприимчивы к традиционным факторам риска атеросклероза, и, следовательно, снижение функции почек и когнитивных функций у пожилых людей связано с общим сосудистым патогенезом [13]. Например, у всех больных с АГ выявляется атеросклероз сосудов, в то время как СД способствует как атеро-, так и артериолосклерозу [42][43]. Нетрадиционные факторы риска, связанные с ХБП, могут способствовать цереброваскулярному повреждению, воздействуя на внутренний и средний слои артерий [24][44].
Сложные взаимодействия между цереброваскулярными заболеваниями и ХБП выходят за рамки общих сосудистых факторов риска. Циркулирующие уремические токсины нарушают жизнеспособность эндотелия (стенки интимы), в то время как хроническое системное воспаление при ХБП способствует как дисфункции эндотелия, так и кальцификации мышечного слоя сосудов [45]. Последний ещё больше усугубляется гиперфосфатемией, повышенной жёсткостью сосудистой стенки и дефицитом антикальцифицирующих факторов в уремической среде. Жёсткость артерий, наложенная на натрий-зависимую гипертензию, и нарушения вегетативной вазомоторной регуляции при поздних стадиях ХБП приводят к выраженной вариабельности артериального давления с повышенным риском как микрокровоизлияний, так и микроинфарктов [10]. Кроме того, на уровне гематоэнцефалического барьера повреждение эндотелия, вызванное уремическим токсином, и уремическая дисфункция тромбоцитов предрасполагают к геморрагическим событиям. Тромболитическая терапия инсульта при ХБП показала повышенный риск симптоматического внутричерепного кровоизлияния или серьёзного системного кровоизлияния, а терапевтические эффекты могут быть снижены. Преимущество терапии статинами у пациентов на диализе в качестве профилактической терапии не было доказано. Контроль артериального давления и разумное использование антиагрегантов составляют основу профилактики инсульта. Польза от антитромбоцитарной терапии и пероральных антикоагулянтов должна быть сбалансирована с реальным и повышенным риском кровотечения, который наиболее очевиден у диализных больных. Повышенный риск кальцификации сосудов, особенно внутримозговых сосудов, наблюдался у пациентов, получавших варфарин в качестве профилактики мерцательной аритмии [46]. Новые антикоагулянты не исследованы у пациентов с СКФ < 30 мл/мин., поэтому их следует использовать с осторожностью. Междисциплинарное сотрудничество между нефрологами, фармацевтами, гематологами, диетологами и неврологами при оказании помощи больным с инсультом на фоне ХБП потенциально может улучшить результаты лечения и реабилитации. Пациенты с ХБП 3–5‑й стадии имеют худшую выживаемость и худшие функциональные исходы после инсульта [47]. У больных с ХБП ограничивается назначение лекарственных препаратов в связи со снижением клиренса, что ухудшает исход инсульта, повышая предрасположенность к кровотечению особенно на терминальных стадиях ХБП [48].
Заключение
Пациенты с ХБП имеют высокий риск инсульта, особенно на поздних стадиях заболевания и при проведении гемодиализа, что может привести к серьёзным последствиям, включая высокую летальность. ХБП увеличивает риск как ишемического, так и геморрагического инсульта через различные механизмы, включая дисфункцию тромбоцитов, нарушение свёртывания крови, эндотелиальную дисфункцию, воспаление и повышенную вероятность фибрилляции предсердий.
Дальнейшие исследования и разработка эффективных стратегий профилактики и лечения инсульта у пациентов с ХБП крайне важны для снижения общей заболеваемости и смертности от инсульта во всем мире. Внедрение этих стратегий поможет улучшить прогноз заболевания и качество жизни пациентов, что является главной целью в работе с данной патологией.
Список литературы
1. Lee D.B., Huang E., Ward H.J. Tight junction biology and kidney dysfunction. Am J Physiol Renal Physiol. 2006;290(1):F20-34. DOI: 10.1152/ajprenal.00052.2005
2. Tinti F., Lai S., Noce A., Rotondi S., Marrone G., Mazzaferro S., Di Daniele N., Mitterhofer A.P. Chronic Kidney Disease as a Systemic Inflammatory Syndrome: Update on Mechanisms Involved and Potential Treatment. Life (Basel). 2021;11(5):419. DOI: 10.3390/life11050419
3. Асфандияров Ф.Р., Кафаров Э.С., Стабредов А.В. Топографическая анатомия почечной артерии, вены и лоханки. Вестник новых медицинских технологий. 2011;18(2):40-41.
4. Федин А.И., Кузнецов М.Р., Берестень Н.Ф., Холопова Е.А., Тугдумов Б.В., Румянцева Е.И., Павочкина Е.С. Состояние ауторегуляции мозгового кровотока. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(1):68-73.
5. Блинов Д.В., Терентьев А.А. Характеристика биохимических маркеров нарушения проницаемости гематоэнцефалического барьера и функционирования центральной нервной системы. Нейрохимия. 2013;30(3):179.
6. Ягмуров О.Д. Гистогематический барьер нефрона как биологическая система при патологии почек. Нефрология. 2003;7(1):7-12.
7. Наточин Ю.В. Целостность. Журнал высшей нервной деятельности им. И.П. Павлова. 2018;68(6):775-787.
8. Синюхин В.Н., Рабинович Э.З., Соколов М.А., Сивков А.В. Неврологические расстройства при хронической болезни почек. Экспериментальная и клиническая урология. 2017;(2):92-101.
9. Watanabe K., Watanabe T., Nakayama M. Cerebro-renal interactions: impact of uremic toxins on cognitive function. Neurotoxicology. 2014;44:184-193. DOI: 10.1016/j.neuro.2014.06.014
10. Муркамилова Ж.А., Сабиров И.С., Фомин В.В., Айтбаев К.А., Юсупов Ф.А., Реджапова Н.А., Райимжанов З.Р., Муркамилов И.Т. Цистатин С и жесткость сосудов как маркеры нефро- и цереброваскулярных заболеваний у лиц пожилого и старческого возраста. Вестник Кыргызско-Российского Славянского университета. 2020;20(5):34-44.
11. Hruska K.A., Mathew S., Lund R., Qiu P., Pratt R. Hyperphosphatemia of chronic kidney disease. Kidney Int. 2008;74(2):148-157. DOI: 10.1038/ki.2008.130
12. Юсупов Ф.А., Юлдашев А.А. Нервная система и почки. Перекрестные механизмы взаимодействия в норме и при патологии. Нефрология. 2023;27(2):29-38.
13. Lau W.L., Huisa B.N., Fisher M. The Cerebrovascular-Chronic Kidney Disease Connection: Perspectives and Mechanisms. Transl Stroke Res. 2017;8(1):67-76. DOI: 10.1007/s12975-016-0499-x
14. Муркамилов И.Т., Айтбаев К.А., Фомин В.В., Райимжанов З.Р., Реджапова Н.А., Юсупов Ф.А., Айдаров З.А. Торможение прогрессирования почечной дисфункции и цереброваскулярных событий: возможности Аторвастатина. Фарматека. 2017;(15):74-82.
15. Kobayashi M., Hirawa N., Yatsu K., Kobayashi Y., Yamamoto Y., Saka S., Andoh D., Toya Y., Yasuda G., Umemura S. Relationship between silent brain infarction and chronic kidney disease. Nephrol Dial Transplant. 2009;24(1):201-207. DOI: 10.1093/ndt/gfn419
16. Toyoda K. Cerebral small vessel disease and chronic kidney disease. J Stroke. 2015;17(1):31-37.DOI: 10.5853/jos.2015.17.1.31
17. Дамулин И.В., Воскресенская О.Н. Неврологические нарушения при хронической болезни почек. Неврологический вестник. 2017;49(1):34-39.
18. Муркамилов И.Т., Айтбаев К.А., Муркамилова Ж.А., Фомин В.В., Юсупов Ф.А. Бета-2-микроглобулин как биомаркер при хронической болезни почек. The Scientific Heritage. 2021;(59-2):45-55.
19. Chelluboina B., Vemuganti R. Chronic kidney disease in the pathogenesis of acute ischemic stroke. J Cereb Blood Flow Metab. 2019;39(10):1893-1905. DOI: 10.1177/0271678X19866733
20. Mahmoodi B.K., Yatsuya H., Matsushita K., Sang Y., Gottesman R.F., Astor B.C., Woodward M., Longstreth WT. Jr, Psaty B.M., Shlipak M.G., Folsom A.R., Gansevoort R.T., Coresh J. Association of kidney disease measures with ischemic versus hemorrhagic strokes: pooled analyses of 4 prospective community-based cohorts. Stroke. 2014;45(7):1925-1931. DOI: 10.1161/STROKEAHA.114.004900
21. Gadalean F., Simu M., Parv F., Vorovenci R., Tudor R., Schiller A., Timar R., Petrica L., Velciov S., Gluhovschi C., Bob F., Mihaescu A., Timar B., Spasovski G., Ivan V. The impact of acute kidney injury on in-hospital mortality in acute ischemic stroke patients undergoing intravenous thrombolysis. PLoS One. 2017;12(10):e0185589. DOI: 10.1371/journal.pone.0185589
22. Chien S.J., Lin I.C., Hsu C.N., Lo M.H., Tain Y.L. Homocysteine and Arginine-to-Asymmetric Dimethylarginine Ratio Associated With Blood Pressure Abnormalities in Children With Early Chronic Kidney Disease. Circ J. 2015;79(9):2031-2037. DOI: 10.1253/circj.CJ-15-0412
23. Nayak-Rao S., Shenoy M.P. Stroke in Patients with Chronic Kidney Disease…: How do we Approach and Manage it? Indian J Nephrol. 2017;27(3):167-171. DOI: 10.4103/0971-4065.202405
24. Ninomiya T., Perkovic V., Verdon C., Barzi F., Cass A., Gallagher M., Jardine M., Anderson C., Chalmers J., Craig J.C., Huxley R. Proteinuria and stroke: a meta-analysis of cohort studies. Am J Kidney Dis. 2009;53(3):417-425. DOI: 10.1053/j.ajkd.2008.08.032
25. Eldehni M.T., McIntyre C.W.. Are there neurological consequences of recurrent intradialytic hypotension? Semin Dial. 2012;25(3):253-256. DOI: 10.1111/j.1525-139X.2012.01057.x
26. Seliger S.L., Gillen D.L., Longstreth W.T. Jr, Kestenbaum B, Stehman-Breen CO. Elevated risk of stroke among patients with end-stage renal disease. Kidney Int. 2003;64(2):603-609. DOI: 10.1046/j.1523-1755.2003.00101.x
27. Deramecourt V., Slade J.Y., Oakley A.E., Perry R.H., Ince P.G., Maurage C.A., Kalaria R.N. Staging and natural history of cerebrovascular pathology in dementia. Neurology. 2012;78(14):1043-1050. DOI: 10.1212/WNL.0b013e31824e8e7f
28. Gupta J., Mitra N., Kanetsky P.A., Devaney J., Wing M.R., Reilly M., Shah V.O., Balakrishnan V.S., Guzman N.J., Girndt M., Periera B.G., Feldman H.I., Kusek J.W., Joffe M.M., Raj D.S. CRIC Study Investigators. Association between albuminuria, kidney function, and inflammatory biomarker profile in CKD in CRIC. Clin J Am Soc Nephrol. 2012;7(12):1938-1946. DOI: 10.2215/CJN.03500412
29. Gansevoort R.T., Correa-Rotter R., Hemmelgarn B.R., Jafar T.H., Heerspink H.J., Mann J.F., Matsushita K., Wen C.P. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. Lancet. 2013;382(9889):339-352. DOI: 10.1016/S0140-6736(13)60595-4
30. Longenecker J.C., Coresh J., Powe N.R., Levey A.S., Fink N.E., Martin A., Klag M.J. Traditional cardiovascular disease risk factors in dialysis patients compared with the general population: the CHOICE Study. J Am Soc Nephrol. 2002;13(7):1918-1927. DOI: 10.1097/01.asn.0000019641.41496.1e
31. Doubal F.N., MacLullich A.M., Ferguson K.J., Dennis M.S., Wardlaw J.M. Enlarged perivascular spaces on MRI are a feature of cerebral small vessel disease. Stroke. 2010;41(3):450-454. DOI: 10.1161/STROKEAHA.109.564914
32. Charidimou A., Boulouis G., Pasi M., Auriel E., van Etten E.S., Haley K., Ayres A., Schwab K.M., Martinez-Ramirez S., Goldstein J.N., Rosand J., Viswanathan A., Greenberg S.M., Gurol M.E. MRI-visible perivascular spaces in cerebral amyloid angiopathy and hypertensive arteriopathy. Neurology. 2017;88(12):1157-1164. DOI: 10.1212/WNL.0000000000003746
33. Liu B., Lau K.K., Li L., Lovelock C., Liu M., Kuker W., Rothwell P.M. Age-Specific Associations of Renal Impairment With Magnetic Resonance Imaging Markers of Cerebral Small Vessel Disease in Transient Ischemic Attack and Stroke. Stroke. 2018;49(4):899-904. DOI: 10.1161/STROKEAHA.117.019650
34. Seliger S.L., Longstreth W.T. Jr. Lessons about brain vascular disease from another pulsating organ, the kidney. Stroke. 2008;39(1):5-6. DOI: 10.1161/STROKEAHA.107.496000
35. O'Rourke M.F., Safar M.E. Relationship between aortic stiffening and microvascular disease in brain and kidney: cause and logic of therapy. Hypertension. 2005;46(1):200-204. DOI: 10.1161/01.HYP.0000168052.00426.65
36. Toyoda K., Ninomiya T. Stroke and cerebrovascular diseases in patients with chronic kidney disease. Lancet Neurol. 2014;13(8):823-833. DOI: 10.1016/S1474-4422(14)70026-2
37. Weiner D.E., Tighiouart H., Amin M.G., Stark P.C., MacLeod B., Griffith J.L., Salem D.N., Levey A.S., Sarnak M.J. Chronic kidney disease as a risk factor for cardiovascular disease and all-cause mortality: a pooled analysis of community-based studies. J Am Soc Nephrol. 2004;15(5):1307-1315. DOI: 10.1097/01.asn.0000123691.46138.e2
38. Kelly D.M., Rothwell P.M. Does Chronic Kidney Disease Predict Stroke Risk Independent of Blood Pressure?: A Systematic Review and Meta-Regression. Stroke. 2019;50(11):3085-3092. DOI: 10.1161/STROKEAHA.119.025442
39. Muntner P., Anderson A., Charleston J., Chen .Z, Ford V., Makos G., O'Connor A., Perumal K., Rahman M., Steigerwalt S., Teal V., Townsend R., Weir M., Wright J.T. Jr. Chronic Renal Insufficiency Cohort (CRIC) Study Investigators. Hypertension awareness, treatment, and control in adults with CKD: results from the Chronic Renal Insufficiency Cohort (CRIC) Study. Am J Kidney Dis. 2010;55(3):441-451. DOI: 10.1053/j.ajkd.2009.09.014
40. O'Donnell M.J., Chin S.L., Rangarajan S., Xavier D., Liu L., Zhang H., Rao-Melacini P., Zhang X., Pais P., Agapay S., Lopez-Jaramillo P., Damasceno A., Langhorne P., McQueen M.J., Rosengren A., Dehghan M., Hankey G.J., Dans A.L., Elsayed A., Avezum A., Mondo C., Diener H.C., Ryglewicz D., Czlonkowska A., Pogosova N., Weimar C., Iqbal R., Diaz R., Yusoff K., Yusufali A., Oguz A., Wang X., Penaherrera E., Lanas F., Ogah O.S., Ogunniyi A., Iversen H.K., Malaga G., Rumboldt Z., Oveisgharan S., Al Hussain F., Magazi D., Nilanont Y., Ferguson J., Pare G., Yusuf S. INTERSTROKE investigators. Global and regional effects of potentially modifiable risk factors associated with acute stroke in 32 countries (INTERSTROKE): a case-control study. Lancet. 2016;388(10046):761-775. DOI: 10.1016/S0140-6736(16)30506-2
41. Lawes C.M., Bennett D.A., Feigin V.L., Rodgers A. Blood pressure and stroke: an overview of published reviews. Stroke. 2004;35(3):776-785. Corrected and republished in: Stroke. 2004;35(4):1024. DOI: 10.1161/01.STR.0000116869.64771.5A
42. Chen Y.C., Su Y.C., Lee C.C., Huang Y.S., Hwang S.J. Chronic kidney disease itself is a causal risk factor for stroke beyond traditional cardiovascular risk factors: a nationwide cohort study in Taiwan. PLoS One. 2012;7(4):e36332. DOI: 10.1371/journal.pone.0036332
43. Koren-Morag N., Goldbourt U., Tanne D. Renal dysfunction and risk of ischemic stroke or TIA in patients with cardiovascular disease. Neurology. 2006;67(2):224-228. DOI: 10.1212/01.wnl.0000229099.62706.a3
44. Lee M., Saver J.L., Chang K.H., Liao H.W., Chang S.C., Ovbiagele B. Low glomerular filtration rate and risk of stroke: meta-analysis. BMJ. 2010;341:c4249. DOI: 10.1136/bmj.c4249
45. Karbowska M., Kaminski T.W., Marcinczyk N., Misztal T., Rusak T., Smyk L., Pawlak D. The Uremic Toxin Indoxyl Sulfate Accelerates Thrombotic Response after Vascular Injury in Animal Models. Toxins (Basel). 2017;9(7):229. DOI: 10.3390/toxins9070229
46. Муркамилов И.Т., Сабиров И.С., Фомин В.В., Муркамилова Ж.А., Юсупов Ф.А. Электролитный дисбаланс и аритмии сердца при хронической болезни почек. The Scientific Heritage. 2021;(60-2):55-70.
47. Yang Y., Rosenberg G.A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 2011;42(11):3323-3328. DOI: 10.1161/STROKEAHA.110.608257
48. Ржевская О.Н., Моисеева А.Ю., Эсауленко А.Н., Пинчук А.В., Алиджанова Х.Г. Хроническая болезнь почек как фактор риска острого инсульта. Трансплантология. 2021;13(4):382-397.
Об авторах
Ф. А. ЮсуповКыргызстан
Фуркат Абдулахатович Юсупов – д-р мед. наук, профессор
Ош
А. Ф. Юсупов
Кыргызстан
Абдулхаким Фуркатович Юсупов
Ош
А. А. Юлдашев
Кыргызстан
Акмал Акбарович Юлдашев
Ош
Рецензия
Для цитирования:
Юсупов Ф.А., Юсупов А.Ф., Юлдашев А.А. Хроническая болезнь почек как фактор риска инсульта. Вестник урологии. 2025;13(4):97-106. https://doi.org/10.21886/2308-6424-2025-13-4-97-106
For citation:
Yusupov F.A., Yusupov A.F., Yuldashev A.A. Stroke risk associated with chronic kidney disease. Urology Herald. 2025;13(4):97-106. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-97-106













































