Перейти к:
Результаты использования аппарата HistoScanningTM для диагностики рака предстательной железы в сравнении со стандартной мультифокальной биопсией
https://doi.org/10.21886/2308-6424-2023-11-4-62-71
Аннотация
Введение. Стандартом верификации диагноза аденокарциномы простаты служит биопсия предстательной железы. При стандартной мультифокальной биопсии под ультразвуковым наведением сохраняется высокий процент ложноотрицательных результатов, что привело к изучению дополнительных методов диагностики. HistoscanningTM — новая технология дифференцировки ткани простаты, основанная на анализе обратного рассеивания ультразвука. Программное обеспечение анализирует плотность тканей, выстраивает 3D-модель предстательной железы с указанием локализации подозрительных очагов на РПЖ, из которых забираются прицельные биоптаты.
Цель исследования. Оценить диагностическую точность аппарата HistoscanningTM, определить преимущества прицельной биопсии предстательной железы в сравнении со стандартной мультифокальной биопсией.
Материалы и методы. Это проспективное исследование, проведённое в период с января 2017 года по май 2021 года. В работу включены 909 пациентов, которым была выполнена трансректальная биопсия предстательной железы в ГКБ № 1 им. Н. И. Пирогова. Группа контроля (A) — 443 мужчины после стандартной мультифокальной биопсии, группа сравнения (B) — 506 мужчин после комбинированной стандартной мультифокальной биопсии совместно с прицельной биопсией с использованием аппарата HistoscanningTM.
Результаты. В группе контроля рак предстательной железы выявлен у 33,4% пациентов, в группе с использованием аппарата HistoscanningTM — 39,7%. Во группе Б чаще встречались высокодиференцированнные формы рака группы ISUP 1 — 71,1%, в группе А— 52,7%. Изолированное поражение прицельных биоптатов обнаружено лишь у 9 мужчин (4,5%) группы Б. Чаще встречалось сочетанное поражение стандартных и прицельных биоптатов — 121 пациент, однако у 72 пациентов в прицельных биоптатах не было выявлено атипичных клеток при наличии РПЖ в стандартных биоптатах. При объёме предстательной железы более 60 см3 эффективность при применении аппарата HistoscanningTM была сопоставима со стандартной биопсией.
Заключение. Использование аппарата HistoscanningTM улучшает диагностику рака предстательной железы, однако преимущественно за счёт группы ISUP 1. Выполнение только прицельных вколов нецелесообразно в связи с высоким процентом ложноотрицательного результата. Показано проведение комбинированной биопсии простаты с обязательным забором таргетных биоптатов совместно со стандартными. Диагностическая точность HistoscanningTM показала лучшие результаты при объёме предстательной железы до 60 см3.
Ключевые слова
Для цитирования:
Котов С.В., Гуспанов Р.И., Пульбере С.А., Юсуфов А.Г., Хачатрян А.Л., Бядретдинов И.Ш., Жилов М.С., Алекберов Э.М., Логвинова С.Л. Результаты использования аппарата HistoScanningTM для диагностики рака предстательной железы в сравнении со стандартной мультифокальной биопсией. Вестник урологии. 2023;11(4):62-71. https://doi.org/10.21886/2308-6424-2023-11-4-62-71
For citation:
Kotov S.V., Guspanov R.I., Pulbere S.A., Yusufov A.G., Khachatryan A.L., Badretdinov I.S., Zhilov M.S., Alekberov E.M., Logvinova S.L. HistoScanningTM vs. standard multifocal biopsy for prostate cancer diagnosis: a comparison of diagnostic methods. Urology Herald. 2023;11(4):62-71. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-4-62-71
Введение
Рак предстательной железы (РПЖ) является одним из наиболее распространённых злокачественных заболеваний, занимая первое место по впервые диагностированным опухолям у мужчин (26%) и второе место по смертности в мире (11%) [1]. В России РПЖ занимает второе место в структуре заболеваемости у мужчин — 14,9%, уступая только опухолям трахеи, бронхов и лёгкого [2]. Стандартом верификации диагноза аденокарциномы простаты является биопсия предстательной железы. Современные аппараты трансректального ультразвукового исследования (ТРУЗИ) обеспечивают высокое качество визуализации, позволяя урологу точно определить границы, зональную анатомию простаты, провести доплерографию. Однако технология биопсии под ТРУЗИ контролем не позволяет достоверно дифференцировать ткани предстательной железы. Частота ложноотрицательных результатов при стандартной трансректальной биопсии предстательной железы под ТРУЗИ контролем остаётся на высоком уровне [3]. Увеличение количества биоптатов привело к улучшению диагностики РПЖ, однако это было сопряжено с увеличением процента осложнений [4]. В настоящее время проводятся многочисленные исследования по внедрению дополнительных методов визуализации с целью повышения выявления РПЖ, используя такие как: эластография, гистосканирование, мультипараметрическая МРТ (мпМРТ) [5][6]. Histoscanningä (ГС) — новая технология дифференцировки тканей простаты, основанная на анализе обратного рассеивания ультразвука. Компьютерный анализ основан на трёх алгоритмах: васкулярности, гетерогенности тканей и плотности клеток. ГС выстраивает 3D-модель предстательной железы с указанием локализации подозрительных очагов на РПЖ, что позволяет провести прицельную биопсию.
Цель исследования. Оценить диагностическую точность аппарата Histoscanningä, определить преимущества прицельной биопсии предстательной железы в сравнении со стандартной мультифокальной биопсией в ежедневной практике врача уролога.
Материалы и методы
Проведено ретроспективное исследование на базе университетской клиники урологии им. Н. И. Пирогова в период с января 2017 года по май 2021. За этот период было проанализировано 909 биопсий, которые разделены на 2 группы: группа А — 443 пациента, которым была выполнена стандартная мультифокальная трансректальная биопсия предстательной железы под УЗИ контролем, группа Б — 506 пациентов после биопсии предстательной железы с использованием аппарата ГС, данные пациентов представлены в таблице 1.
Таблица 1.Данные пациентов
Table 1. Data of patients
Параметры Characteristics | Cтандартная биопсия Standard biopsy | Биопсия с ГС HS-guided biopsy | p |
Количество пациентов Number of patients | 443 | 506 | |
Возраст, лет (M ± SD) Age, yrs (Me ± SD) | 66 ± 7,3 | 66 ± 7,3 | > 0,05 |
ПСА, нг/мл (Me +/- SD) PSA, ng/ml (Me ± SD) | 7,6 ± 5,3 | 7,2 ± 5,4 | > 0,05 |
Объём простаты, см³ (Me ± SD) Prostate volume, cc (Me ± SD) | 51 ± 35,8 | 47,3 ± 27,8 | < 0,05 |
Плотность ПСА, нг/мл/см³ (Me ± SD) PSA density, ng/ml/cc (Me ± SD) | 0,15 ± 0,18 | 0,13 ± 0,13 | < 0,05 |
Количество биоптатов (Me ± SD) Number of cores (Me ± SD) | 14 ± 2,3 | 15 ± 1,2 | > 0,05 |
Первичная биопсия, n (%) Biopsy-naive, n (%) | 321 (79,7) | 438 (86,6) | > 0,05 |
Повторная биопсия, n (%) Prior negative, n (%) | 82 (20,3) | 68 (13,4) | > 0,05 |
Примечание. ГС — гистосканирование;
ПРИ — пальцевое ректальное исследование;
РПЖ — рак предстательной железы;
ПСА — простатспецифический антиген;
МРТ — магнитнорезонансная томография;
n — количество случаев;
SD — стандартное отклонение;
Ме — медиана
Note. HS — histoscanning;
DRE — digital rectal examination;
PCa — prostate cancer;
PSA — prostate specific antigen;
MRI — magnetic resonance imaging;
US — ultrasound;
n — number of cases;
SD — standard deviation;
Ме — median
До июля 2019 года пациентам выполняли стандартную трансректальную биопсию предстательной железы. За год было проанализировано 403 биопсий, выполненных трансректальным доступом под контролем УЗИ. В период с июня 2019 года по май 2021 года выполнено 506 биопсий трансректальным доступом при помощи аппарата ГС.
Критерии включения:
- Пациенты с повышенным уровнем ПСА (выше возрастной нормы).
- Наличие подозрительных очагов по данным лучевых исследований (УЗИ, мпМРТ).
- Обнаружение очагов уплотнений предстательной железы при пальцевом ректальном исследовании (ПРИ).
Критерии невключения:
- Высокий уровень ПСА (пациентам с ПСА >30 нг/мл выполняли секстантную биопсию).
- Выполнение пациентам FUSION биопсии.
- Наличие заболеваний анального отверстия и ампулы прямой кишки.
Техника выполнения стандартной трансректальной биопсии. Пациент укладывается на операционном столе в положении на боку с согнутыми тазобедренными и коленными суставами либо в литотомическое положение. Трасректально вводится УЗИ датчик. Визуализируются предстательная железа, семенные пузырьки, уретра. В режиме доплерографии определяются гиперваскуляризованные зоны железы. С целью обезболивания выполняется перипростатический блок в область угла между семенным пузырьком и основанием предстательной железы с двух сторон. Биопсийным пистолетом Bard Magnum с помощью игл 16G 20 мм по стандартной методике выполняется забор тканей из основания, середины и верхушки железы парауретрально и латерально, всего 12 точек. Каждый биоптат помещается в отдельный флакон и маркируется.
Техника определения таргетных очагов с аппаратом Histoscanningä. Предстательная железа сканируется для создания её 3D-изображения. Для обеспечения точного сбора данных визуализации ультразвуковой датчик подключается к катушке на магните, которая вращает датчик ТРУЗИ на 180°. Затем врач определяет точные границы предстательной железы в программной платформе. Сигнал анализируется, затем программное обеспечение классифицирует выявленные подозрительные очаги, генерируя красный цвет для областей, подозрительных на РПЖ. Области с низкоинформативными данными отображаются фиолетовым цветом. Очаг менее 0,5 см³ считался клинически незначимым, в таком случае прицельная биопсия пациентам не выполнялась.
Техника выполнения биопсии предстательной железы в ГКБ № 1 им. Н. И. Пирогова. Выполняется ТРУЗИ простаты, определение гипоэхогенных очагов, использование доплерографии для выявления гиперваскуляризованных образований. После этого группе больных А выполняли стандартную (S) трансректальную биопсию предстательной железы, количество биоптатов основывалось на Венской номограмме. Пациентам группы Б выполняли ГС. После сканирования железы хирург производит коррекцию контура простаты, после чего программа анализирует и определяет зоны, подозрительные в отношении РПЖ, выделяя их красным цветом (рис. 1). Хирург отмечает на карте области для выполнения прицельных (T) биоптатов (в среднем 1 биоптат на 1 см³ очага). После забора прицельных биоптатов этим же больным выполняли стандартную мультифокальную биопсию предстательной железы.
Статистический анализ. Организацию и статистическую обработку данных выполняли с использованием «Microsoft Office Excel 2010» («Microsoft Corp.», Redmond, WA, USA) и программу STATISTICA v.7.0. (“StatSoft Inc.”, Tulsa, OK, USA). Все анамнестические, клинические, лабораторные и инструментальные данные вносили в базу данных на основе Microsoft Office Excel, разработанную автором, и обрабатывали методами вариационной статистики. Для количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (M) и стандартное отклонение (SD), которые были представлены в виде M ± SD. Если количественные данные не подчинялись закону нормального распределения, для их описания применяли медиану (Me). Сравнение показателей проводили при помощи оценки t-критерия Student для данных с нормальным распределением. При отсутствии нормального распределения использовали U-тест Mann-Whitney. Для определения статистически значимых различий использовали порог p = 0,05. Чувствительность и специфичность были рассчитаны с 95% доверительным интервалом.
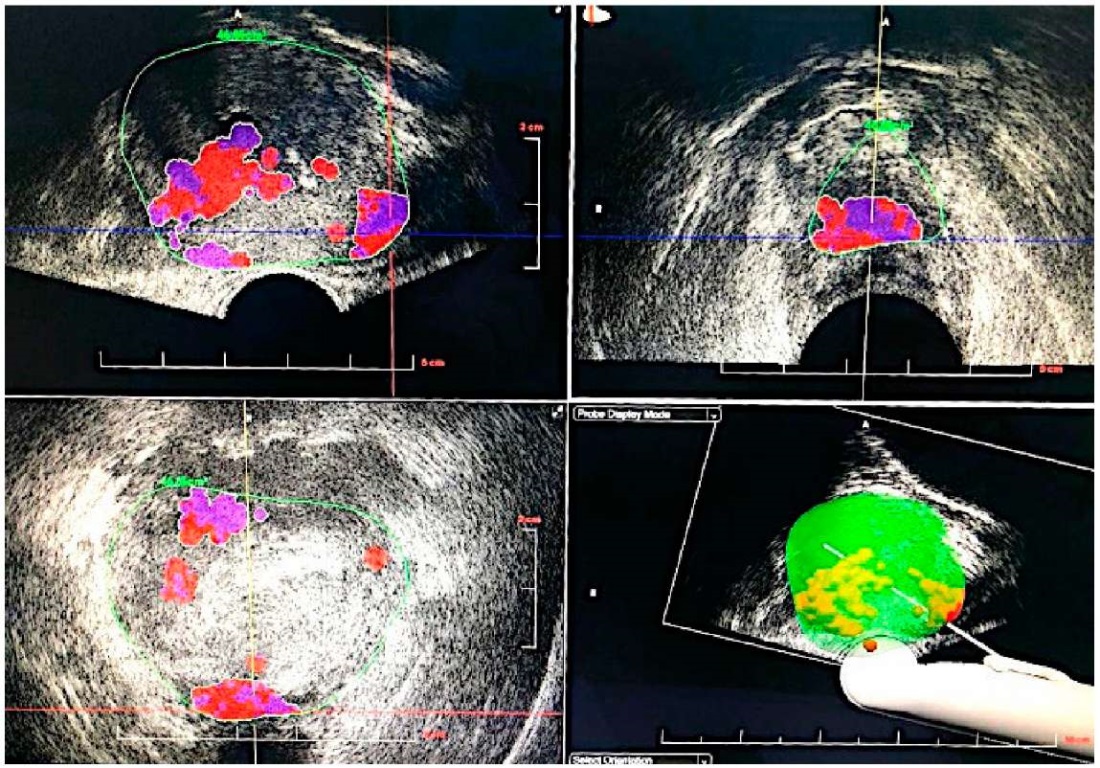
Рисунок 1. Гистосканограммы: подозрительные очаги в предстательной железе
Figure 1. Histoscanningä scans: PCa-suspicious foci in the prostate
Результаты
По данным гистологического заключения РПЖ выявлен в группе А у 143 пациентов (33,4%), в группе Б — у 204 пациентов (39,7%) (табл. 2). В нашем исследование использование аппарата ГС показало чувствительность 65% (95% ДИ 34 – 69), специфичность 44% (95% ДИ 25 – 52).
Таблица 2. Результаты
Table 2. Results
Параметры Characteristics | Cтандартная биопсия Standard biopsy | Биопсия с ГС HS-guided biopsy | p |
РПЖ, n (%) PCa, n (%) | 148 (33,4) | 201 (39,7) | < 0,05 |
ISUP 1, n (%) | 78 (17,6) | 143 (28,3) | < 0,05 |
ISUP 2, n (%) | 37 (8,4) | 20 (3,9) | < 0,05 |
ISUP 3, n (%) | 19 (4,3) | 13 (2,6) | > 0,05 |
ISUP 4, n (%) | 12 (2,7) | 21 (4,2) | > 0,05 |
ISUP 5, n (%) | 2 (0,4) | 4 (0,8) | > 0,05 |
Примечание. ГС — гистосканирование;
ISUP — Международное общество урологической патологии;
РПЖ — рак предстательной железы;
n — количество случаев
Note. HS — histoscanning;
ISUP — International Society of Urological Pathology;
PCa — prostate cancer;
n — number of cases
Все гистологические заключения с диагностированным РПЖ проанализированы и распределены по группе ISUP (рис. 2). Использование аппарата ГС значительно повышает выявление РПЖ группы ISUP 1 до 71,1% против 52,7% (p < 0,05), группа ISUP 2 преобладает при стандартной биопсии — 25% против 10% (p < 0,05), во всех остальных группах ISUP результаты достоверно не различались (p > 0,05).
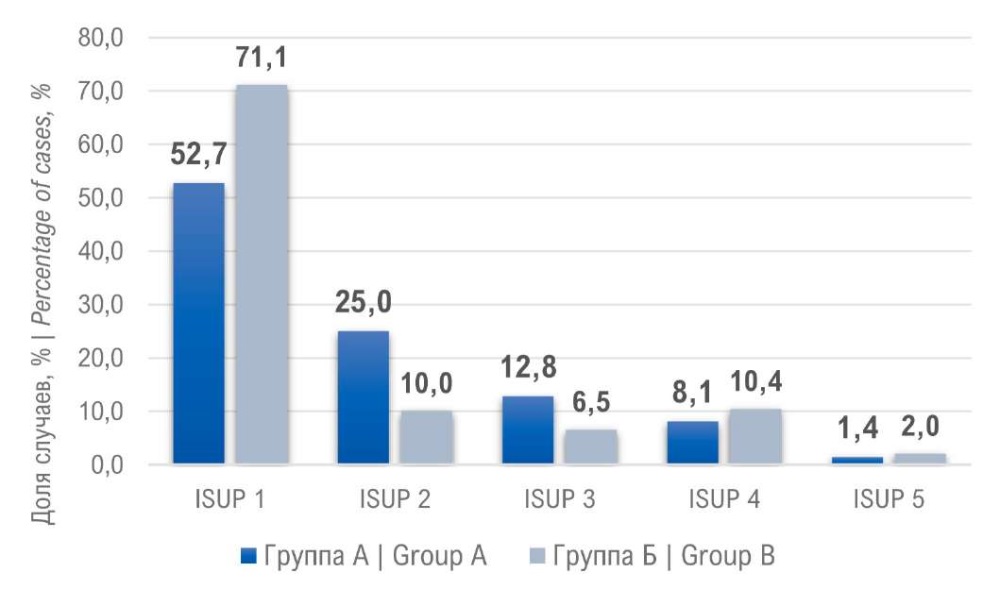
Рисунок 2. Распределение пациентов по группам ISUP
Figure 2. Distribution of patients by ISUP groups
201 пациента из группы Б с диагностированным РПЖ были распределены на 3 группы в зависимости от выявления рака в стандартном биоптате (S+T-), в прицельном биоптате (S-T+) и сочетано в стандартном и прицельном (S+T+). В большинстве случаев выявлен РПЖ как в стандартном, так и в прицельном биоптате – почти 60% (рис. 3).
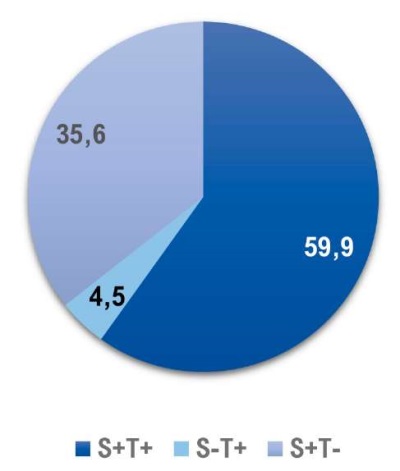
Рисунок 3. Распределение пациентов по поражениям
в стандартных (S) и прицельных (T) биоптатах
Figure 3. Distribution of patients by lesions
in standard (S) and targeted (T) biopsies
У 9 мужчин (4,5%) ГС позволил диагностировать РПЖ при помощи прицельных биоптатов. Из 9 пациентов у 7 ISUP 1, и по одному пациенту с ISUP 2 и 3. Данные результаты говорят о том, что ГС позволяет дополнительно выявить низкий процент высокодифференцированного РПЖ. У 35,6% пациентов поражены были только стандартные биоптаты, у этой группы пациентов прицельные биоптаты «пропустили» РПЖ. При сравнении групп (S+T0) и (S+T+) выявлено, что вторая группа пациентов имела выше процент мужчин с более злокачественными формами РПЖ (ISUP 3 – 4). Мы проанализировали группу (S+T+). При изолированном сравнении системных и прицельных биоптатов выявлено, что распределение по ISUP оказалось одинаковым для биоптатах S и Т, а в группе ISUP 4 выше у системных 16,5% по сравнению с 14,1%. Для 68 пациентов из группы Б биопсия предстательной железы была повторной. Процент выявления РПЖ составил 25,4%, однако ни у одного из пациентов РПЖ не был выявлен только в прицельных биоптатах. В группе А процент положительного результата повторной биопсии составил 25%, что оказалось сопоставимо с группой Б. Следующей задачей для нас было распределить пациентов по уровню ПСА. Процент выявления РПЖ возрастал пропорционально росту ПСА в обеих группах пациентов. Так при уровне ПСА более 20 нг/мл в группе А процент выявления рака простаты составил 45,4%, в группе Б — 53,3% (рис. 4). Выявление более злокачественных форм РПЖ (ISUP 4 – 5) также возрастало с ростом ПСА. Обратная зависимость оказалась при сравнении объёма предстательной железы и процента выявления РПЖ. Для объёма простаты до 30 см³ процент РПЖ составил 75,3% в группе Б и 57,7% в группе А (рис. 5). Учитывая большое влияние объёма ПЖ на процент выявления РПЖ, нами была проанализирована зависимость плотности ПСА на РПЖ. Наилучшие результаты получены при плотности ПСА более 0,3 нг/мл/см³, так рак простаты диагностирован в 70% в группе Б и 58,1% в группе А (рис. 6).
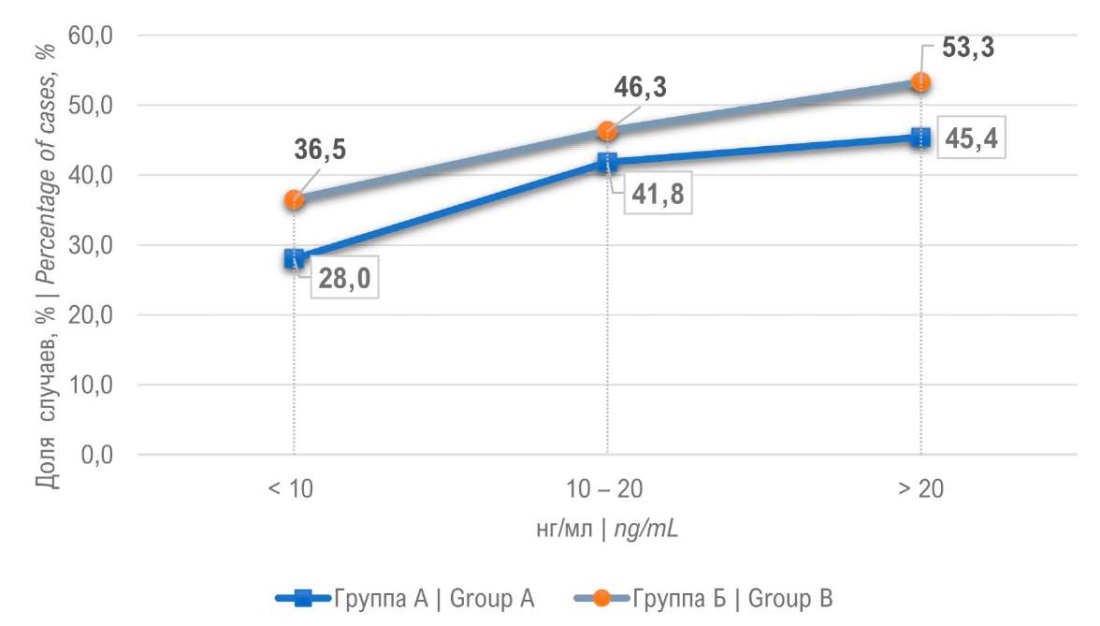
Рисунок 4. Диагностика рака предстательной железы
в зависимости от уровня общего ПСА
Figure 4. Diagnosis of prostate cancer depending on tPSA values
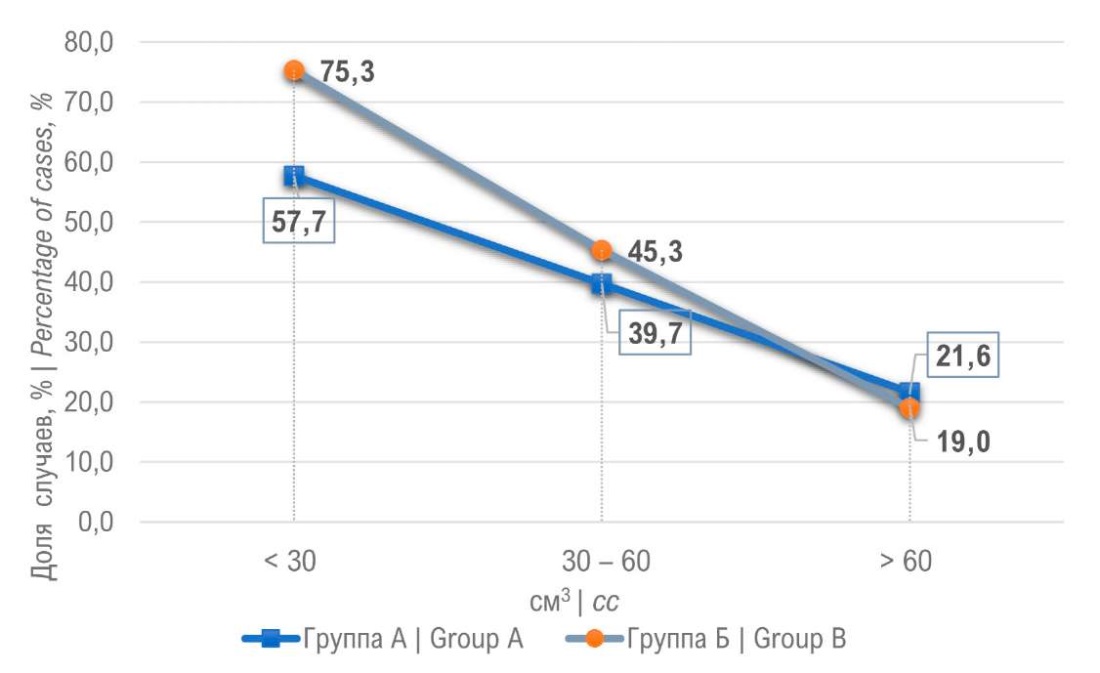
Рисунок 5. Диагностика рака предстательной железа в зависимости от её объёма
Figure 5. Diagnosis of prostate cancer depending on the prostate volume
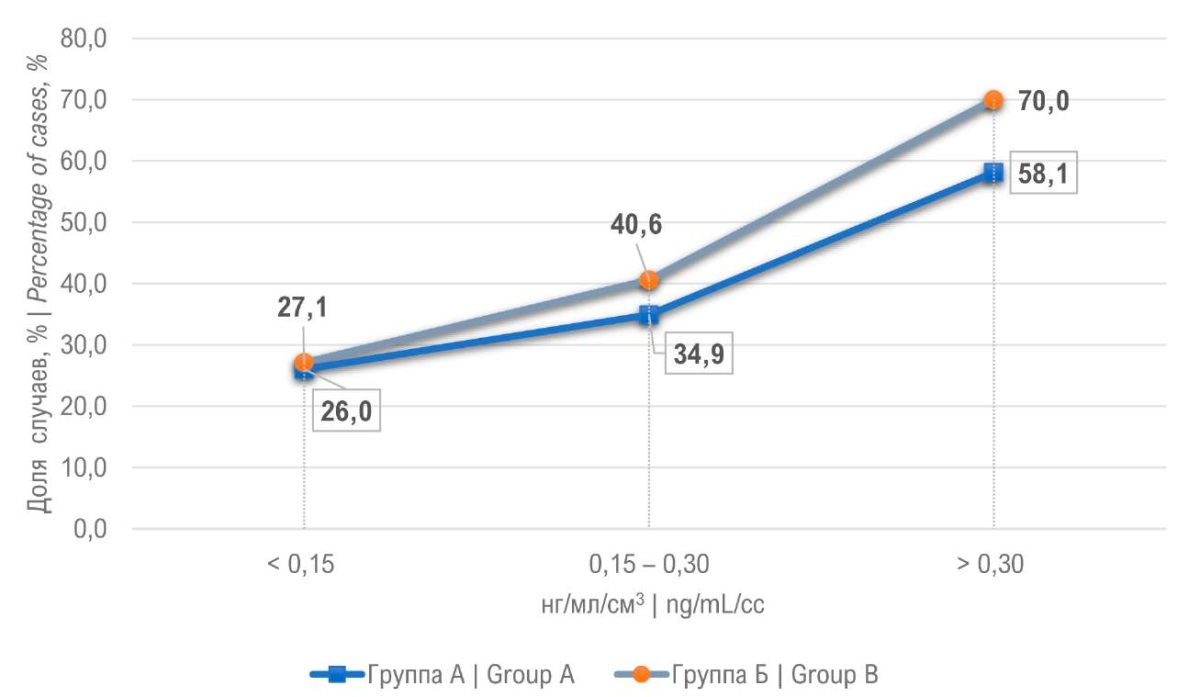
Рисунок 6. Диагностика рака предстательной железы в зависимости от плотности ПСА
Figure 6. Diagnosis of prostate cancer depending on the PSA density
Обсуждение
Использование аппарата ГС началось с 2006 года гинекологами для диагностики опухолей яичников. В исследовании чувствительность метода составила 98%, а специфичность 77% [7]. Для первого использования аппарата ГС в урологии использовали группу из 29 пациентов, у которых ранее был подтверждён диагноз РПЖ. Диагностику ГС делали до РПЭ, а затем сравнивали с послеоперационными гистологическими препаратами. В результате исследователи объявили, что локализация опухоли, её размеры и мультифокальность совпадает до 100%. ГС точно выявил очаги рака объёмом ≥ 0,50 мл [8]. Ю.Г. Аляев и соавт. оценили чувствительность и специфичность метода гистосканирования для пациентов с уровнем повышения ПСА < 10 нг/мл — 89 % и 96 % соответственно [9]. В работе V. Alvydas et al. (2020) была поставлена цель оценить эффективность выявления клинического значимого рака с помощью ГС. Были взяты данные у 200 пациентов, у которых уровень ПСА в сыворотке крови повышался в течение 4 месяцев после предыдущей отрицательной биопсии. Всем пациентам была проведена ГС и трансперинеальная биопсия с дополнительными прицельными биоптатами при выявлении подозрительного очага более 0,5 см³. Клинически значимый РПЖ был выявлен у 41 (20,5%) пациента при биопсии. Чувствительность ГС для диагностики составила 61,9% (95% ДИ 45,64 – 76,43) при специфичности 27,85% (95% ДИ 21 – 35,53). Положительная прогностическая ценность (PPV) и отрицательная прогностическая ценность (NPV) для ГС составили 18,57% (95% ДИ 15 – 22,76) и 73,33% (95% ДИ 63,45 – 81,33) соответственно [10]. В крупном метаанализе, опубликованном в World Journal of Urology в 2021 году, показали низкую точность ГС: чувствительность метода — 20% (95% ДИ 0,19 – 0,21), специфичность — 12% (0,11 – 0,13), AUC 0,12. 8 из 10 участников исследования не показали дополнительной ценности ГС. Точность ГС до оперативного вмешательства при сравнении с гистологией после РПЭ была относительно лучше, но все ещё остаётся очень низкой: чувствительность — 56% (95% ДИ 0,5 – 0,63), специфичность — 23% (95% ДИ 0,18 – 0,28), AUC 0,4. 9 из 12 исследований не показали какой-либо пользы от ГС [11].
По нашим данным, стандартная мультифокальная трансректальная биопсия под УЗИ контролем диагностирует РПЖ в 33,4% случаев, при этом ISUP 1 выявлялся реже, чем при биопсии с использованием ГС — 52,7%. Использование ГС позволяет увеличить выявляемость новообразований до 39,7%. В данной группе балл ISUP 1 повысился до 71,1%, что говорит об увеличении числа выявления высокодифференцированного РПЖ, который может не требовать активного хирургического лечения. Самая высокая частота выявления РПЖ отмечалась при ПСА более 20 нг/мл, объёме предстательной железы до 30 см³ и плотности ПСА более 30 нг/мл/см³. Использование ГС соизмеримо со стандартной биопсией повышает процент выявления рака при повышении ПСА. Однако выявлено, что при увеличении объёма простаты, диагностическая ценность использования гистосканирования уменьшается. Так при объёме предстательной железы более 60 см³ результаты РПЖ оказались соизмеримы со стандартной биопсией. Также ГС не показал лучших результатов при повторных биопсиях, РПЖ был выявлен в 25% обеих группах больных.
Заключение
Использование аппарата Histoscanningä улучшает диагностику рака предстательной железы, однако преимущественно за счёт группы ISUP 1. Выполнение только прицельных вколов нецелесообразно в связи с высоким процентом ложноотрицательных результатов. Показано проведение комбинированной биопсии простаты с обязательным забором таргетных биоптатов совместно со стандартными. Диагностическая точность ГС показала лучшие результаты при объёме предстательной железы до 60 см³.
Список литературы
1. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021. CA Cancer J Clin. 2021;71(1):7-33. Erratum in: CA Cancer J Clin. 2021;71(4):359. DOI: 10.3322/caac.21654.
2. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Под ред. Каприна А.Д., Старинского В.В., Шахзадовой А.О. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021.
3. Кельн А.А., Зырянов А.В., Суриков А.С., Пономарев А.В., Купчин А.В., Знобищев В.Г., Сальников М.А. Fusion-биопсия предстательной железы у пациентов с ранее отрицательной биопсией в анамнезе. Вестник урологии. 2017;5(4):39-46. DOI: 10.21886/2308-6424-2017-5-4-39-46
4. Loeb S, Vellekoop A, Ahmed HU, Catto J, Emberton M, Nam R, Rosario DJ, Scattoni V, Lotan Y. Systematic review of complications of prostate biopsy. Eur Urol. 2013;64(6):876-92. DOI: 10.1016/j.eururo.2013.05.049
5. Ukimura O, Coleman JA, de la Taille A, Emberton M, Epstein JI, Freedland SJ, Giannarini G, Kibel AS, Montironi R, Ploussard G, Roobol MJ, Scattoni V, Jones JS. Contemporary role of systematic prostate biopsies: indications, techniques, and implications for patient care. Eur Urol. 2013;63(2):214-30. DOI: 10.1016/j.eururo.2012.09.033
6. Геворкян А.Р., Молодцов М.С., Александров Е.В. Диагностика рака предстательной железы в рамках высокотехнологичной специализированной поликлинической медицинской помощи. Вестник урологии. 2023;11(1):26-33. DOI: 10.21886/2308-6424-2023-11-1-26-33
7. Lucidarme O, Akakpo JP, Granberg S, Sideri M, Levavi H, Schneider A, Autier P, Nir D, Bleiberg H; Ovarian HistoScanning Clinical Study Group. A new computer-aided diagnostic tool for non-invasive characterisation of malignant ovarian masses: results of a multicentre validation study. Eur Radiol. 2010;20(8):1822-30. DOI: 10.1007/s00330-010-1750-6
8. Braeckman J, Autier P, Garbar C, Marichal MP, Soviany C, Nir R, Nir D, Michielsen D, Bleiberg H, Egevad L, Emberton M. Computer-aided ultrasonography (HistoScanning): a novel technology for locating and characterizing prostate cancer. BJU Int. 2008;101(3):293-8. DOI: 10.1111/j.1464-410X.2007.07232.x
9. Глыбочко П.В., Аляев Ю.Г., Амосов А.В., Крупинов Г.Е., Обухов А.А., Ганжа Т.М., Амосов Н.А. Опыт применения аппарата Histoscanning в ранней диагностике рака предстательной железы. Онкоурология. 2012;8(1):72-76. DOI: 10.17650/1726-9776-2012-8-1-872-878
10. Vezelis Alvydas A, Platkevicius G, Kincius KM, Naruseviciute I, Ulys A, Jankevicius F. Prostate 3D ultrasound-guided imaging device (HistoScanning) performance detecting clinically significant prostate cancer. J BUON. 2020;25(1):460-463. PMID: 32277669
11. Morozov A, Kozlov V, Rivas JG, Teoh JY, Bezrukov E, Amosov A, Barret E, Taratkin M, Salomon G, Herrmann TRW, Gozen A, Enikeev D; collaboration between ESUT, ESUI and Uro-technology WP of the Young Academic Urologists. A systematic review and meta-analysis of Histoscanning™ in prostate cancer diagnostics. World J Urol. 2021;39(10):3733-3740. DOI: 10.1007/s00345-021-03684-8
Об авторах
С. В. КотовРоссия
Сергей Владиславович Котов — д-р мед. наук, профессор; заведующий кафедрой урологии и андрологии; врач-уролог урологического отделения; руководитель Университетской клиникой урологии, онкоурологии и андрологии
Москва
Р. И. Гуспанов
Россия
Ренат Иватуллаевич Гуспанов — канд. мед. наук; доцент кафедры урологии и андрологии; врач-уролог урологического отделения; врач-онколог 4-го онкологического отделения (онкоурологии)
Москва
С. А. Пульбере
Россия
Сергей Александрович Пульбере — д-р мед. наук, профессор кафедры урологии и андрологии
Москва
А. Г. Юсуфов
Россия
Анвар Гаджиевич Юсуфов — канд. мед. наук; доцент кафедры урологии и андрологии; заведующий урологическим отделением
Москва
А. Л. Хачатрян
Россия
Арам Левонович Хачатрян — канд. мед. наук; доцент кафедры урологии и андрологии
Москва
И. Ш. Бядретдинов
Россия
Ильдар Шамилевич Бядретдинов — аспирант, старший лаборант кафедры урологии и андрологии
Москва
М. С. Жилов
Россия
Максим Сергеевич Жилов — аспирант кафедры урологии и андрологии
Москва
Э. М. Алекберов
Россия
Эмиль Мушфигович Алекберов — ординатор кафедры урологии и андрологии
Москва
С. Л. Логвинова
Россия
Светлана Леонидовна Логвинова — студентка
Москва
Рецензия
Для цитирования:
Котов С.В., Гуспанов Р.И., Пульбере С.А., Юсуфов А.Г., Хачатрян А.Л., Бядретдинов И.Ш., Жилов М.С., Алекберов Э.М., Логвинова С.Л. Результаты использования аппарата HistoScanningTM для диагностики рака предстательной железы в сравнении со стандартной мультифокальной биопсией. Вестник урологии. 2023;11(4):62-71. https://doi.org/10.21886/2308-6424-2023-11-4-62-71
For citation:
Kotov S.V., Guspanov R.I., Pulbere S.A., Yusufov A.G., Khachatryan A.L., Badretdinov I.S., Zhilov M.S., Alekberov E.M., Logvinova S.L. HistoScanningTM vs. standard multifocal biopsy for prostate cancer diagnosis: a comparison of diagnostic methods. Urology Herald. 2023;11(4):62-71. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-4-62-71













































