Перейти к:
Синдром культи мочеточника после уретероуретероанастомоза, геминефрэктоми и нефрэктомии у детей
https://doi.org/10.21886/2308-6424-2020-8-4-32-43
Аннотация
Актуальность. Выполнение нефрэктомии (НЭ), геминефрэктомии (ГНЭ) и формирование ипсилатерального уретероуретероанастомоза (УУА) не исключает возможность сохранения дистального отдела мочеточника. Оставшаяся культя мочеточника может стать причиной формирования синдрома культи мочеточника (СКМ) в виде рецидивирующей инфекции мочевых путей (ИМП), гематурии, болевого синдрома и даже эмпиемы культи.
Цель исследования. Оценить частоту встречаемости и подходы к лечению в разных клиниках синдрома культи мочеточника (СКМ) у детей после НЭ, ГНЭ и УУА, выполненных с использованием открытого и лапароскопического доступов.
Материалы и методы. Исследование основано на результатах лечения 778 пациентов из 9 клиник РФ и Республики Беларусь, которым были проведены НЭ, ГНЭ и УУА открытым или лапароскопическим доступом в период с 1998 по 2020 год, у которых в результате операции мочеточник не удалялся полностью, была оставлена его культя. Открытый доступ использовали у 313 (40,2%) детей, лапароскопический — в 465 (59,8%) случаях. СКМ выявлен у 27(3,5%) пациентов. Удаление культи мочеточника проведено 26 (96,3%) детям. Открытое удаление культи мочеточника выполнено 11 (42,3%) пациентам, лапароскопическим доступом — 13 (50,0%) и везикоскопически — 2 (7,7%) детям.
Результаты. Среди пациентов с СКМ наблюдалось 12 мальчиков (44,4%) и 15 девочек (55,6%). СКМ выявлен справа у 13 (48,1%) детей, слева — у 14 (51,9%). Медиана возраста пациентов на момент выявления СКМ составила 25 [12; 42] месяцев. При первичной операции у 15 (55,6%) детей культя мочеточника была прошита и перевязана, у 4 (14,8%) — оставлена открытой после отсечения, у 8 (29,6%) не было указано, каким образом обработана культя. Рефлюкс в культю выявлен у 13 (48,1%) пациентов, СКМ на фоне обструкции — у 14 (51,9%) детей. При применении лапароскопического доступа частота СКМ ниже (9 (1,9%)), чем при открытых (18 (5,8%)) операциях (p < 0,004). У 85% больных с СКМ клинические проявления возникли в течение года после операции.
Выводы. СКМ — редкое осложнение (3,5% случаев) у пациентов, перенесших НЭ, ГНЭ и УУА с оставлением культи мочеточника. Проведение этих операций лапароскопическим доступом позволяет выполнить тотальную уретерэктомию и достоверно снижает вероятность развития СКМ.
Ключевые слова
Для цитирования:
Каганцов И.М., Щедров Д.Н., Сизонов В.В., Дубров В.И., Бондаренко С.Г., Кузовлева Г.И., Пирогов А.В., Сварич В.Г., Орлов В.М., Староверов О.В. Синдром культи мочеточника после уретероуретероанастомоза, геминефрэктоми и нефрэктомии у детей. Вестник урологии. 2020;8(4):32-43. https://doi.org/10.21886/2308-6424-2020-8-4-32-43
For citation:
Kagantsov I.V., Shchedrov D.N., Sizonov V.V., Dubrov V.I., Bondarenko S.G., Kuzovleva G.I., Pirogov A.V., Svarich V.G., Orlov V.M., Staroverov O.V. Ureteral stump syndrome after ureteroureteroanastomosis, heminephrectomy and nephrectomy in children. Urology Herald. 2020;8(4):32-43. (In Russ.) https://doi.org/10.21886/2308-6424-2020-8-4-32-43
Введение
Выраженное снижение дифференциальной почечной функции, развивающееся на фоне врождённых пороков мочевой системы у детей, является показанием к нефрэктомии. Наиболее часто значимое снижение функции почки наблюдается при пузырно-мочеточниковом рефлюксе (ПМР) высокой степени, обструкции уретеровезикального и пиелоуретерального сегментов, обструктивных уропатиях ассоциированных с удвоением верхних мочевых путей [1][2].
В арсенале хирургических методик имеются как традиционные открытые оперативные вмешательства (нефрэктомия (НЭ), геминефрэктомия (ГНЭ)), так и ставшая в последнее время распространённой методика наложения ипсилатерального уретероуретероанастомоза (УУА). В последние годы НЭ, ГНЭ и УУА всё чаще выполняются с использованием лапароскопического доступа (ЛД), что позволяет прецизионно и малотравматично удалить патологически изменённый мочеточник на всём протяжении [1][3][4]. При каждом из этих вмешательств, несмотря на технику и мастерство хирурга, не всегда удаётся полностью иссечь дистальный отдел мочеточника. Оставшаяся культя мочеточника может стать причиной рецидивирующей инфекции мочевых путей (ИМП), гематурии, болевого синдрома, формирования эмпиемы культи [5].
В данной работе ретроспективно проанализирована частота встречаемости и подходы к лечению в разных клиниках России и Белоруссии синдрома культи мочеточника (СКМ) у детей после НЭ, ГНЭ и УУА, выполненных с использованием открытого доступа (ОД) и лапароскопического доступа (ЛД).
Материалы и методы
Исследование основано на результатах лечения пациентов из 9 клиник, которым были проведены НЭ, ГНЭ и УУА открытым или лапароскопическим доступом в период с 1993 по 2020 год. Были проанализированы данные 773 детей, у которых в результате операции мочеточник не удалялся полностью, была оставлена его культя. Из них ОД прооперировано 313 (40,2%) детей, ЛД был использован в 465 (59,3%) случаях (табл. 1).
Таблица 1. Оперативные вмешательства выполненные с оставлением культи мочеточника
Table 1. Surgical interventions performed without removal of the ureteral stump
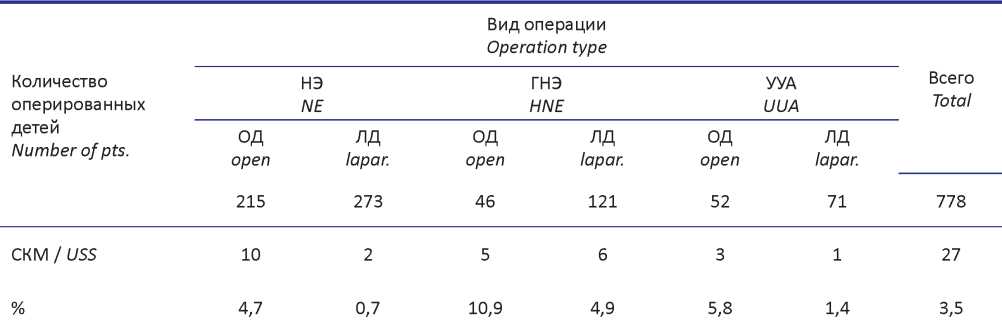
Примечания: НЭ — нефрэктомия; ГНЭ — геминефрэктомия; УУА — уретероуретероанастомоз; ОД — открытый доступ; ЛД — лапароскопический доступ; СКМ — синдром культи мочеточника.
Notes: NE — nephrectomy; HNE — heminephrectomy; UUA — ureteroureteroanastomosis; USS — ureteral stump syndrome.
НЭ выполнена 433 детям (ОД — 215, ЛД — 273). Показанием к проведению НЭ служила утрата почечной функции вследствие врождённых пороков мочевой системы (обструкция пиелоуретерального, везикоуретерального соустья, ПМР).
ГНЭ выполнена при удвоении почки с утратой или резким снижением функции одного из сегментов органа у 167 детей (ОД — 46, ЛД — 121).
УУА выполнен 123 пациентам (ОД — 52, ЛД — 71) с удвоением почки и гидронефрозом III - IV степени одной из половин по классификации SFU [6], недержанием мочи при внепузырной эктопии устья мочеточника и рецидивирующей ИМП, а также у пациентов с высокой степенью ПМР при сохранённой функции поражённого сегмента почки.
СКМ ретроспективно выявлен у 27 детей, что составило 3,5% от 773 операций. Ультразвуковое исследование (УЗИ) мочевых путей (рис. 1) и микционная цистография выполнены всем детям с СКМ (рис. 2), цистоскопия — 10 (37,0%) пациентам. Компьютерная томография для уточнения диагноза произведена 3 (11,1%) детям (рис. 3).
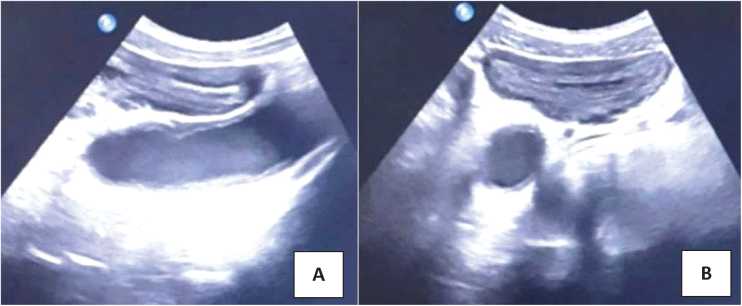
Рисунок 1. Изображение культи мочеточника в сагиттальной (А) и аксиальной (B) проекциях
Figure 1. Image of the ureteral stump in sagittal (A) and axial (B) projections
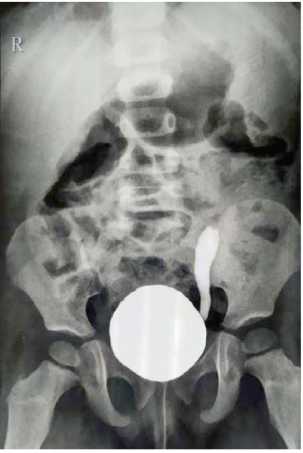
Рисунок 2. Пузырно-мочеточниковый рефлюкс в культю левого мочеточника
Figure 2. Vesicoureteral reflux in the left ureter stump
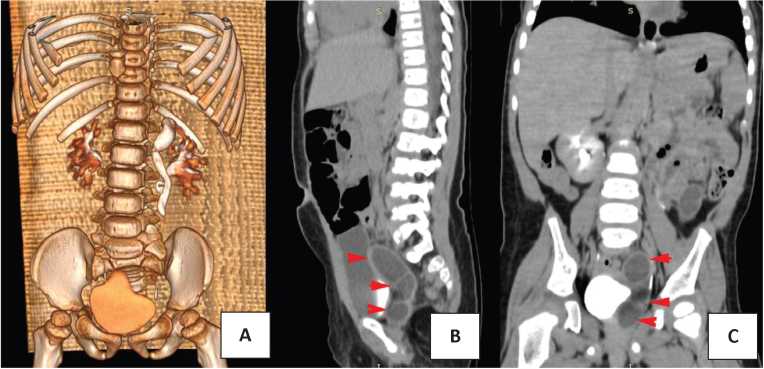
Рисунок 3. Изображение верхних мочевых путей через 6 месяцев после формирования верхнего уретероуретероанастомоза (А), в сагитальной (B) и фронтальной (C) проекциях. Красными стрелками указано изображение культи мочеточника нижней половины удвоенной левой почки
Figure 3. Image of the upper urinary tract 6 months after the formation of the upper ureteroureteroanastomosis (A), in sagittal projection (B) and in frontal projection (C). Red arrows indicate the image of the ureteral stump of the lower half of the duplicated left kidney
Удаление культи мочеточника проведено 26 (96,3%) детям. ОД и экстравезикальное выделение культи мочеточника выполнено 11 (42,3%) пациентам, при этом в одном случае при удвоенной почке одномоментно с удалением культи осуществлена экстравезикальная неоимплантация мочеточника в связи с возникшим ПМР IV степени в нижнюю половину почки после проведённой ранее ГНЭ верхнего полюса. Использовали ОД в надлобковой области с заинтересованной стороны. По боковой стенке мочевого пузыря визуализировали культю мочеточника с максимальным выделением её до интрамурального отдела, где проводили её отсечение после прошивания и перевязки. В двух случаях при выраженном рубцовом процессе одновременно проводили цистоскопию с введением цистоскопа через устье в культю, что позволяло визуализировать дистальный отдел мочеточника. В трёх случаях мочеточник нижнего сегмента и культи находились в едином фасциальном футляре, при этом разделение их было сопряжено с высоким риском повреждения мочеточника от нижнего полюса. В таких случаях проведена продольная резекция культи с оставлением части её стенки на здоровом мочеточнике. Операцию завершали дренированием паравезикального пространства на 1 - 2 дня и установкой катетера в мочевой пузырь на 3 - 7 дней.
Для удаления культи мочеточника у 13 (50,0%) детей применён ЛД. Пациента укладывали на спину с приподнятым тазом. Устанавливали три троакара: оптический — в параумбиликальной области, 2 рабочих — в подвздошных областях. Визуализировали культю мочеточника на уровне или ниже подвздошных сосудов и проводили её мобилизацию до интрамурального отдела (рис. 4), после чего культю отсекали с предварительным прошиванием и перевязкой. В брюшной полости оставляли страховой дренаж на 1 - 2 дня и в мочевой пузырь на 3 - 7 дней устанавливали катетер.
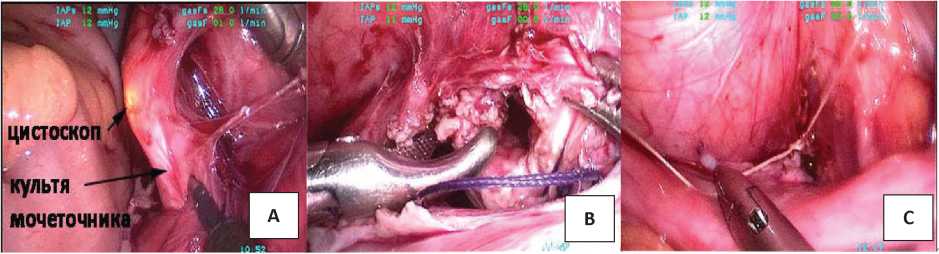
Рисунок 4. Этапы удаления культи мочеточника с использованием лапароскопического доступа: А — выделение культи мочеточника в предпузырном отделе (стрелка указывает на культю мочеточника с введённым в неё трансуретрально цистоскопом); B — культя мочеточника иссечена до места вхождения в мочевой пузырь; C — культя ушита с включением в шов детрузора
Figure 4. Stages of ureteral stump removal using laparoscopic access: A — laparoscopic isolation of the distal ureteral stump (the arrow points to the ureteral stump with a cystoscope inserted into it through urethra); B — ureteral stump is excised to the place where it fuse into the bladder; C — ureteral stump is sutured with the inclusion of the detrusor in the suture
Везикоскопический доступ (ВД) использован у 2 (7,7%) пациентов, при этом у одного ребёнка одномоментно с удалением культи была выполнена реимплантация мочеточника по Cohen в связи с сохраняющимся ПМР III степени в нижний полюс почки после проведённой ранее ГНЭ верхнего полюса. Ребёнка укладывали на спину с разведёнными в стороны ногами и подложенным под ягодицы валиком с целью создания наклона нижней части туловища таким образом, чтобы промежность была ротирована кверху и максимально приближена к горизонтальному положению. Под контролем цистоскопа и на фоне тугого наполнения мочевого пузыря стерильным физиологическим раствором осуществляли временную фиксацию мочевого пузыря к передней брюшной стенке. Используя крупную колющую или режущую иглу с 0/0, 2/0 или 3/0 нитью производили чрескожную фиксацию стенки мочевого пузыря к передней брюшной стенке тремя швами. Через переднюю брюшную стенку в мочевой пузырь, непосредственно над местами его фиксации вводили три троакара. Первый (5 мм) для оптики — в купол мочевого пузыря, примерно на середине расстояния между пупком и лоном; два манипуляционных (3 мм) — симметрично в правой и левой подвздошно-паховых областях. Мочевой пузырь опорожняли и наполняли углекислым газом, поддерживая его давление во время операции на уровне 10 - 12 мм рт. ст. В троакары вводили лапароскоп и манипуляторы. Визуализировали дистальный отдел расширенной культи, контурирующий в области тригонума, и над ним рассекали стенку мочевого пузыря с помощью крючка электрокоагуляции. Далее, используя электрокоагуляцию, преимущественно крючком постепенно выделяли культю и вводили её в просвет мочевого пузыря. После полного иссечения культи производили послойное ушивание дефекта детрузора и слизистой оболочки мочевого пузыря (рис. 5).
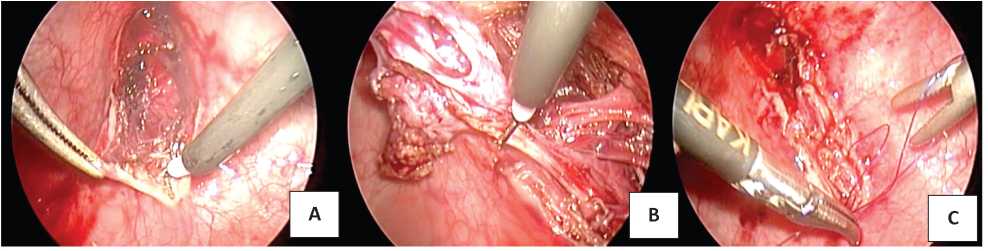
Рисунок 5. Этапы удаления культи мочеточника с использованием везикоскопического доступа: А — рассечение стенки мочевого пузыря; B — выделение и иссечение культи; C — послойное ушивание дефекта детрузора и слизистой оболочки мочевого пузыря
Figure 5. Stages of the ureteral stump removal using a vesicoscopic approach: A — dissection of the bladder wall; B — isolation and excision of the stump; C — layered suturing of the detrusor defect and the bladder mucosa
При удвоении мочеточников дополнительно производили неоимплантацию мочеточника здоровой половины почки по методике Cohen. Дренировали мочевой пузырь уретральным катетером на 7 дней. Троакары из полости мочевого пузыря удаляли, после чего накладывали швы на троакарные раны.
Методы статистического анализа: в качестве описательной статистики для количественных показателей использовали средние значения, стандартное отклонение, медианы и квартильный размах, для качественных - проценты. Статистический анализ качественных показателей производили с использованием точного теста Фишера. Критическое значение уровня статистической значимости принимали равным 0,05. Статистическая обработка результатов выполнялась в STATISTICA 12 (StatSoft, Inc, USA).
Результаты
Среди пациентов с СКМ было 12 мальчиков (44,4%), 15 девочек (55,6%). Правосторонняя локализация культи мочеточника определена у 13 (48,1%) детей, левосторонняя — у 14 (51,9%). Медиана возраста пациентов на момент госпитализации с СКМ составила 25 (12; 42) месяцев.
При первичной операции у 15 (55,6%) детей культя мочеточника была герметизирована путём прошивания и перевязки, у 4 (14,8%) — не герметизирована и оставлена открытой после отсечения, у 8 (29,6%) — не было указано каким образом обработана культя.
Из 27 случаев СКМ рефлюкс в культю выявлен у 13 (48,1%) пациентов, культя на фоне обструкции уретеровезикального соустья — у 14 (51,9%) детей.
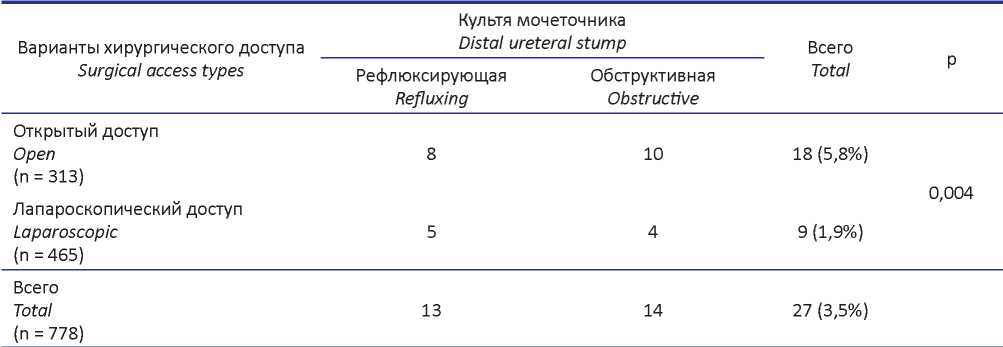
Ретроспективный анализ показал, что при применении лапароскопического доступа частота СКМ достоверно ниже, чем при открытых операциях (табл. 2).
Таблица 2. Частота формирования синдрома культи мочеточника в зависимости от варианта хирургического доступа
Table 2. Frequency of ureteral stump syndrome formation depending on the type of surgical access
Клинические симптомы СКМ проявились в первые 1 - 3 месяца после первичной операции у 13 (48,1%) детей, через 4 - 12 месяцев — у 10 (37,1%) пациентов, через 1 - 3 года — у 2 (7,4%), у 2 (7,4%) — через 6 - 8 лет после хирургического вмешательства.
Таким образом, у 85% больных клинические проявления СКМ возникли в течение года после проведённой операции с оставлением дистальной культи мочеточника и проявлялись в виде ИМП (23 / 85,2%) с повышением температуры до фебрильных цифр (14 / 51,9%), болевого синдрома в нижних отделах живота (4 / 14,9%), дизурии (9 / 33,3%).
По данным УЗИ, культя мочеточника была визуализирована в виде жидкостного образования сбоку от мочевого пузыря у 19 (70,4%) пациентов, у остальных детей УЗИ картина была неинформативной. При проведении микционной цистоуретрографии ПМР в культю мочеточника выявлен в 13 (48,1%) случаях.
По данным цистоскопии, у 6 (22,2%) детей выявлена культя с расширенным устьем, позволяющем ввести цистоскоп (9,8Ch) в её просвет, у 3 (11,1%) выявлено обструктивное устье, в просвет которого не представлялось возможным завести мочеточниковый катетер или проводник. У одного ребёнка (3,7%) с резко суженным устьем культи мочеточника и гнойным отделяемым из него удалось провести мочеточниковый катетер и произвести рассечение и бужирование устья. В дальнейшем в течение 7 дней дренирование полости культи происходило с помощью оставленного в её просвете катетера. После купирования воспалительного процесса и удаления катетера ребёнок был выписан и приглашён на плановое оперативное вмешательство (удаление культи мочеточника) через 3 месяца, но для дальнейшего лечения пациент не явился.
Медиана времени операции при ОД удаления культи мочеточника составила 87 [60,0; 121,3] минут, при ЛД и ВД - 90 [81,3; 131,8] минут.
Интраоперационных осложнений при удалении культи мочеточника не отмечено. В раннем послеоперационном периоде подтекание мочи по дренажу (Clavien I) отмечено у 1 (3,8%) пациента после открытого экстрапузырного выделения культи. Подтекание мочи купировалось самостоятельно в течение 7 суток после операции.
Обострение пиелонефрита (Clavien I) после операции возникло у 2 (7,7%) детей. Нормализация общего анализа мочи и купирование бактериурии у 25 пациентов произошло в течение 2 месяцев после удаления культи. Клинических и лабораторных проявлений ИМП после нормализации анализов мочи и купирования бактериурии у них не отмечено.
У одного (3,8%) пациента через 2 года после удаления культи выявлено сохраняющее уретероцеле значимых размеров (Clavien III), обусловливающее периодическое обострение ИМП. Данному пациенту проведено иссечение уретероцеле с использованием везикоскопического доступа. В дальнейшем при наблюдении в течение 12 месяцев у ребёнка отмечено купирование ИМП.
Реносонография через 6 и 12 месяцев после операции была выполнена 26 (100%) детям. Расширения чашечно-лоханочной системы и изменений со стороны верхних и нижних мочевых путей не выявлено ни в одном случае.
По данным нефросцинтиграфии через год после удаления культи мочеточника 11 пациентам, у которых первичной операцией была ГНЭ, отсутствовала отрицательная динамика функции оставленного сегмента почки. У 4 детей, которым потребовалось удаление культи после УУА, отсутствовала отрицательная динамика функции поражённого сегмента почки, диуретическая проба у всех была отрицательная.
Таким образом, после удаления культи мочеточника у 26 пациентов осложнения возникли у 4 (15,4%) детей, при этом повторное вмешательство потребовалось только 1 (3,8%) ребёнку. По классификации Clavien, у всех 4 пациентов были осложнения, не повлиявшие на результат лечения.
Обсуждение
Потеря или значимое снижение функции почки при врождённых пороках мочевыделительной системы в ряде случаев требует проведения НЭ [1], а при удвоенной почке - ГНЭ или УУА в качестве операции, восстанавливающей уродинамику одного из полюсов удвоенной почки [4][7].
При проведении данных операций есть полярные мнения, как необходимо поступать в отношении дистального отдела мочеточника. Сторонники полного удаления мочеточника объясняют его необходимость риском возникновения СКМ, характеризирующего фебрильной ИМП, болью в нижних отделах живота, гематурией [5][8][9]. Оппоненты тотальной уретерэктомии считают, что СКМ встречается редко и необходимости в проведении дополнительного разреза для удаления дистальной части мочеточника нет [10]. Одним из аргументов сторонников субтотальной уретерэктомии является то, что при полном удвоении почки здоровый мочеточник остаётся нетронутым, в результате не возникает риск нарушения его кровоснабжения при мобилизации дистальной части патологического мочеточника [11].
В нашем исследовании СКМ был выявлен у 3,5%, что ниже данных, приводимых другими авторами [5][8][9].
В отдельных публикациях сообщается, что СКМ развивался чаще при ПМР в культю мочеточника [12]. R. Persad et al. сообщили о 8 случаях СКМ после НЭ при повреждении почки рефлюксом, при этом авторы не встретили ни одного ребёнка с СКМ при обструкции УВС. На основании этого авторы сделали вывод, что удаление мочеточника требуется только если до операции НЭ или ГНЭ был выявлен ПМР [13]. В нашем исследовании СКМ в равной мере встречался при ПМР в культю мочеточника и при наличии обструкции или эктопии устья.
Одним из спорных вопросов является зависимость между длиной оставляемой культи мочеточника и частотой возникновения СКМ. Долгое время существовало мнение, озвученное в разных публикациях как: "Take the ureter as far down as you can" («Возьмите мочеточник как можно ниже, насколько вы это можете») [14]. Однако есть работы, в которых показано отсутствие статистического подтверждения вероятности возникновения СКМ от длины оставляемой дистальной культи мочеточника [15][16].
Для удаления мочеточника на всем протяжении при открытом проведении НЭ, ГНЭ и УУА требуется дополнительный разрез, что значительно увеличивает травматичность хирургического вмешательства. Учитывая редкость возникновения СКМ в большинстве случаев открытого вмешательства целесообразность дополнительного разреза становится сомнительной. При выполнении лапароскопического вмешательства мочеточник доступен практически на всем протяжении и, таким образом, возможно его полное удаление, без существенного увеличения травматичности операции. В проведённом нами исследовании доказано, что при использовании ЛД, частота возникновение СКМ ниже, чем после открытых операций (1,9% и 5,8% соответственно).
При сравнении результатов проведения ГНЭ ЛД и ретроперитонеоскопическими доступом было доказано, что лапароскопия имеет преимущества, так как позволяет максимально выделить и удалить мочеточник. При ретроперитонеоскопическом доступе имеется ограниченное пространство для мобилизации мочеточника в дистальном направлении и вследствие этого чаще выявляется СКМ [17][18].
Бессимптомные культи мочеточника в большинстве своём не требуют оперативного лечения. R.S. Malek et al. обосновывают это тем, что после НЭ мышечный слой и слизистая неудалённой части мочеточника подвергаются в большинстве случаев атрофии, тогда как при СКМ отмечается выраженная гипертрофия и фиброз мышечной ткани мочеточника [15].
При возникновении СКМ встаёт вопрос о выборе способа лечения. Традиционным способом решения данной проблемы является оперативное лечение из пахового доступа с экстрапузырным выделением культи до мочевого пузыря и её удалением. Ряд авторов в своих работах сообщают о высоком успехе данного подхода к лечению СКМ [2][4][5]. Использование открытого экстрапузырного доступа привело к излечению у 13 наших пациентов с СКМ.
Развитие малоинвазивных методик в хирургии не обошло стороной и проблему лечения СКМ. K.N. Bullock et al. в 1985 году сообщили об успешном устранении ПМР в культю мочеточника после НЭ у 43-летнего пациента путём эндоскопического введения в область устья тефлоновой пасты [19]. Авторы из Ирландии сообщили о двух аналогичных случаях успешного введения тефлона в устье культи [8]. M. Perez-Brayfield et al. излечили шесть пациентов эндоскопической инъекцией декстраномера гиалуроновой кислоты при рефлюксе в культю мочеточника [20].
R.M. Ehrlich et al. в качестве лечения СКМ при эктопии устья предложили в просвет культи вводить специальный зонд и обрабатывать её внутри при помощи коагуляции, сообщая о безопасности и высокой эффективности метода [21]. D. Ikeda et al. видоизменили эту методику и предварительно выполняли трансуретральное рассечение и расширение устья культи, после чего обрабатывали её изнутри шариковым электродом [22]. P. Casale et al. впервые сообщили об успешном удалении культи мочеточника у 4 пациентов ЛД [16]. В последующем было опубликовано ещё две работы с описанием отдельных случаев удаления культи мочеточника лапароскопически [23][24]. В нашей серии у 13 пациентов культя мочеточника была удалена ЛД. При этом мы ни разу не отметили сложностей выделения дистального отдела мочеточника, которые бы привели к конверсии. В 2-х случаях мы использовали ВД, в доступной нам литературе мы не встретили сообщений об использовании этого доступа для удаления культи мочеточника.
Заключение
СКМ - редкое осложнение (3,5% случаев) у пациентов, перенесших НЭ, ГНЭ и УУА с оставлением культи мочеточника. Проведение этих операций ЛД позволяет выполнить тотальную уретерэктомию и достоверно снижает вероятность развития СКМ. В то же время при возникновении СКМ лапароскопический и везикоскопический доступы безопасны и эффективны и могут быть использованы для успешного удаления культи мочеточника.
Список литературы
1. Сизонов В.В. Возрастная характеристика гидронефроза в аспекте выбора пиелопластики или нефрэктомии. Детская хирургия. 2008;(2):26-28. eLIBRARY ID: 23077083
2. Логваль А.А., Каганцов И.М., Дубров В.И. Малоинвазивная хирургия в лечении патологических состояний при полном удвоении почки у детей. Экспериментальная и клиническая урология. 2017;(2):128-133. eLIBRARY ID: 29899592
3. Каганцов И.М., Сизонов В.В., Дубров В.И., Бондаренко С.Г., Акрамов Н.Р., Шмыров О.С., Кузовлева Г.И., Суров Р.В., Логваль А.А. Первый опыт уретероуретероа-настомоза (уретеропиелоанастомоза) при удвоенной почке у детей. Вестник урологии. 2017;5(4):29-38. DOI: 10.21886/2308-6424-2017-5-4-29-38
4. Каганцов И.М., Сизонов В.В., Дубров В.И., Бондаренко С.Г., Акрамов Н.Р., Шмыров О.С., Кузовлева Г.И., Марков Н.В., Саблин Д.Е., Суров Р.В., Пирогов А.В., Логваль А.А. Лапароскопическая геминефруретерэктомия при удвоенной почке у детей. Урология. 2017;(5):69-74. DOI: 10.18565/urology.2017.5.69-74
5. Agarwal D, Kandpal DK, Chowdhary SK. Laparoscopic ipsilateral ureteroureterostomy for the management of children with duplication anomalies. J Indian Assoc Pediatr Surg. 2016;21(2):92-93. DOI: 10.4103/0971-9261.158094
6. Nguyen HT, Herndon CD, Cooper C, Gatti J, Kirsch A, Ko-korowski P, Lee R, Perez-Brayfield M, Metcalfe P, Yerkes E, Cendron M, Campbell JB. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. Pediatr Urol. 2010;6(3):212-31. DOI: 10.1016/j.jpurol.2010.02.205
7. Каганцов И.М., Сизонов В.В., Дубров В.И., Бондаренко С.Г., Акрамов Н.Р., Шмыров О.С., Кузовлева Г.И., Суров Р.В., Логваль А.А. Уретероуретероанастомоз (уретеропи-елоанастомоз) при удвоении верхних мочевыводящих путей у детей. Урология. 2018;(2):83-88. DOI: 10.18565/urology.2018.2.83-88
8. De Caluwe D, Chertin B, Puri P. Fate of the retained ureteral stump after upper pole heminephrectomy in duplex kidneys. J Urol. 2002;168(2):679-80. DOI: 10.1097/00005392200208000-00076
9. Ade-Ajayi N, Wilcox DT, Duffy PG, Ransley PG. Upper pole heminephrectomy: is complete ureterectomy necessary? BJU Int. 2001;88(1):77-9. DOI: 10.1046/j.1464-410x.2001.02249.x
10. Chandrasekharam V, Jayaram H. Laparoscopic ipsilateral ureteroureterostomy for the management of children with duplication anomalies. J Indian Assoc Pediatr Surg. 2015;20(1):27-31. DOI: 10.4103/0971-9261.145442
11. Kim KS, Kim Y, Oh SJ. Natural history of refluxing distal ureteral stumps following upper tract surgery in children with ectopic ureter or ureterocele. Urol Int. 2001;67(2):142-6. DOI: 10.1159/000050970
12. Amar AD. Refluxing ureteral stump: reservoir of urinary infection. J Urol. 1964;91:493-5. DOI: 10.1016/s0022-5347(17)64158-2
13. Persad R, Kamineni S, Mouriquand PD. Recurrent symptoms of urinary tract infection in eight patients with refluxing ureteric stumps. Br J Urol. 1994;74(6):720-2. DOI: 10.1111/j.1464-410x.1994.tb07113.x
14. Androulakakis PA, Stephanidis A, Antoniou A, Christopho-ridis C. Outcome of the distal ureteric stump after (hemi) nephrectomy and subtotal ureterectomy for reflux or obstruction. BJU Int. 2001;88(6):586-9. DOI: 10.1046/j.1464-4096.2001.02385.x
15. Malek RS, Moghaddam A, Furlow WL, Greene LF. Symptomatic ureteral stumps. J Urol. 1971;106(4):521-8. DOI: 10.1016/s0022-5347(17)61332-6
16. Casale P, Grady RW, Lee RS, Joyner BD, Mitchell ME. Symptomatic refluxing distal ureteral stumps after nephroureter-ectomy and heminephroureterectomy. What should we do? J Urol. 2005;173(1):204-6; discussion 206. DOI: 10.1097/01.ju.0000147849.80627.41
17. Esposito C, Varlet F, Patkowski D, Castagnetti M, Escolino M, Draghici IM, Settimi A, Savanelli A, Till H. Laparoscopic partial nephrectomy in duplex kidneys in infants and children: results of an European multicentric survey. Surg Endosc. 2015;29(12):3469-76. DOI: 10.1007/s00464-015-4096-y
18. Escolino M., Farina A., Turra F., Cerulo M., Esposito R., Sa-vanelli A., Settimi A., Esposito C. Evaluation and outcome of the distal ureteral stump after nephro-ureterectomy in children. A comparison between laparoscopy and retroperitoneoscopy. J. of Ped. Urol. 2016;12,1191-8. DOI: 10.1016/j.jpurol.2015.10.007
19. Bullock KN, Deane AM, Ashken MH. Endoscopic Teflon injection for a refluxing ureteric stump after simple nephrectomy. Br Med J (Clin Res Ed). 1985;290(6475):1109. DOI: 10.1136/bmj.290.6475.1109
20. Perez-Brayfield M, Kirsch AJ, Hensle TW, Koyle MA, Furness P, Scherz HC. Endoscopic treatment with dextra-nomer/hyaluronic acid for complex cases of vesicoureteral reflux. J Urol. 2004;172:1614-6. DOI: 10.1097/01.ju.0000139013.00908.1c
21. Ehrlich RM, Koyle MA, Shanberg AM. A technique for ureteral stump ablation. J Urol. 1988;140(5 Pt 2):1240-1241. DOI: 10.1016/s0022-5347(17)42012-x
22. Ikeda D, Matsutani R, Fukuda M, Fuse H, Hirano S. Transurethral fulguration for empyema of ectopic ureteral stump. Int. J. Urol. 2003;10(12), 664-666. DOI: 10.1046/j.1442-2042.2003.00714.x
23. Labairu-Huerta L, Burguete-Moriones A, Zabalza-Unzuё J, Grasa-Lanau V. Empiema del munon ureteral. A proposito de un caso y revision de la literatura [Ureteral stump empyema. A report of a case and review of the literature]. Actas Urol Esp. 201034(10):909-11. (In Spanish) PMID: 21159294
24. Alenezi H, Eltiraifi AE, Alomar M. Minimally invasive surgery for the treatment of ureteral stump syndrome. Urol Ann. 2015;7(4):454-8. DOI: 10.4103/0974-7796.150491
Об авторах
И. М. КаганцовРоссия
Каганцов Илья Маркович — доктор медицинских наук, доцент; профессор кафедры хирургических болезней СГУ им. Питирима Сорокина; заведующий отделением урологии РДКБ г. Сыктывкар.
167004, Республика Коми, Сыктывкар, ул. Пушкина, д. 116/6; 167001, Республика Коми, Сыктывкар, пр-т. Октябрьский, д. 55.
тел.: +7 (912) 861-23-41
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Д. Н. Щедров
Россия
Щедров Дмитрий Николаевич — кандидат медицинских наук; заведующий урологическим отделением.
150042, Ярославль, Тутаевское шоссе, д. 27.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. В. Сизонов
Россия
Сизонов Владимир Валентинович — доктор медицинских наук, доцент; профессор кафедры урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии) РостГМУ Минздрава России; заведующий детским уроандрологическим отделением ОДКБ г. Ростов-на-Дону.
344015, Ростов-на-Дону, ул.339-й Стрелковой Дивизии, д.14.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. И. Дубров
Беларусь
Дубров Виталий Игоревич — кандидат медицинских наук; руководитель республиканского центра детской урологии, заведующий отделением урологии.
220020, Минск, ул. Нарочанская, д. 17.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
С. Г. Бондаренко
Россия
Бондаренко Сергей Георгиевич — кандидат медицинских наук; заведующий отделением детской урологии.
400002, Волгоград, ул. Казахская, д. 1.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Г. И. Кузовлева
Россия
Кузовлева Галина Игоревна — кандидат медицинских наук; детский уролог-андролог отделения урологии-андрологии.
123317, Москва, Шмитовский пр-д, д. 29.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. В. Пирогов
Россия
Пирогов Александр Владимирович — заведующий детским урологическим отделением.
414011, Астрахань, ул. Медиков, д. 6.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. Г. Сварич
Россия
Сварич Вячеслав Гаврилович — доктор медицинских наук; профессор кафедры хирургии СГУ им. Питирима Сорокина; заведующий отделением хирургии РДКБ г. Сыктывкар.
167004, Республика Коми, Сыктывкар, ул. Пушкина, д. 116/6; 167001, Республика Коми, Сыктывкар, пр-т. Октябрьский, д. 55.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. М. Орлов
Россия
Орлов Владимир Михайлович — кандидат медицинских наук; детский уролог-андролог детского уроандрологическим отделением ГБУ РО «ОДКБ»
344015, Ростов-на-Дону, ул.339-й Стрелковой Дивизии, д.14.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
О. В. Староверов
Россия
Староверов Олег Васильевич — кандидат медицинских наук, заведующий отделением урологии-андрологии.
123317, Москва, Шмитовский пр-д, д. 29.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Каганцов И.М., Щедров Д.Н., Сизонов В.В., Дубров В.И., Бондаренко С.Г., Кузовлева Г.И., Пирогов А.В., Сварич В.Г., Орлов В.М., Староверов О.В. Синдром культи мочеточника после уретероуретероанастомоза, геминефрэктоми и нефрэктомии у детей. Вестник урологии. 2020;8(4):32-43. https://doi.org/10.21886/2308-6424-2020-8-4-32-43
For citation:
Kagantsov I.V., Shchedrov D.N., Sizonov V.V., Dubrov V.I., Bondarenko S.G., Kuzovleva G.I., Pirogov A.V., Svarich V.G., Orlov V.M., Staroverov O.V. Ureteral stump syndrome after ureteroureteroanastomosis, heminephrectomy and nephrectomy in children. Urology Herald. 2020;8(4):32-43. (In Russ.) https://doi.org/10.21886/2308-6424-2020-8-4-32-43













































