Перейти к:
Динамическая оценка гистоморфологических и функциональных изменений в почках экспериментальных животных при ударно-волновом воздействии
https://doi.org/10.21886/2308-6424-2025-13-4-14-24
Аннотация
Введение. Проблема сопутствующего повреждения почечной паренхимы при дистанционном ударно-волновом воздействии (ДУВВ) на камни почек до сих пор сохраняет актуальность ввиду отсутствия единой концепции механизма повреждения почечной паренхимы.
Цель исследования. Уточнить механизмы повреждения и защиты почки при ДУВВ с учётом гистоморфологических и функциональных изменений у экспериментальных животных.
Материалы и методы. Исследование проводили на 50 половозрелых нелинейных белых крысах, самцах весом 240 – 290 г. Животные были рандомизированы в 2 группы: группа интактных животных (группа сравнения, n = 10) и группа животных, которым проводили однократное ДУВВ (n = 40). В дальнейшем животным после ДУВВ на 1-е (n = 10), 3-и (n = 10), 7-е (n = 10), 14-е (n = 10) сутки под общим наркозом проводили эвтаназию путём декапитации. Для исследования производили забор крови путём пункции сердца. Почку, подвергшуюся ДУВВ, использовали для приготовления гомогената и гистоморфологических исследований. Были изучены маркёры свободнорадикального окисления: белковые карбонильные группы (БКГ) и малоновый диальдегид (МДА), отражающие степень повреждения канальцевого эпителия почки. Также в почечном гомогенате определяли ферменты антиоксидантной защиты (АОЗ), такие как супероксиддисмутаза (СОД), глутатионпероксидаза (ГПО), глутатионредуктаза (ГР), глутатион восстановленный (GSH), отражающие степень антиоксидантной защиты почки. Функциональные нарушения почек экспериментальных животных после ДУВВ оценивали по мочевине и креатинину в сыворотке крови. Гистоморфологическую оценку изменений в почках под воздействием ДУВВ осуществляли при заборе материала на 1-е, 3-и, 7-е, 14-е сутки после ДУВВ. Изъятый материал подвергали светооптическому и микроскопическому исследованию.
Результаты. После ДУВВ на почку с 1-го по 3-й день происходит активация процессов свободнорадикального окисления белков и липидов нефроэпителия (белковые карбонильные группы, малоновый диальдегид), снижение активности ферментов антиоксидантной защиты (супероксиддисмутаза, глутатионпероксидаза, глутатионредуктаза, восстановленный глутатион (GSH)), что в итоге приводит к мембранодеструктивным изменениям, гибели клеток нефроэпителия, альтерации ткани почки. На 7-е сутки выраженные гистоморфологические изменения способствуют нарушению функции почек, что проявляется увеличением мочевины и креатинина в сыворотке крови. Только на 14-е сутки маркёры повреждения почки и её гистоморфологическая структура и функциональная способность почек приближаются к норме. Анализ показателей свободнорадикального окисления белков и липидов нефроэпителия, оценка активности антиоксидантных ферментов и функциональной способности почек, а также гистоморфологические изменения после ДУВВ на 1-е, 3-и, 7-е, 14-е дни исследования позволили уточнить механизм и этапы повреждения и восстановления структурно-функциональных параметров почек экспериментальных животных.
Заключение. Выявлены механизмы и временные этапы повреждения и восстановления почки после ДУВВ у экспериментальных животных.
Ключевые слова
Для цитирования:
Клочков В.В., Клочков А.В., Белый Л.Е., Давидян Т.Х. Динамическая оценка гистоморфологических и функциональных изменений в почках экспериментальных животных при ударно-волновом воздействии. Вестник урологии. 2025;13(4):14-24. https://doi.org/10.21886/2308-6424-2025-13-4-14-24
For citation:
Klochkоv V.V., Klochkоv A.V., Belyi L.E., Davidyan T.Kh. Renal response to shock wave exposure in experimental animals: dynamic histomorphological and functional evaluation. Urology Herald. 2025;13(4):14-24. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-14-24
Введение
Мочекаменная болезнь (МКБ), или уролитиаз, — широко распространённое во всём мире заболевание. Ежегодная заболеваемость уролитиазом в мире составляет 0,5 – 5,5%, а в некоторых странах и эндемичных по МКБ районах — до 13 – 20% [1 – 4]. В структуре общей урологической патологии МКБ занимает второе место после инфекции мочевых путей [5]. На долю больных МКБ приходится от 30 до 50% всего контингента урологических стационаров [6]. Абсолютное число зарегистрированных пациентов с МКБ в РФ в 2012 году составило 787 555 человек, а показатель числа зарегистрированных больных на 100 000 всего населения был равен 550,5. По сравнению с 2002 годом прирост абсолютного числа пациентов с МКБ составил + 25,1% [7]. В связи с длительными сроками реабилитации пациентов и потерей трудоспособности МКБ представляет собой актуальную медицинскую и социальную проблему.
За последние несколько десятков лет достигнуты значительные успехи в дезинтеграции конкрементов за счёт применения неинвазивных и малоинвазивных методик. Дистанционная ударно-волновая литотрипсия (ДУВЛ) как монотерапия используется для лечения камней в почках с 80-х годов прошлого столетия, несмотря на активное внедрение в клиническую практику методов ретроградной интраренальной хирургии и перкутанной нефролитотрипсии [8 – 10].
ДУВЛ, являющаяся альтернативным подходом в хирургии уролитиаза, как любая операция, не лишена осложнений. Ударная волна при любом типе применяемого аппаратного воздействия неизбежно приводит к повреждению почки [11 – 13].
Проблема сопутствующего повреждения почечной паренхимы при проведении ДУВЛ камней почек до сих пор остаётся актуальной и нерешённой.
Отсутствие единой концепции механизма повреждения почечной паренхимы при проведении ДУВЛ камней почек, недооценка осложнений, неясность в периодичности этапов лечения, недостаток биомаркёров, ориентированных на раннюю диагностику повреждения почки, объясняют сохраняющуюся актуальность продолжающихся исследований.
Цель исследования: уточнить механизмы повреждения и защиты почки при ударно-волновом воздействии с динамической оценкой гистоморфологических и функциональных изменений у экспериментальных животных.
Материалы и методы
Дизайн исследования: рандомизированное, одномоментное, проспективное, когортное исследование, метод — случай-контроль. Исследование проведено на 50 половозрелых нелинейных белых крысах, самцах весом 240 – 290 г. Все эксперименты на животных проводили в соответствии с рекомендациями FELASA и соответствующими национальными законами (Российская Федерация, №498-ФЗ 27.12.2018) о защите и гуманном обращении с животными. Протокол исследования был одобрен локальным независимым этическим комитетом Ул ГУ ИМЭ и ФК №12 от 01.12.2022.
Животные были рандомизированы в две группы: группа 1 — интактные животные (группа сравнения — n = 10), группа 2 (n = 40) — животные, которым проводили однократно дистанционное ударно-волновое воздействие (ДУВВ).
Животных наркотизировали введением тиопентала натрия (50 мг/кг внутрибрюшинно). После наступления наркотического сна у животного тщательно выбривали место входа ударной волны в проекции левой почки на спине, смазывали тонким слоем вазелина, крысу фиксировали на специальном ложементе, под ультразвуковым контролем левую почку совмещали с фокусом ударной волны. ДУВВ проводили в соответствии с рекомендуемыми параметрами для лабораторных животных: амплитуда давления — от 300 до 1000 атм., длительность импульса — менее 0,8 мкс, величина энергии — от 3,5 до 7,8 Дж, напряжение генератора — 0,5 кВ, количество импульсов — 1000. Процедуру выполняли однократно на литотрипторе Lithostar-plus («Siemens Healthineers AG», Erlangen, Germany) с электромагнитной генерацией ударных волн, продолжительность сеанса составляла 7 минут.
В дальнейшем под общим наркозом осуществляли эвтаназию животных путём декапитации на 1-е (n = 10), 3-и (n = 10), 7-е (n = 10), 14-е (n = 10) сутки после ДУВВ. Для исследования производили забор крови путём пункции сердца, левую почку использовали для приготовления гомогената.
Для приготовления общей цитоплазматической фракции почку растирали в гомогенезаторе Potter с буфером, содержащим 0,1 М раствор KCI, 1 мМ раствор этилендиаминтетрауксусной кислоты, 20 мМ раствор Трис-HCI (pH = 7,0), далее экстракт центрифугировали при 10000 g, супернатант разливали по пластиковым пробиркам V = 0,2 мл и хранили до использования при t = – 200 ºC.
У подопытных животных, которых подвергали ДУВВ, в гомогенате почек были изучены маркёры свободнорадикального окисления: (белковые карбонильные группы (БКГ), малоновый диальдегид (МДА), отражающие степень повреждения канальцевого эпителия почки. Также в почечном гомогенате исследовали содержание ферментов, отражающих степень антиоксидантной защиты (АОЗ) почки, такие как супероксиддисмутаза (СОД), глутатионпероксидаза (ГПО), глутатион восстановленный (GSH), глутатионредуктаза (ГР).
Для гистоморфологической оценки в почках забор материала производили на 1-е (n = 10), 3-и (n = 10), 7-е (n = 10), 14-е (n = 10) сутки после ДУВВ. Изъятый материал подвергали светооптическому и микроскопическому исследованию. Микроскопию проводили в проходящем свете с помощью бинокулярного микроскопа AxioStar Plus ("Carl Zeiss AG", Oberkochen, Germany). Материал окрашивали с помощью общепринятых методик гематоксилином и эозином, пикрофуксином по van Gieson. При морфологическом исследовании основное внимание обращали на варианты проявления альтеративных изменений, которые отражали выраженность повреждающего действия сфокусированных ударных волн. В качестве альтеративных изменений мы оценивали различные виды дистрофии, проявления некроза и некробиоза, а также сосудистые нарушения в виде полнокровия сосудов микроциркуляторного русла, отёка и кровоизлияний. С позиций обратимости и необратимости патологических изменений в почке после ДУВВ мы оценивали степень воздействия сфокусированных ударных волн в динамике.
Статистический анализ. Статистическую обработку результатов проводили с использованием пакета Statistica v.10.0 ("StatSoft Inc.", Tulsa, OK, USA). Нормальность распределения проверяли с помощью теста Shapiro-Wilk. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). Достоверность различий между показателями оценивали t-критерием Fisher-Student. При значении р < 0,05 различия считали статистически достоверными.
Результаты
Маркёры свободнорадикального окисления в гомогенате ткани почки экспериментальных животных после ДУВВ в динамике представлены в таблице 1.
Таблица 1. Маркёры свободнорадикального окисления в гомогенате ткани почки крыс после дистанционного ударно-волнового воздействия в динамике
Table 1. Dynamics of markers of free radical oxidation in rat kidney tissue homogenate following ESWE.
Показатели Indicators | Группа 1 | Group 1 n = 10 | Группа 2 | Group 2 n = 10 | Группа 3 | Group 3 n = 10 | Группа 4 | Group 4 n = 10 | Группа 5 | Group 5 n = 10 | Р |
M ± m; 95% ДИ | ||||||
Белковые карбонильные группы, ммоль/мг белка Protein carbonyl groups, mmol/mg prt | 1,97 ± 0,07 1,91 – 2,02 | 2,75 ± 0,22 2,59 – 2,90 | 2,21 ± 0,04 2,17 – 2,24 | 2,15 ± 0,02 2,14 – 2,17 | 2,08 ± 0,05 2,05 – 2,12 | р1 < 0,001 р2 < 0,01 р3 < 0,05 р4 > 0,05 р5 < 0,001 р6 > 0,05 р7 > 0,05 |
Малоновый диальдегид, нмоль/мг белка Malondialdehyde nmol/mg prt | 0,97 ± 0,06 0,93 – 1,02 | 3,53 ± 0,07 3,48 – 3,59 | 3,21 ± 0,04 3,18 – 3,25 | 2,52 ± 0,07 2,46 – 2,57 | 1,87 ± 0,06 1,82 – 1,92 | р1 < 0,001 р2 < 0,001 р3 < 0,001 р4 < 0,001 р5 < 0,001 р6 < 0,001 р7 < 0,001 |
Примечание. Группа 1 — интактные животные (группа сравнения); группа 2 — экспериментальные животные после ДУВВ — 1-е сутки; группа 3 — -//- 3-и сутки; группа 4 — -//- 7-е сутки; группа 5 — -//- 14-е сутки
Сравнения. P1 — группа 1 с группой 2; p2 — группа 1 c группой 3; p3 — группа 1 с группой 4; p4 — группа 1 с группой 5; p5 — группа 2 с группой 3; p6 — группа 3 с группой 4; p7 — группа 4 с группой 5
Note. Group 1 — intact animals (comparison group); group 2 — experimental animals after ESWE — day 1; group 3 — -//- day 3; group 4 — -//- day 7; group 5 — -//- day 14
Comparisons. P1 — group 1 vs. group 2; p2 — group 1 vs. group 3; p3 — group 1 vs. group 4; p4 — group 1 vs. group 5; p5 — group 2 vs. group 3; p6 — group 3 vs. group 4; p7— group 4 vs. group 5
Оценивая показатели в гомогенате ткани почки экспериментального животного, мы выявили статистически значимое увеличение белковых карбонильных групп в 1‑й день после ДУВВ в сравнении с группой 1 (p1 < 0,001). С течением времени, на 3-и и 7-е сутки, уровень белковых карбонильных групп снижался, а к 14-м суткам приходил к значениям, достоверно не отличающимися от таковых в группе 1 (p4 > 0,05).
Возвращение уровня карбонильных групп к базовым значениям может свидетельствовать о завершении синдрома ишемии — реперфузии после ДУВВ.
Иным образом обстоит ситуация с динамикой концентрации малонового диальдегида в гомогенате почки. Анализ уровня концентрации малонового диальдегида в гомогенате почки показал его увеличение в 3,6 раза в первый день, в 3,3 раза — в 3-й, в 2,6 раза — на 7‑й день, в 1,9 — на 14-е сутки, так и не вернувшегося к базовым значениям (р4 > 0,05). Примечательно, что в каждой контрольной точке (3-и, 7-е, 14-е сутки) был отмечен уровень малонового диальдегида, который был достоверно ниже предыдущего.
В таблице 2 представлены антиоксидантные ферменты в гомогенате почки экспериментальных животных после ДУВВ в разные временные периоды.
Таблица 2. Активность антиоксидантных ферментов в гомогенате ткани почки крыс после дистанционного ударно-волнового воздействия в динамике
Table 2. Dynamics of activity of antioxidant enzymes in rat kidney tissue homogenate following ESWE
Показатели Indicators | Группа 1 | Group 1 n = 10 | Группа 2 | Group 2 n = 10 | Группа 3 | Group 3 n = 10 | Группа 4 | Group 4 n = 10 | Группа 5 | Group 5 n = 10 | Р |
M ± m; 95% ДИ | ||||||
СОД, мкмоль/мин./мг белка SOD, μmol/min/mg prt | 2,0 ± 0,02 2,0 – 2,04 | 1,55 ± 0,03 1,5 – 1,57 | 1,72 ± 0,02 1,71 – 1,74 | 1,8 ± 0,03 1,7 – 1,8 | 1,9 ± 0,02 1,9 – 1,93 | р1 < 0,001 р2 < 0,001 р3 < 0,001 р4 < 0,01 р5 < 0,001 р6 < 0,05 р7 < 0,01 |
ГПО, мкмоль/мин./мг белка GPO, μmol/min/mg prt | 2,04 ± 0,02 2,02 – 2,05 | 1,52 ± 0,02 1,50 – 1,53 | 1,76 ± 0,03 1,74 – 1,78 | 1,9 ± 0,03 1,87 – 1,9 | 2,0 ±0,04 1,94 – 2,0 | р1 < 0,001 р2 < 0,001 р3 < 0,001 р4 > 0,05 р5 < 0,001 р6 < 0,01 р7 > 0,05 |
ГР, нмоль/мин./мг белка GR, nmol/min/mg prt | 5,43 ± 0,03 5,40 – 5,45 | 2,73 ± 0,03 2,71 – 2,75 | 3,21 ± 0,03 3,19 – 3,24 | 4,6 ± 0,02 4,6 – 4,67 | 5,0 ± 0,03 4,9 – 4,99 | р1 < 0,001 р2 < 0,001 р3 < 0,001 р4 < 0,001 р5< 0,001 р6 < 0,001 р7 < 0,001 |
GSH, мкг/мг белка GSH, μg/mg prt | 2,71 ± 0,02 2,69 – 2,72 | 2,2 ± 0,02 2,18 – 2,21 | 2,25 ± 0,02 2,24 – 2,27 | 2,3 ± 0,02 2,27 – 2,3 | 2,6 ± 0,03 2,6 – 2,65 | р1 < 0,001 р2 < 0,001 р3 < 0,001 р4 < 0,05 р5 > 0,05 р6 < 0,05 р7 < 0,001 |
Примечание. Группа 1 — интактные животные (группа сравнения); группа 2 — экспериментальные животные после ДУВВ — 1-е сутки; группа 3 — -//- 3-е сутки; группа 4 — -//- 7-е сутки; группа 5 — -//- 14-е сутки
Сравнения. P1 — группа 1 с группой 2; p2 — группа 1 c группой 3; p3 — группа 1 с группой 4; p4 — группа 1 с группой 5; p5 — группа 2 с группой 3; p6 — группа 3 с группой 4; p7 — группа 4 с группой 5
Note. Group 1 — intact animals (comparison group); group 2 — experimental animals after ESWE — day 1; group 3 — -//- day 3; group 4 — -//- day 7; group 5 — -//- day 14
Comparisons. P1 — group 1 vs. group 2; p2 — group 1 vs. group 3; p3 — group 1 vs. group 4; p4 — group 1 vs. group 5; p5 — group 2 vs. group 3; p6 — group 3 vs. group 4; p7— group 4 vs. group 5
Отмечается статистически значимое снижение активности фермента супероксиддисмутазы в 1‑й день после ДУВВ (р1 < 0,001), в последующем, на 3-и и 7-е сутки, наблюдалось некоторое повышение активности СОД. К 14-м суткам уровень становится ещё выше, однако он не достигает базовых значений. Аналогичный тренд прослеживается при анализе активности глутатионредуктазы.
Несколько иные закономерности обнаружены при изучении динамики глутатионпероксидазы. После статистически значимого снижения следует рост активности, к 14-м суткам уровень этого фермента достигает исходных значений.
Динамика уровня восстановленного глутатиона в почечном гомогенате в целом повторяет динамику антиоксидантных ферментов: в первые сутки отмечено достоверное снижение, а в последующих контрольных точках фиксировался его рост. Тем не менее к 14-му дню уровень восстановленного глутатиона не достигает исходного.
Следующим этапом нашего исследования была гистоморфологическая оценка изменений в почках под воздействием ДУВВ.
Макроскопически левая почка увеличена в размерах по сравнению с правой, собственная фиброзная капсула почки из-за выраженного отёка истончена, натянута в области верхнего полюса, о чём свидетельствует лоснящаяся поверхность почки. В то же время в области тела и нижнего полюса почки капсула растянута, собирается в виде поперечных складок, что указывает на «дряблость» паренхимы почки (рис. 1).

Рисунок 1. Макропрепараты почек крыс на первые сутки после дистанционного ударно-волнового воздействия: левая почка указана стрелкой
Figure 1. Macroscopic specimens of rat kidneys following ESWE on day 1: the left kidney is indicated by an arrow
Морфологические изменения в почках на 1-й, 3-й, 7‑й дни после воздействия ударных волн были практически однотипными (рис. 2 – 5). Отмечается полнокровие капилляров, базальные мембраны клубочков утолщены, мочевое пространство расширено. В интерстиции коркового слоя мелкоочаговые кровоизлияния, а в переходной зоне — множественные сливающиеся. Выражена дистрофия эпителия канальцев, в просвете — следы белковой жидкости. И лишь на 14-е сутки происходит уменьшение отёка, исчезновение кровоизлияний, нивелирование признаков дистрофии эпителия канальцев, восстановление морфологических структур почки практически до исходного уровня.

Рисунок 2. Микропрепарат интактной почки крысы. Гематоксилин-эозин, ув. x100
Figure 2. Microscope slide of an intact rat kidney. H&E staining, magn. ×100
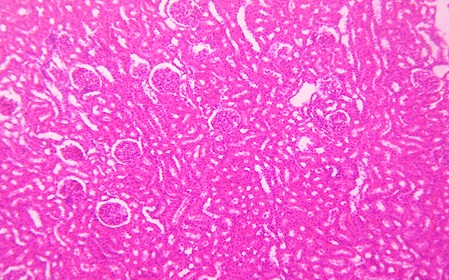
Рисунок 3. Микропрепарат почки крысы на 3-и сутки после дистанционного ударно-волнового воздействия. Гематоксилин-эозин, ув. x100
Figure 3. Microscope slide of an intact rat kidney. H&E staining, magn. ×100
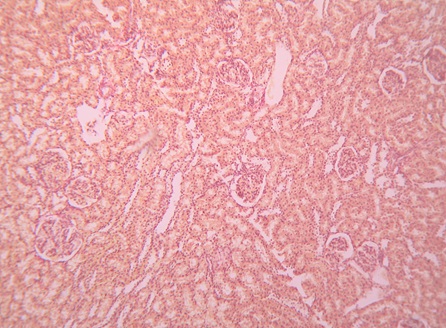
Рисунок 4. Микропрепарат почки крысы на 7-е сутки после дистанционного ударно-волнового воздействия. Окраска по van Gieson, ув. ×100
Figure 4. Microscope slide of the rat kidney following ESWE on day 7. Van Gieson staining, magn. ×100
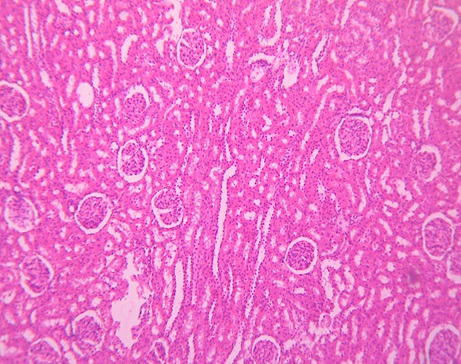
Рисунок 5. Микропрепарат почки крысы на 14-е сутки после дистанционного ударно-волнового воздействия. Окраска гематоксилин-эозин, ув. ×100
Figure 5. Microscope slide of the rat kidney following ESWE on day 14. H&E staining, magn. ×100
Результаты наших исследований продемонстрировали, что, в дополнение к обнаруженным морфологическим изменениям, после ударно-волнового воздействия присоединяется нарушение функции почек.
В таблице 3 представлены показатели, характеризующие функциональную способность почек экспериментальных животных после ДУВВ в динамике с 1-го по 14‑й день наблюдения.
Таблица 3. Маркёры функциональных нарушений почек крыс после дистанционного ударно-волнового воздействия в динамике
Table 3. Dynamics of markers of functional impairments in the rat kidneys of rats following ESWE
Показатели Indicators | Группа 1 | Group 1 n = 10 | Группа 2 | Group 2 n = 10 | Группа 3| Group 3 n = 10 | Группа 4 | Group 4 n = 10 | Группа 5 | Group 5 n = 10 | Р |
M ± m; 95% ДИ | ||||||
Креатинин, мг/дл Creatinine, mg/dL | 0,75 ± 0,04 0,73 – 0,78 | 0,99 ± 0,05 0,95 – 1,02 | 1,47 ± 0,03 1,45 – 1,49 | 1,56 ± 0,04 1,53 – 1,59 | 1,23 ± 0,04 1,20 – 1,25 | р1< 0,05 р2< 0,01 р3< 0,01 р4< 0,01 р5< 0,01 р6> 0,05 р7< 0,01 |
Мочевина, мг/дл Urea, mg/dL | 18,99 ± 0,66 18,5 – 19,4 | 19,66 ± 0,4 19,4 – 19,9 | 20,29 ± 0,5 19,93 – 20,65 | 27,65 ± 0,5 27,3 – 28,0 | 21,42 ± 0,3 21,2 – 21,6 | р1 > 0,05 р2 > 0,05 р3 < 0,01 р4 < 0,01 р5 > 0,05 р6 < 0,01 р7 < 0,01 |
Примечание. Группа 1 — интактные животные (группа сравнения); группа 2 — экспериментальные животные после ДУВВ — 1-е сутки; группа 3 — -//- 3-и сутки; группа 4 — -//- 7-е сутки; группа 5 — -//- 14-е сутки
Сравнения. P1 — группа 1 с группой 2; p2 — группа 1 c группой 3; p3 — группа 1 с группой 4; p4 — группа 1 с группой 5; p5 — группа 2 с группой 3; p6 — группа 3 с группой 4; p7 — группа 4 с группой 5
Note. Group 1 — intact animals (comparison group); group 2 — experimental animals after ESWE — day 1; group 3 — -//- day 3; group 4 — -//- day 7; group 5 — -//- day 14
Comparisons. P1 — group 1 vs. group 2; p2 — group 1 vs. group 3; p3 — group 1 vs. group 4; p4 — group 1 vs. group 5; p5 — group 2 vs. group 3; p6 — group 3 vs. group 4; p7— group 4 vs. group 5
Отмечается достоверное увеличение концентрации креатинина в 1-е сутки после ДУВВ, однако уровень данного маркёра функционального состояния почек остаётся в пределах нормы, составляя 0,68 – 1,02 мг/дл. К 3-м суткам уровень креатинина становится достоверно выше по сравнению с уровнем в предыдущей контрольной точке, выходя за пределы нормальных значений. Высокие уровни креатинина на 3-и и на 7-е сутки не имеют статистически значимых различий между собой, что свидетельствует об установлении определённого плато, обусловленного повреждением как внутрипочечного сосудистого русла, так и элементов нефронов. К 14-м суткам начинает прослеживаться тенденция к снижению уровня креатинина, что согласуется с результатами морфологических исследований.
Несколько иная динамика прослеживается при оценке изменений концентрации мочевины в сыворотке крови. Максимальная концентрация мочевины в сыворотке крови отмечена на 7‑й день со снижением к 14-му дню наблюдения. Однако уровень мочевины остаётся достоверно выше, чем в группе сравнения.
Анализ показателей свободнорадикального окисления белков и липидов нефроэпителия, оценка активности антиоксидантных ферментов и функциональной способности почек экспериментальных животных, а также гистоморфологические изменения после ДУВВ на 1-й, 3-й, 7-й, 14‑й дни исследования позволили уточнить механизм и этапы повреждения и восстановления структурно-функциональных параметров почек крыс (табл. 4).
Таблица 4. Механизм и этапы повреждения и восстановления структурно-функциональных параметров почек крыс после дистанционного ударно-волнового воздействия
Table 4. Mechanism and stages of injury and recovery of structural and functional parameters of rat kidneys following ESWE
1 – 3‑й дни | Days 1 – 3 | 7‑й день | Day 7 | 14‑й день | Day 14 |
Травматическое воздействие ударной волны на паренхиму почки Traumatic impact of a shock wave on the renal parenchyma ↓ Активация процессов свободнорадикального окисления белков и липидов нефроэпителия Activation of free radical oxidation processes of proteins and lipids in renal epithelium ↓ Снижение антиоксидантной защиты клеток нефроэпителия Reduced antioxidant protection of renal epithelium ↓ Деструктивные изменения мембран клубочка и тубулярного эпителия Destructive changes in the glomerular membranes and tubular epithelium ↓ Гибель клеток нефроэпителия Renal epithelium cell death ↓ Альтерация ткани почки Alteration of kidney tissue | Выраженные гистоморфологические изменения в почке Pronounced histomorphological changes in the kidney ↓ Снижение функциональной способности почек Decreased functional ability of the kidney | Нормализация активности маркёров повреждения почки Normalisation of kidney injury marker activity ↓ Регресс гистоморфологических изменений в почке Regression of histomorphological changes in the kidney ↓ Восстановление функциональной способности почки Restoring the function of the kidney ↓ Возможность повторного дистанционного ударно-волнового воздействия на почку Possibility of repeated ESWE on the kidney |
Обсуждение
Традиционно ДУВЛ считается малоинвазивным и высокоэффективным методом лечения МКБ [14 – 17]. Однако проблема сопутствующего повреждения почечной паренхимы при проведении ДУВЛ остаётся актуальной и нерешённой.
Очевидно, что внедрение в клиническую практику новых информативных критериев оценки степени повреждения почечной паренхимы, сопоставимое по информативности с морфологическими исследованиями, могло бы послужить объективной основой регулирования параметров волнового воздействия и оптимизировать сроки проведения повторных процедур в ходе хирургического лечения нефролитиаза методом ДУВЛ.
Для оценки степени выраженности почечного повреждения в настоящее время предложено большое количество прямых и непрямых маркёров [18][19].
Интерпретируя показатели тех или иных биомаркёров, мы должны учитывать механизм активации экспрессии, время, прошедшее после воздействия повреждающего фактора, исходное состояние функции почек [18].
В нашем исследовании у подопытных животных, которые подвергались ДУВВ, в гомогенате почек были изучены маркёры свободнорадикального окисления белков (белковые карбонильные группы) и липидов полиненасыщенных жирных кислот (малоновый диальдегид), отражающие степень повреждения нефроэпителия. Также в почечном гомогенате определяли ферменты, такие как супероксиддисмутаза, глутатионпероксидаза, глутатионредуктаза, глутатион восстановленный, отражающие степень антиоксидантной защиты почки.
Проведённое экспериментальное исследование показало, что после ДУВВ на почку экспериментальных животных с 1-го по 3‑й день происходит активация процессов свободнорадикального окисления белков и липидов клеток нефроэпителия. Нормализация показателей радикального окисления белков и липидов происходила с 7-го по 14‑й день наблюдения, что согласуется с результатами других авторов [20 – 22], доказывая, что одним из факторов повреждения при ДУВВ является активация свободнорадикального окисления мембранных липидов и белков клеток нефроэпителия. Показатели антиоксидантной защиты почки после ДУВВ статистически значимо снижали свою функцию на 1 – 2‑й день, восстановление отмечено с 3-го по 14‑й день.
Таким образом, колебания концентраций маркёров свободнорадикального окисления и антиоксидантной защиты отражают сущность патогистологических изменений в результате альтерации почечной паренхимы и позволяют более чётко представить механизмы нарушения почечной функции на фоне ДУВВ. Для подтверждения данных выводов была произведена гистоморфологическая оценка изменений в почках животных после ДУВВ в динамике на 1-е, 3-и, 7-е, 14-е сутки. При морфологическом исследовании основное внимание обращали на варианты проявления альтеративных изменений, их обратимости, которые отражали выраженность повреждающего действия сфокусированных ударных волн.
Морфологические изменения в почках на 1-й, 3-й, 7‑й дни после ДУВВ были практически однотипны. Отмечалось полнокровие капилляров, базальные мембраны клубочков утолщены, мочевое пространство расширено. В интерстиции коркового слоя — мелкоочаговые кровоизлияния, а в переходной зоне — множественные сливающиеся, выраженная дистрофия эпителия канальцев, в просвете — следы белковой жидкости. Такие острые биоэффекты ударных волн тщательно изучены в нескольких экспериментальных исследованиях с использованием различных животных моделей [23]. Лишь на 14-е сутки произошло уменьшение отёка, исчезновение кровоизлияний, нивелирование признаков дистрофии эпителия канальцев, морфологическая структура почки восстановилась практически до исходного уровня.
Конструктивное развитие и усовершенствование литотриптеров привели к изменению характера и уровней осложнений, поэтому проведение ДУВЛ на аппаратах с различным принципом генерации ударной волны характеризуется неодинаковой степенью травматизации почечной паренхимы [24]. Этим, по всей видимости, объясняются разные сроки восстановления почечной ткани после ДУВВ — от 8 до 35 дней, согласно результатам исследований, проведённых авторами в разные временные периоды [20][23].
В последнее время в поисках улучшения результатов дистанционной литотрипсии и уменьшения повреждающего фактора на почечную паренхиму стали исследоваться альтернативные методики, в частности описанные Н.К. Гаджиевым и соавт. (2021) [25]. Данные устройства используют технологию сфокусированных ультразвуковых волн высокой интенсивности, или «ультразвуковой пропульсии», что позволяет снизить объём поражения почки до 0,1% по сравнению с 5% при ДУВЛ.
С учётом вышеизложенного были уточнены механизмы и временные этапы повреждения и восстановления структурно функциональных параметров почек экспериментальных животных после ДУВВ. Так, с 1-го по 3‑й день происходит активация процессов свободнорадикального окисления белков и липидов нефроэпителия (белковые карбонильные группы, малоновый диальдегид), снижение активности ферментов антиоксидантной защиты (супероксиддисмутаза, глутатионпероксидаза, глутатионредуктаза, восстановленный глутатион (GSH)), что в итоге приводит к мембранодеструктивным изменениям, гибели клеток нефроэпителия, альтерации ткани почки. На 7-е сутки выраженные гистоморфологические изменения способствуют снижению функции почек (увеличение мочевины и креатинина в сыворотке крови). Только на 14-е сутки маркёры повреждения почки, её гистоморфологическая структура и функциональная способность приближаются к норме.
Проведённые экспериментальные исследования позволяют достаточно точно судить о том, что изменения в почках животных при ДУВВ носят обратимый характер и восстановление происходит на 14‑й день. Полученные данные позволяют обсуждать возможность и целесообразность повторного ДУВВ на почку не ранее 14 дней после первого сеанса.
Однако нужно отметить, что выявленные повреждения в почках экспериментальных животных после ДУВВ и сроки восстановления относятся только к интактным почкам, так как при изначально сниженной функции почек периоды нормализации активности продуктов СРО и восстановления почечной паренхимы удлиняются [23].
Заключение
Результаты экспериментального исследования позволяют изучить механизмы повреждения почечной ткани, выявить стадийность патоморфологических изменений и функциональных расстройств, установить сроки восстановления почечной ткани после ударно-волнового воздействия.
Ключевые моменты:
- Концентрация маркёров СРО и АОЗ отражают сущность патологогистологических изменений в почках экспериментальных животных после ДУВВ.
- С 1-го по 3‑й день происходит активация СРО-белков и липидов нефроэпителия, снижение активности ферментов АОЗ и, как итог, — гибель клеток нефроэпителия, альтерация ткани почки.
- К 7-м суткам эксперимента развиваются выраженные гистоморфологические изменения в ткани почки со снижением её функции.
- Изменения в почках экспериментальных животных при ДУВВ носят обратимый характер, восстановление происходит на 14‑й день, что позволяет обсуждать возможность и целесообразность проведения повторного сеанса.
- Выявленные механизмы и динамика повреждения и восстановления почки после ДУВВ позволяют обосновать необходимость проведения медикаментозной протекторной терапии почки.
Список литературы
1. Аполихин О.И., Сивков А.В., Комарова В.А., Просянников М.Ю., Голованов С.А., Казаченко А.В., Никушина А.А., Шадеркина В.А. Заболеваемость мочекаменной болезнью в Российской Федерации (2005-2016 годы). Экспериментальная и клиническая урология. 2018;(4):4-14.
2. Grundy S.M., Cleeman J.I., Daniels S.R., Donato K.A., Eckel R.H., Franklin B.A., Gordon D.J., Krauss R.M., Savage P.J., Smith S.C. Jr, Spertus J.A., Costa F. American Heart Association; National Heart, Lung, and Blood Institute. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005;112(17):2735- 2752. Erratum in: Circulation. 2005;112(17):e297. Erratum in: Circulation. 2005;112(17):e298. DOI: 10.1161/CIRCULATIONAHA.105.169404
3. de la Rosette J., Assimos D., Desai M., Gutierrez J., Lingeman J., Scarpa R., Tefekli A. CROES PCNL Study Group. The Clinical Research Office of the Endourological Society Percutaneous Nephrolithotomy Global Study: indications, complications, and outcomes in 5803 patients. J Endourol. 2011;25(1):11-17. DOI: 10.1089/end.2010.0424
4. Scales C.D. Jr, Smith A.C., Hanley J.M., Saigal C.S. Urologic Diseases in America Project. Prevalence of kidney stones in the United States. Eur Urol. 2012;62(1):160-165. DOI: 10.1016/j.eururo.2012.03.052
5. Аполихин О.И., Сивков А.В., Москалева Н.Г., Солнцева Т.В., Комарова В.А. Анализ уронефрологической заболеваемости и смертности в Российской Федерации в 2010 – 2011 годах. Экспериментальная и клиническая урология. 2013;(2):10-17.
6. Аляев Ю.Г., Амосов В.С., Саенко В.С. Метафилактика мочекаменной болезни. М.: Канц-Экспо; 2007.
7. Аполихин О.И., Сивков А.В., Бешлиев Д.А., Солнцева Т.В., Комарова В.А., Зайцевская Е.В. Анализ урологической заболеваемости в Российской Федерации в 2002-2009 годах по данным официальной статистики. Экспериментальная и клиническая урология. 2011;(1):4-10.
8. Лопаткин Н.А., Яненко Э.К. Лечение больных коралловидным нефролитиазом. М., 1991.
9. Kuo R.L., Aslan P., Abrahamse P.H., Matchar D.B., Preminger G.M. Incorporation of patient preferences in the treatment of upper urinary tract calculi: a decision analytical view. J Urol. 1999;162(6):1913-1918; discussion 1918-1919. DOI: 10.1016/S0022-5347(05)68067-6
10. Orsola A., Diaz I., Caffaratti J., Izquierdo F., Alberola J., Garat J.M. Staghorn calculi in children: treatment with monotherapy extracorporeal shock wave lithotripsy. J Urol. 1999;162(3 Pt 2):1229-1233. DOI: 10.1016/S0022-5347(01)68142-4
11. Неймарк А.И., Жуков В.Н., Фидиркин А.В. Влияние экстракорпоральной ударно-волновой литотрипсии на показатели энзимурии у больных нефролитиазом. Урология и нефрология. 1997;(4):11-13.
12. Сазонтова Т.Г., Архипенко Ю.В. Значение баланса прооксидантов и антиоксидантов – равнозначных участников метаболизма. Патофизиология и экспериментальная терапия. 2007;(3):2-18.
13. Corbally M.T., Ryan J., FitzPatrick J., Fitzgerald R.J. Renal function following extracorporeal lithotripsy in children. J Pediatr Surg. 1991;26(5):539-540. DOI: 10.1016/0022-3468(91)90701-t
14. Хасигов А.В., Хажоков М.А., Ильяш А.В., Глухов В.П., Набока Ю.Л., Гудима И.А. Эффективность и безопасность дистанционной ударноволновой литотрипсии простых лоханочных камней. Вестник урологии. 2017;5(3):39-48.
15. Donaldson J.F., Lardas M., Scrimgeour D., Stewart F., MacLennan S., Lam T.B., McClinton S. Systematic review and meta-analysis of the clinical effectiveness of shock wave lithotripsy, retrograde intrarenal surgery, and percutaneous nephrolithotomy for lower-pole renal stones. Eur Urol. 2015;67(4):612-616. DOI: 10.1016/j.eururo.2014.09.054
16. Gokce M.I., Tokatli Z., Suer E., Hajiyev P., Akinci A., Esen B. Comparison of shock wave lithotripsy (SWL) and retrograde intrarenal surgery (RIRS) for treatment of stone disease in horseshoe kidney patients. Int Braz J Urol. 2016;42(1):96-100. DOI: 10.1590/S1677-5538.IBJU.2015.0023
17. Elmansy H.E., Lingeman J.E. Recent advances in lithotripsy technology and treatment strategies: A systematic review update. Int J Surg. 2016;36(Pt D):676-680. DOI: 10.1016/j.ijsu.2016.11.097
18. Malhotra R., Siew E.D. Biomarkers for the Early Detection and Prognosis of Acute Kidney Injury. Clin J Am Soc Nephrol. 2017;12(1):149-173. DOI: 10.2215/CJN.01300216
19. McIlroy D.R., Wagener G., Lee H.T. Biomarkers of acute kidney injury: an evolving domain. Anesthesiology. 2010;112(4):998-1004. DOI: 10.1097/ALN.0b013e3181cded3f
20. Ужегов Т.А. Профилактика повреждений почки при дистанционной ударно-волновой литотрипсии: Автореферат дис. ... канд. мед. наук. Москва; 2004. Ссылка активна на 03.04.2025.
21. Селиванова О.С. Экспериментальное исследование нефропротекторных свойств глицина: Автореферат дис. ... канд. мед. наук. Казань; 2005. Ссылка активна на 03.04.2025.
22. Россоловский А.Н., Чехонацкая М.Л., Захарова Н.Б., Березинец О.Л., Емельянова Н.В. Динамическая оценка состояния почечной паренхимы у больных после дистанционной ударно-волновой литотрипсии камней почек. Вестник урологии. 2014;(2):3-14.
23. Лопаткин Н.А., Трапезникова М.Ф., Дутов В.В., Дзеранов Н.К. Дистанционная ударно-волновая литотрипсия: прошлое, настоящее, будущее. Урология. 2007;(6):3-13.
24. Дутов В.В., Дутов С.В. Дистанционная ударно-волновая литотрипсия у взрослых. В кн. Инновационная хирургия камней почек и мочеточников. 2-е издание, переработанное и дополненное. Под редакцией Когана М.И., Акилова Ф.А., Мартова А.Г., Дутова В.В., Григорьева Н.А. М.: Медконгресс; 2025:160-174.
25. Гаджиев Н.К., Горелов Д.С., Иванов А.О., Семенякин И.В., Маликиев И.Е., Обидняк В.М., Крючковенко Я.И., Петров С.Б., Григорьев В.Е. Радиоимпульсная ультразвуковая литотрипсия – новая ступень эволюции дистанционной ударно-волновой литотрипсии. Вестник урологии. 2021;9(3):127-134.
Об авторах
В. В. КлочковРоссия
Владимир Валерьевич Клочков – д-р мед. наук, доцент
Ульяновск
А. В. Клочков
Россия
Артём Владимирович Клочков
Ульяновск
Л. Е. Белый
Россия
Лев Евгеньевич Белый – д-р мед. наук, доцент
Ульяновск
Т. Х. Давидян
Россия
Давидян Тигран Хачатурович
Ульяновск
Рецензия
Для цитирования:
Клочков В.В., Клочков А.В., Белый Л.Е., Давидян Т.Х. Динамическая оценка гистоморфологических и функциональных изменений в почках экспериментальных животных при ударно-волновом воздействии. Вестник урологии. 2025;13(4):14-24. https://doi.org/10.21886/2308-6424-2025-13-4-14-24
For citation:
Klochkоv V.V., Klochkоv A.V., Belyi L.E., Davidyan T.Kh. Renal response to shock wave exposure in experimental animals: dynamic histomorphological and functional evaluation. Urology Herald. 2025;13(4):14-24. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-14-24













































