Перейти к:
Применение протокола ускоренного восстановления (ERAS) при аугментационной цистопластике у больных туберкулёзом
https://doi.org/10.21886/2308-6424-2025-13-4-5-13
Аннотация
Введение. Использование протокола ускоренного восстановления после операции (Enhanced Recovery After Surgery, ERAS) может позволить улучшить качество жизни у пациентов, перенёсших субтотальную резекцию мочевого пузыря с последующей кишечной пластикой.
Цель исследования. Оценить результаты субтотальной резекции мочевого пузыря с кишечной реконструкцией и послеоперационное восстановление пациентов при использовании адаптированного протокола ERAS.
Материалы и методы. В исследование включены 99 пациентов, перенесших субтотальную резекцию микроцистиса с последующей кишечной пластикой. Основную группу с применением протокола составили 29 пациентов, группу контроля – 70 пациентов.
Результаты. Использование протокола ERAS существенно снижает количество послеоперационных осложнений по шкале Clavien-Dindo. В группе ERAS в сравнении с группой контроля выше доля пациентов, имевших прирост скорости клубочковой фильтрации – 65,5% против 27,1%. Функциональный объём сформированного мочевого пузыря > 200 мл чаще наблюдали в группе ERAS – 69,0% против 34,3% пациентов; объём остаточной мочи > 100 мл у больных группы ERAS не отмечен, но зарегистрирован у 20% пациентов группы контроля; отхождение газов в группе ERAS происходило в среднем через 16 часов после операции, а в группе контроля – в через 25 часов; среднее время до первой дефекации в группе ERAS составило 35 часов, в группе контроля – 49 часов.
Заключение. Применение протокола ERAS у пациентов, подвергнутых аугментационной илеоцистопластике, существенно снижает частоту послеоперационных осложнений, способствует лучшему восстановлению функции почек, достижению наилучших функциональных параметров мочеиспускания и скорейшему восстановлению перистальтики кишечника.
Ключевые слова
Для цитирования:
Зубань О.Н., Прокопович М.А., Чотчаев Р.М., Вишневский Д.А., Корчагин М.П. Применение протокола ускоренного восстановления (ERAS) при аугментационной цистопластике у больных туберкулёзом. Вестник урологии. 2025;13(4):5-13. https://doi.org/10.21886/2308-6424-2025-13-4-5-13
For citation:
Zuban O.N., Prokopovich M.A., Chotchaev R.M., Vishnevskii D.A., Korchagin M.P. Enhanced recovery after surgery (ERAS) protocol in augmentation cystoplasty for patients with urogenital tuberculosis. Urology Herald. 2025;13(4):5-13. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-5-13
Введение
Во многих регионах России среди внелёгочных форм туберкулёза более половины приходится на мочеполовую систему [1]. Наиболее частой мишенью является почка, а вовлечение в процесс мочевого пузыря наблюдают у каждого пятого пациента. В последнем случае наступает выраженная социальная, бытовая и профессиональная ущербность заболевшего вследствие учащённого и болезненного мочеиспускания (30 – 40 и более раз в сутки). Необратимым исходом туберкулёза мочевого пузыря является его рубцовое сморщивание, требующее его удаления и кишечной реконструкции [2].
В настоящее время благодаря внедрению протоколов ускоренного восстановления после операции (Enhanced Recovery After Surgery, ERAS), сохраняющих физиологический гомеостаз и уменьшающих периоперационный стресс, снижается количество ранних осложнений и продолжительность пребывания урологических больных в стационаре без сопутствующего увеличения количества повторных госпитализаций. Целями ERAS являются минимизация болевого и периоперационного метаболического стресса, оптимизация баланса жидкости и сокращение времени выздоровления.
Общество ERAS разработало научно обоснованные рекомендации по расширенному восстановлению после операций на толстой кишке, поджелудочной железе, прямой кишке, тазовых органах и при радикальной цистэктомии у взрослых [3][4].
Известно, что протокол ERAS применяется при аугментационной цистопластике у детей, а у взрослых нашёл отражение только в одной публикации [5]. В свою очередь аугментационная цистопластика, применяемая для обеспечения континенции, защиты верхних мочевых путей от высокого внутрипросветного давления и облегчения симптомов дисфункции мочевого пузыря, остаётся важным методом хирургического лечения при снижении комплаентности или ёмкости мочевого пузыря в результате туберкулёза, а также других нейрогенных и не нейрогенных причин или врождённых урологических аномалий, когда другие методы лечения, такие как пероральные препараты, внутрипузырные инъекции ботулотоксина и крестцовая нейромодуляция, не дали результатов. Эта методика связана с рядом осложнений [2][6]. Некоторые из них возникают на ранних стадиях, такие как тромбоэмболия, раневая и внутрибрюшная инфекция, перфорация и смертность. В то время как метаболические нарушения, бактериурия, камни в мочевыводящих путях, недержание мочи, перфорация, необходимость периодической самокатетеризации, выделение слизи, задержка роста, дефицит витаминов, деминерализация костей и карцинома могут проявиться позже [7][8].
Относительно небольшое количество публикаций позволяет утверждать, что реализация программы ускоренного восстановления в условиях современного урологического стационара изучена и освящена не полностью [8 – 14]. Работ, посвящённых применению протокола ERAS при субтотальной резекции мочевого пузыря с кишечной реконструкцией по поводу мочеполового туберкулёза, нет.
Цель исследования: оценить результаты субтотальной резекции мочевого пузыря с кишечной реконструкцией и послеоперационное восстановление пациентов при использовании адаптированного протокола ERAS.
Материалы и методы
В исследование включено 99 пациентов с посттуберкулёзным микроцистисом, перенёсших оперативное вмешательство в объёме субтотальной резекции мочевого пузыря с последующей аугментационной кишечной пластикой.
Пациенты были разделены на группы, отличающиеся по принципам предоперационной подготовки, интраоперационного выделения фрагмента кишки и послеоперационного ведения. Первую группу (основную) составили 29 (29,30%) пациентов, оперированных с использованием протокола ERAS, вторую (контрольную) — 70 (70,70%) человек со стандартной общепринятой подготовкой и послеоперационным ведением.
Хирургическая техника. Для создания нового резервуара с максимальной ёмкостью при аугментационной цистопластике используют различные отделы желудочно-кишечного тракта. Илеоцистопластика — наиболее распространённая техника, при которой пациент занимает супинированное или низкое литотомическое положение. Затем выполняют стандартный срединный лапаротомный разрез для доступа к органам брюшной полости. Путём диссекции обнажается предпузырное и перивезикальное пространства, мочевой пузырь субтотально резецируется или рассекается в корональной или сагиттальной плоскости. В зависимости от желаемого увеличения объёма мочевого пузыря и его исходной ёмкости сегмент подвздошной кишки длиной от 15 до 35 см (обычно около 25 – 30 см) выбирают на расстоянии 15 – 20 см от илеоцекального клапана.
Кроме того, оценивают длину брыжейки, позволяющую достичь мочевого пузыря. Затем участок кишки выключают из непрерывного кишечника, оставляют на брыжейке, выполняют илеоилеанастомоз. Брыжеечное окно закрывают для профилактики образования грыж. После очистки иссечённый сегмент подвздошной кишки реконфигурируют в форме буквы U и после детубуляризации формируют сферический резервуар, который затем анастомозируют с нативным мочевым пузырём. Проводят проверку резервуара на предмет герметичности и перед закрытием брюшной стенки устанавливают дренажи.
Адаптированный протокол ERAS.
- Голод в течение 8 часов до операции.
- Отказ от приёма жидкости за 2 часа до операции.
- Диета с высоким содержанием белка и низким содержанием углеводов за 1 день до операции.
- Отказ от подготовки кишечника (очистительная клизма, слабительные средства) перед операцией.
- Введение антибиотиков (комбинация цефалоспорина, аминогликозида и метронидазола) непосредственно перед операцией и продолжение в течение 7 дней после операции.
- Отказ от использования наркотических средств во время анестезии.
- Продлённая эпидуральная анальгезия с введением наропина 0,2% через одноразовую инфузионную помпу.
- Отказ от рутинной постановки назогастрального зонда.
- Начало энтерального питания в 1-е сутки после операции.
- Раннее удаление страховых дренажей и уретрального катетера.
- Использование сегмента подвздошной кишки для илеоцистопластики длиной не более 35 см.
Контроль восстановления после операции. Производили оценку сроков начала активной перистальтики кишечника (время до отхождения газов, до первого стула). Для оценки послеоперационных осложнений использовали шкалу Clavien-Dindo. Критериями выписки были адекватный контроль послеоперационной боли пероральными анальгетиками, физическая активность (вне постели 6 часов и более в день), восстановление функции кишечника и отсутствие осложнений, требующих лечения в стационаре.
Статистический анализ. Для статистической обработки данных использовали программы IBM SPSS Statistics v.26 (SPSS: An IBM Company, IBM SPSS Corp., Armonk, NY, USA), Microsoft Excel 365 (“Microsoft Corp.”, Redmond, WA, USA). Нормальность распределения проверяли с помощью теста Колмогорова-Смирнова-Lilliefors. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей [ Q1; Q3]. Категориальные данные описывались с указанием абсолютных значений (n) и процентных долей (%). 95% ДИ для долей (%) рассчитывались по методу Klopper-Pearson. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Mann-Whitney (M-W test). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия Pearson’s chi-square (χ²). P < 0,05 считалось статистически значимым для всех тестов.
Результаты
В обеих группах превалировали пациенты мужского пола: 62,1% против 37,9% женщин в основной и 54,3% против 45,7% в контрольной соответственно. Средний возраст в основной группе составил 46,2 года, в то время как в группе контроля — 50,4 года.
Коморбидность пациентов оказалась примерно одинаковой в обеих группах, наиболее распространённые заболевания представлены в таблице 1.
Таблица 1. Коморбидный фон
Показатель | Группа 1 (n = 29) | Группа 2 (n = 70) | P (χ², df = 1) |
n (%) | |||
Гипертоническая болезнь | 14 (48,28) | 36 (51,43) | 0,7752 |
Хроническая болезнь почек | 11 (37,93) | 30 (42,86) | 0,6506 |
Сахарный диабет | 6 (20,69) | 16 (22,86) | 0,8134 |
Ишемическая болезнь сердца | 4 (13,79) | 12 (17,14) | 0,6803 |
Хроническая обструктивная болезнь лёгких | 2 (6,90) | 6 (8,57) | 0,7808 |
Установлено, что медиана пребывания в реанимации в основной группе составила 3 койко-дня против 4 в группе контроля, что оказалось статистически не значимым. Длительность продлённой перидуральной анестезии составила 3,0 [ 3,0; 4,0] суток. Медиана сроков удаления страхового дренажа и уретрального катетера была меньше в основной группе (табл. 2).
Таблица 2. Послеоперационные показатели
Показатель | Группа 1 (n = 29) | Группа 2 (n = 70) | P (M-W test) |
Me [ LQ; UQ] | |||
Сроки в реанимации, сутки | 3,0 [ 3,0; 4,0] | 4,0 [ 3,0; 5,0] | 0,0959 |
Начало энтерального питания, сутки | 1,0 [ 1,0; 1,0] | 3,0 [ 3,0; 4,0] | < 0,0001 |
Удаление дренажей, сутки | 4,0 [ 3,0; 5,0] | 7,0 [ 6,0; 8,0] | < 0,0001 |
Удаление уретрального катетера, сутки | 14,0 [ 12,0; 16,0] | 23,0 [ 22,0; 24,0] | < 0,0001 |
Сравнительный анализ частоты осложнений по классификации Clavien-Dindo в первые 90 дней после операции представлен в таблице 3.
Таблица 3. Послеоперационные осложнения по шкале Clavien-Dindo
Категории по Clavien-Dindo | Группа 1 (n = 29) | Группа 2 (n = 70) | Всего (n=99) | P (χ², df = 4) |
n (%) | ||||
1 | 19 (65,52) | 17 (24,29) | 36 (36,36) | 0,0036 |
2 | 4 (13,79) | 19 (27,14) | 23 (23,23) | |
3a | 1 (3,45) | 5 (7,14) | 6 (6,01) | |
3b | 5 (17,24) | 25 (35,71) | 30 (30,3) | |
4 | 0 | 4 (5,71) | 4 (4,04) | |
Продемонстрировано, что наиболее лёгкие осложнения категории 1 преобладали в группе ERAS: 65,5% против 24,3% — в группе контроля. Более тяжёлые категории 2 – 4 существенно доминировали в группе контроля. Осложнений категории 5 (летальные исходы) не отмечено ни в одной из групп.
Оперативное лечение привело к приросту скорости клубочковой фильтрации у 65,5% основной группы и только у 27,1% — контрольной. Снижение этого показателя, напротив, отмечено существенно реже в группе применения протокола ERAS (10,3% против 44,3%) (рис. 1).

Рисунок 1. Распределение больных в зависимости от изменений скорости клубочковой фильтрации после кишечной пластики мочевого пузыря
Функциональный объём сформированного мочевого пузыря более 200 мл чаще наблюдали в группе 1 у 69,0% пациентов против 34,3%, менее 150 мл в группе 2 — у 51,4% против 20,7% соответственно (рис. 2). Лучшие функциональные результаты в группе 1 можно объяснить меньшим объёмом остаточной мочи в сравнении с группой 2.
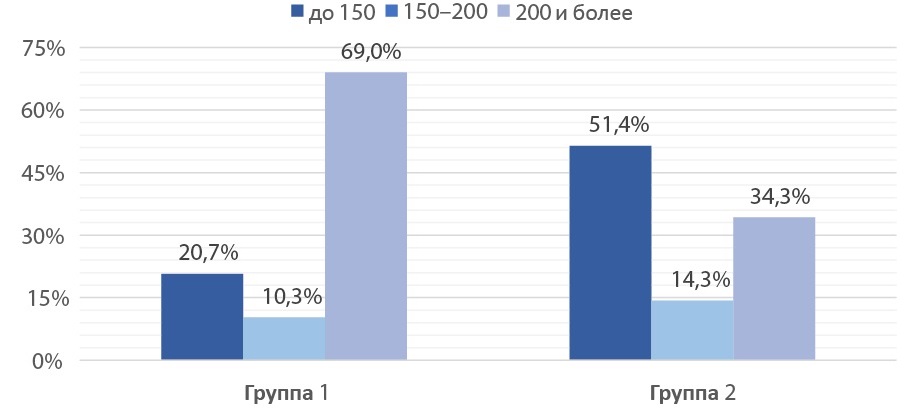
Рисунок 2. Распределение больных в зависимости от функционального объёма сформированного неоцистиса
Объём остаточной мочи более 100 мл не отмечен у больных группы 1 и зарегистрирован у 20% в группе контроля, от 50 мл до 100 мл — у 17,2% и 65,7%, менее 50 мл — у 82,8% и 20,0% соответственно (рис. 3).
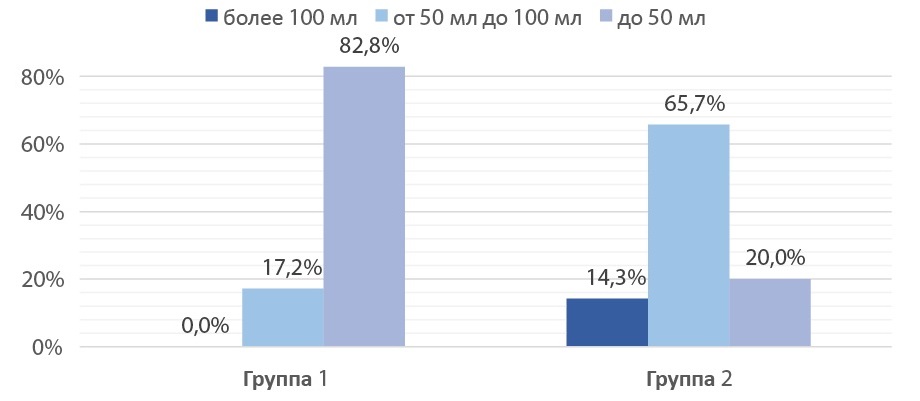
Рисунок 3. Распределение больных в зависимости от объёма остаточной мочи
Средний балл по шкале IPSS до операции составил 32 [ 28,0; 32,0] и 33 [ 30,0; 34,0] для групп 1 и 2 соответственно. После оперативного пособия отмечено снижение этого показателя до 21 [ 21,0; 24,0] балла в основной группе и до 25 [ 23,0; 26,0] — в контрольной (рис. 4).
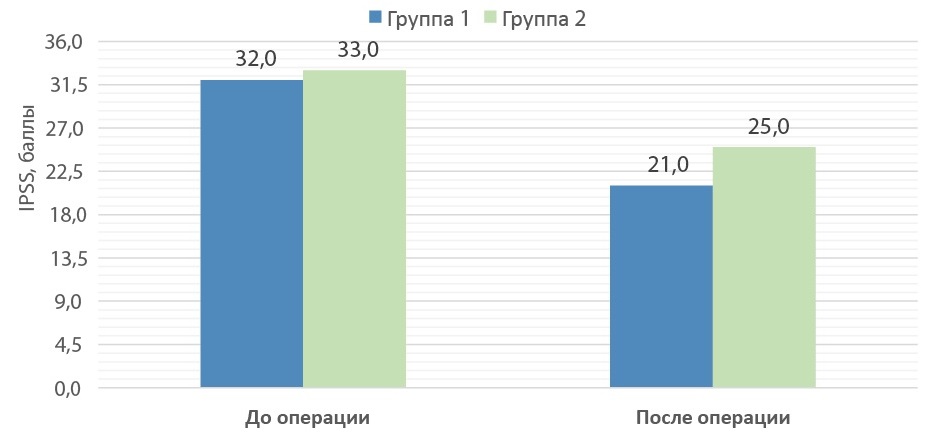
Рисунок 4. Показатели IPSS до и после операции в группах сравнения
Средний балл качества жизни вследствие расстройств мочеиспускания QoL до операции в обеих группах составил 6 [ 5,0; 6,0]. Оперативное пособие привело к улучшению у всех больных, балл снизился до 1 [ 1,0; 3,0] и 3 [ 2,0; 3,0] для групп 1 и 2 соответственно (рис. 5).
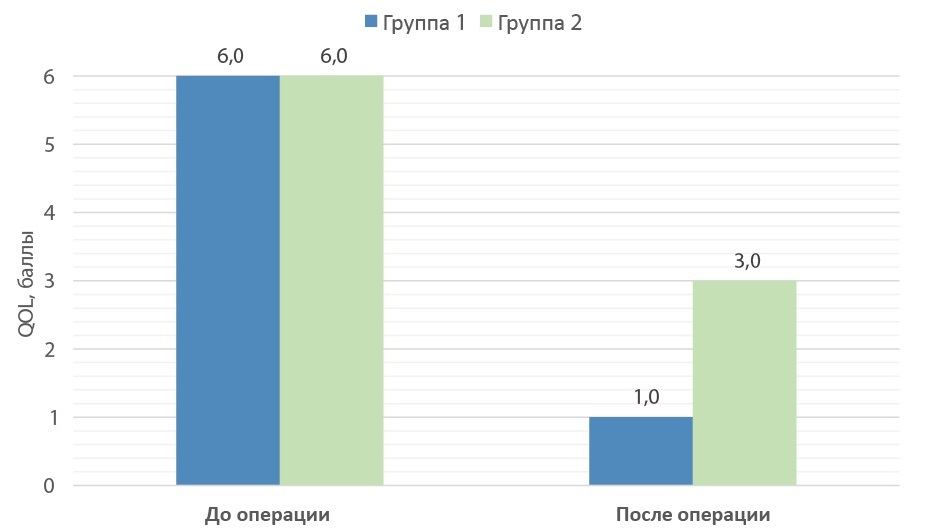
Рисунок 5. Показатели QoL до и после операции в группах сравнения
Отхождение газов в группе 1 происходило через 16 [ 14,0; 19,0] часов после операции в то время, как в группе 2 — через 25 [ 22,0; 28,0] (рис. 6).
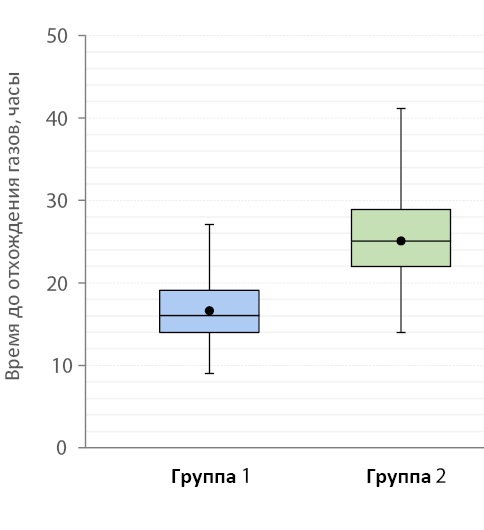
Рисунок 6. Сроки отхождения газов у больных
Время до первой дефекации в среднем составило 35 [ 28,0; 41,0] и 49 [ 39,2; 58,0] часов для основной и контрольной групп соответственно (рис. 7).
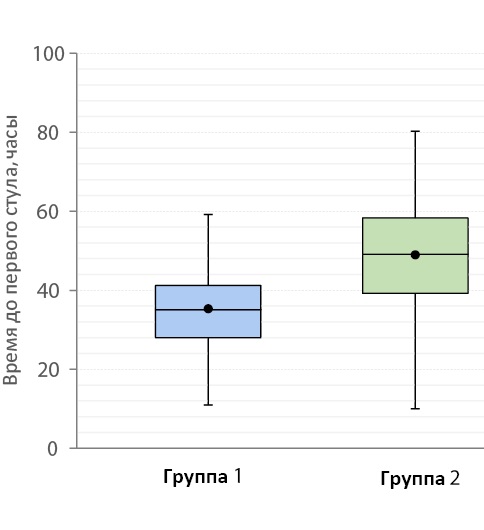
Рисунок 7. Время до первого стула у больных
Обсуждение
В проведённом исследовании приняли участие 99 пациентов с посттуберкулёзным микроцистисом, перенёсших оперативное вмешательство в объёме субтотальной резекции мочевого пузыря с последующей аугментационной кишечной пластикой, 29 из которых оперированы с использованием адаптированного протокола ERAS. Коморбидный фон в обеих группах оказался примерно одинаковый, что исключает влияние дополнительных факторов на результаты исследования. Пациенты группы исследования имели значительно лучшие показатели по таким критериям, как: меньшее количество послеоперационных осложнений по шкале Clavien-Dindo (табл. 3), прирост скорости клубочковой фильтрации (рис. 1), больший функциональный объём неоцистиса (рис. 2), меньший объем остаточной мочи (рис. 3), лучшие показатели IPSS и QoL (рис. 4 и 5), более быстрое отхождение газов (рис. 6), более быстрое время первой дефекации (рис. 7). Следовательно, выполнение протоколов ускоренной реабилитации (ERAS) при аугментационной илеоцистопластике: голод в течение 8 часов до операции, отказ от приёма жидкости за 2 часа до операции, высокое потребление белка и низкое потребление углеводов за 1 день до операции, отказ от подготовки кишечника перед операцией, введение антибиотиков непосредственно перед операцией и их применение в течение 7 дней после операции, отказ от использования наркотических средств во время анестезии, продлённая эпидуральная анальгезия с введением наропина 0,2% через одноразовую инфузионную помпу, отказ от рутинной постановки назогастрального зонда, начало энтерального питания в 1-е сутки после операции, раннее удаление страховых дренажей и уретрального катетера, использование сегмента подвздошной кишки для илеоцистопластики длиной не более 35 см позволяет значительно улучшить функциональные показатели и снизить количество осложнений в послеоперационном периоде.
Заключение
Таким образом, применение протокола ERAS у пациентов, подвергнутых аугментационной илеоцистопластике, существенно снижает частоту серьёзных послеоперационных осложнений (Clavien-Dindo 3 и более), способствует лучшему восстановлению функции почек, достижению наилучших функциональных параметров мочеиспускания и скорейшему восстановлению перистальтики кишечника.
Адаптированный протокол ERAS является безопасным, практичным и эффективным при аугментационной илеоцистопластике у взрослых. Он сопровождается небольшим количеством осложнений, уменьшением проблем с кишечной моторикой и короткой продолжительностью пребывания в отделении реанимации и стационаре. Адаптированный протокол ERAS способен увеличить показатели ранней выписки и, следовательно, снизить расходы медицинских учреждений.
Список литературы
1. Фтизиатрия. Национальное руководство. Под ред. М.И. Перельмана. М.: ГЭОТАР-Медна; 2007.
2. Зубань О.Н., Комяков Б.К. Хирургическая коррекция малого мочевого пузыря. СПб: Стикс; 2011.
3. Melloul E., Hübner M., Scott M., Snowden C., Prentis J., Dejong C.H., Garden O.J., Farges O., Kokudo N., Vauthey J.N., Clavien P.A., Demartines N. Guidelines for Perioperative Care for Liver Surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations. World J Surg. 2016;40(10):2425-2440. DOI: 10.1007/s00268-016-3700-1
4. Nelson G., Kalogera E., Dowdy S.C. Enhanced recovery pathways in gynecologic oncology. Gynecol Oncol. 2014;135(3):586-594. DOI: 10.1016/j.ygyno.2014.10.006
5. Jahantabi E., Soleimanzadeh F., Salehi-Pourmehr H., Saadat M.Z., Nouri M., Hajebrahimi S. An adapted enhanced recovery protocol for adult augmentation cystoplasty in limited sources countries: A pilot clinical trial. Turk J Urol. 2021;47(6):509-517. DOI: 10.5152/tud.2021.21108
6. Зубань О.Н., Чотчаев Р.М. Интестиноцистопластика при туберкулезном поражении мочевого пузыря. Экспериментальная и клиническая урология. 2022;15(4):115-121.
7. Воробьев В.А., Белобородов В.А., Тухиев А.Р. Ускоренное выздоровление. предоперационная подготовка и преабилитация. Экспериментальная и клиническая урология. 2023;16(1):10-17.
8. Wei C., Wan F., Zhao H., Ma J., Gao Z., Lin C. Application of enhanced recovery after surgery in patients undergoing radical cystectomy. J Int Med Res. 2018;46(12):5011-5018. DOI: 10.1177/0300060518789035
9. Romagnoli D., Schiavina R., Bianchi L., Borghesi M., Chessa F., Mineo Bianchi F., Angiolini A., Casablanca C., Giampaoli M., Corsi P.,D'Agostino D., Brunocilla E., Porreca A. Is Fast Track protocol a safe tool to reduce hospitalization time after radical cystectomy with ileal urinary diversion? Initial results from a single high-volume centre. Arch Ital Urol Androl. 2020;91(4):230-236. DOI: 10.4081/aiua.2019.4.230
10. Schulz G.B., Volz Y., Jokisch F., Casuscelli J., Eismann L., Pfitzinger P., Stief C.G., Schlenker B. Aktuelle Studienlage der Enhanced Recovery After Surgery (ERAS®) nach radikaler Zystektomie [Enhanced Recovery After Surgery (ERAS®) after radical cystectomy-current data]. Urologe A. 2021;60(2):162-168. (In German). DOI: 10.1007/s00120-020-01435-y
11. Herbert G., Perry R., Andersen H.K., Atkinson C., Penfold C., Lewis S.J., Ness A.R., Thomas S. Early enteral nutrition within 24 hours of lower gastrointestinal surgery versus later commencement for length of hospital stay and postoperative complications. Cochrane Database Syst Rev. 2019;7(7):CD004080. DOI: 10.1002/14651858.CD004080.pub4
12. Fischer N.D., Epple S., Wittenmeier E., Betz U., Haferkamp A., Jäger W. Implementierung des ERAS®-Protokolls (Enhanced Recovery After Surgery) nach radikaler Zystektomie an der Universitätsmedizin Mainz [Implementation of Enhanced Recovery after Surgery (ERAS®) protocol in radical cystectomy at the University Medical Center Mainz]. Urologe A. 2021;60(2):169-177. (In German). DOI: 10.1007/s00120-020-01430-3
13. Vukovic N., Dinic L. Enhanced Recovery After Surgery Protocols in Major Urologic Surgery. Front Med (Lausanne). 2018;5:93. DOI: 10.3389/fmed.2018.00093
14. Lv Z., Cai Y., Jiang H., Yang C., Tang C., Xu H., Li Z., Fan B., Li Y. Impact of enhanced recovery after surgery or fast track surgery pathways in minimally invasive radical prostatectomy: a systematic review and meta-analysis. Transl Androl Urol. 2020;9(3):1037-1052. DOI: 10.21037/tau-19-884
Об авторах
О. Н. ЗубаньРоссия
Олег Николаевич Зубань – д-р мед. наук, профессор
Москва
М. А. Прокопович
Россия
Максим Александрович Прокопович – канд. мед. наук
Москва
Р. М. Чотчаев
Россия
Радмир Махтиевич Чотчаев – д-р мед. наук
Москва
Д. А. Вишневский
Россия
Дмитрий Алексеевич Вишневский – канд. мед. наук
Москва
М. П. Корчагин
Россия
Михаил Павлович Корчагин
Москва
Рецензия
Для цитирования:
Зубань О.Н., Прокопович М.А., Чотчаев Р.М., Вишневский Д.А., Корчагин М.П. Применение протокола ускоренного восстановления (ERAS) при аугментационной цистопластике у больных туберкулёзом. Вестник урологии. 2025;13(4):5-13. https://doi.org/10.21886/2308-6424-2025-13-4-5-13
For citation:
Zuban O.N., Prokopovich M.A., Chotchaev R.M., Vishnevskii D.A., Korchagin M.P. Enhanced recovery after surgery (ERAS) protocol in augmentation cystoplasty for patients with urogenital tuberculosis. Urology Herald. 2025;13(4):5-13. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-5-13













































