Перейти к:
Анализ факторов прогноза выживаемости у больных с метастазами рака почки в лимфатические узлы
https://doi.org/10.21886/2308-6424-2025-13-3-82-90
Аннотация
Введение. Изучение предикторов, влияющих на показатели выживаемости пациентов с почечноклеточным раком (ПКР) при метастатическом поражении лимфатических узлов (ЛУ), представляется важным аспектом для принятия решений в клинической практике и персонализированном лечении.
Цель исследования. Выявить прогностические факторы, влияющие на показатели общей выживаемости (ОВ) пациентов с метастазами ПКР в ЛУ.
Материалы и методы. Проведён ретроспективный анализ данных 332 пациентов с метастазами ЛУ при ПКР, получавших лечение в ГБУЗ «МГОБ № 62 ДЗМ» и СПб ГБУЗ «ГКОД» в период 2006 – 2022 годов. К группе промежуточного прогноза были отнесены 110 (33,0%) больных, к группе неблагоприятного прогноза — 160 (48,0%). В исследовании изучены клинико-морфологические факторы прогноза, влияющие на показатели ОВ у больных с метастазами ПКР в ЛУ.
Результаты. Показатели 3-летней и 5-летней ОВ у больных с метастазами в ЛУ ПКР (n = 332) составили 35% (95% ДИ 27 – 44) и 21% (95% ДИ 15 – 29) соответственно, при этом медиана ОВ составила 21,9 (95% ДИ 14,9 – 29,9) месяца. При однофакторном анализе установлено, что отрицательное влияние на показатели ОВ больных с метастазами ПКР в ЛУ оказывают статус по ECOG (p < 0,001), гистологический подтип опухоли (p < 0,001), степень дифференцировки опухоли по Fuhrman (p < 0,001), тип метастазов (p < 0,001), метастазы в кости (p = 0,001) и печень (p < 0,001), прогноз по IMDC (p < 0,001), проведение нефрэктомии и метастазэктомии (p < 0,001). Многофакторный анализ показал, что предикторами низкой ОВ являются гистологический подтип опухоли (ОШ 1,50; 95% ДИ 1,01 – 2,23), степень дифференцировки опухоли по Fuhrman (ОШ 1,74; 95% ДИ 1,00 – 3,03), прогноз по IMDC (ОР 2,60; 95% ДИ 1,46 – 4,62), а также проведение нефрэктомии (ОШ 2,39; 95% ДИ 1,51 – 3,79) и метастазэктомии (ОШ 0,61; 95% ДИ 0,39 – 0,95).
Заключение. У пациентов с метастазами рака почки в ЛУ факторами неблагоприятного прогноза выживаемости являются гистологический подтип ПКР, степень дифференцировки опухоли по Fuhrman, прогноз по IMDC, а также проведение нефрэктомии и метастазэктомии. Необходимы дальнейшие исследования по изучению прогностических факторов с целью повышения эффективности персонализированного лечения и повышения показателей ОВ пациентов с ПКР.
Ключевые слова
Для цитирования:
Семенов Д.В., Орлова Р.В., Широкорад В.И., Кострицкий С.В. Анализ факторов прогноза выживаемости у больных с метастазами рака почки в лимфатические узлы. Вестник урологии. 2025;13(3):82-90. https://doi.org/10.21886/2308-6424-2025-13-3-82-90
For citation:
Semyonov D.V., Orlova R.V., Shirokorad V.I., Kostritsky S.V. The analysis of overall survival and estimation of survival prognostic factors in patients diagnosed with renal cancer metastases to lymph nodes. Urology Herald. 2025;13(3):82-90. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-82-90
Введение
Почечноклеточный рак (ПКР) составляет 90% случаев первичных злокачественных опухолей почки [1][2], около 30% пациентов на момент диагностики ПКР имеет отдалённые метастазы [1 – 4]. Поражение лимфатических узлов (ЛУ) является одной из наиболее частых локализаций метастазов ПКР [3][5] и ассоциируется с плохим прогнозом [6 – 10]. Поражение ЛУ удваивает риск развития отдалённых метастазов у пациентов ПКР и оказывает значительное негативное влияние на показатели выживаемости [11]. С быстрым развитием многочисленных методов визуализации улучшилась идентификация и выявление метастазов в ЛУ, однако микрометастазы часто остаются незамеченными. В настоящее время проводятся исследования по выявлению прогностических факторов у больных с метастазами ПКР в ЛУ [12 – 17].
Поэтому изучение прогностических факторов и выявление пациентов ПКР с высоким риском метастазов в ЛУ представляется важным аспектом для принятия клинических решений и персонализированного лечения.
Цель исследования: изучить показатели выживаемости у больных с метастазами рака почки в ЛУ и выявить факторы, негативно влияющее на прогноз жизни.
Материалы и методы
Проведён ретроспективный анализ данных 332 пациентов с лимфатическими метастазами ПКР, которым проведено комбинированное лечение на базе Московской городской онкологической больницы № 62 и Городского клинического онкологического диспансера (Санкт-Петербург) с 2006 по 2022 год.
Средний возраст больных составил 61,5 (28 – 95) года. Все пациенты получали системную противоопухолевую терапию. Подробная характеристика пациентов приведена в таблице 1.
Таблица 1. Характеристика больных
Table 1. Patient demographics
Показатели Values | Количество больных, n (%) Number of patients, n (%) |
Пол | Gender | |
мужской | male | 256 (77,1) |
женский | female | 76 (22,9) |
Возраст, лет | Age, years | |
18 – 44 | 22 (6,6) |
45 – 59 | 145 (43,87) |
60 – 74 | 144 (43,4) |
≥75 | 21 (6,3) |
Статус по шкале ECOG | ECOG scale status | |
0 | 15 (4,5) |
1 | 119 (35,8) |
2 | 115 (34,7) |
3 | 83 (25,0) |
Локализация первичной опухоли | Localization of the primary tumor | |
справа | right | 151 (45,5) |
слева | left | 170 (51,2) |
двустороннее | bilateral | 11 (3,3) |
Гистологический вариант | Histological type | |
светлоклеточный рак | clear-cell carcinoma | 285 (85,8) |
несветлоклеточный рак | non-clear-carcinoma | 47 (14,2) |
Степень дифференцировки | Differentiation grade | |
G1 | 42 (12,7) |
G2 | 105 (31,6) |
G3 | 185 (55,7) |
Тип метастазов | Metastasis type | |
метахронные | metachronous | 175 (52,7) |
синхронные | synchronous | 157 (47,3) |
Количество метастазов | Number of metastases | |
солитарные | solitary | 2 (0,6) |
единичные | single | 28 (8,4) |
множественные | multiple | 302 (91,0) |
Прогноз по IMDC | IMDC prognosis | |
благоприятный | favorable | 62 (18,7) |
промежуточный | intermediate | 110 (33,1) |
неблагоприятный | poor | 160 (48,2) |
Локализация метастазов | Metastases | |
кости | bones | 97 (29,2) |
лёгкие | lungs | 236 (71,1) |
печень | liver | 56 (16,9) |
головной мозг | brain | 10 (3,0) |
Предыдущая нефрэктомия | Prior nephrectomy | 290 (87,3) |
Метастазэктомия | Metastasectomy | 52 (15,7) |
Лучевая терапия | Radiation therapy | 27 (8,1) |
Примечание. IMDC — Международный консорциум баз данных по метастатической почечноклеточной карциноме; ECOG — Восточная кооперативная группа онкологов
Note. IMDC — International mRCC Database Consortium; ECOG — Eastern Cooperative Oncology Group
Статистический анализ. В исследовании изучены клинико-морфологические факторы прогноза, влияющие на показатели ОВ у больных с метастазами в ЛУ ПКР. Данные пациентов были консолидированы в виде электронных таблиц и анализировались с помощью программы Statistica v.12.0 (StatSoft Inc., Tulsa, OK, USA). Нормальность распределения оценивали с помощью теста Shapiro-Wilk. Продолжительность жизни рассчитывали от даты диагноза до даты последнего наблюдения или смерти. Выживаемость оценивали по методу Kaplan-Meier, различия выживаемости определяли с помощью log-rank теста; для исключения факторов, не имеющих самостоятельной прогностической значимости, использовали регрессионный анализ Cox. Категориальные данные описывались с указанием абсолютных значений (n) и процентных долей (%), количественные данные представлены в виде медиан (Me) и средних значений (M). Для оценки связи между определённым исходом и фактором риска использовали метод соотношения шансов с расчётом скорректированного соотношения шансов (AOR — adjusted odds ratio) с границами 95%-ного доверительного интервала (95% ДИ). Проводился анализ показателей ОВ у больных с метастазами в ЛУ ПКР в зависимости от пола, возраста, ECOG-статуса, локализации первичной опухоли и гистологического варианта, степени градации по Fuhrman, группы прогноза по IMDC, типа, количества и локализации метастазов, проведения нефрэктомии и метастазэктомии. Принятый уровень достоверности различий р < 0,05.
Результаты
Показатели 3-летней и 5-летней ОВ у больных с метастазами ПКР в ЛУ составили 35% (95% ДИ 27 – 44) и 21% (95% ДИ 15 – 29) соответственно, при этом медиана ОВ составила 21,9 (95% ДИ 14,9 – 29,9) месяца (рис. 1).
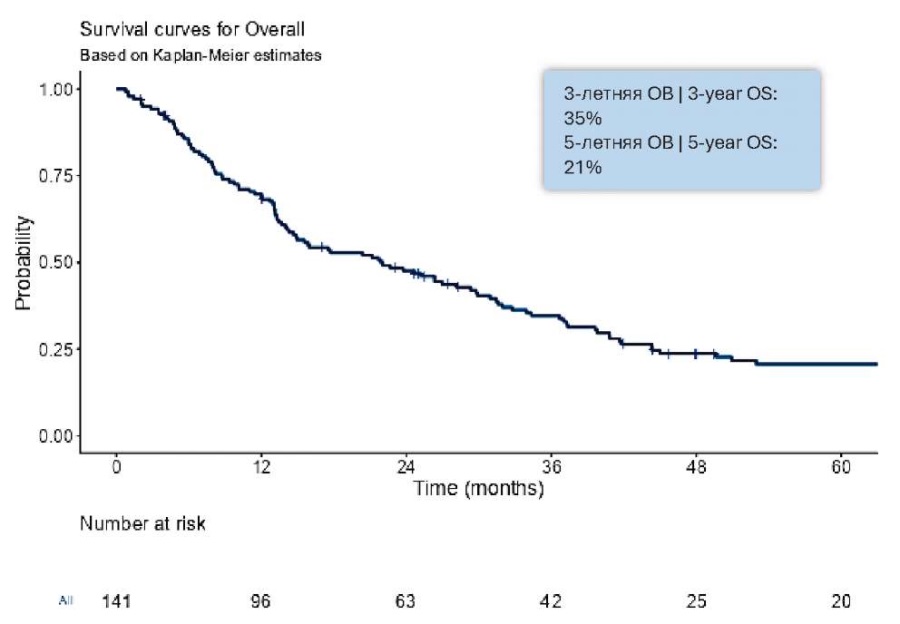
Рисунок 1. Общая выживаемость больных с метастазами в лимфатические узлы ПКР
Figure 1. Overall survival of patients with RCC metastases to lymph nodes
Медиана ОВ при светлоклеточном и несветлоклеточном ПКР составила 30 (95% ДИ 26,9 – 36,7) и 13,9 (95% ДИ 9,7 – 23) месяца соответственно, а при G1, G2 и G3 — 63,5 (95% ДИ 46,3 – 78), 38,6 (95% ДИ 28,2 – 49,8) и 17,6 (95% ДИ 14,3 – 24) месяца соответственно (рис. 2).
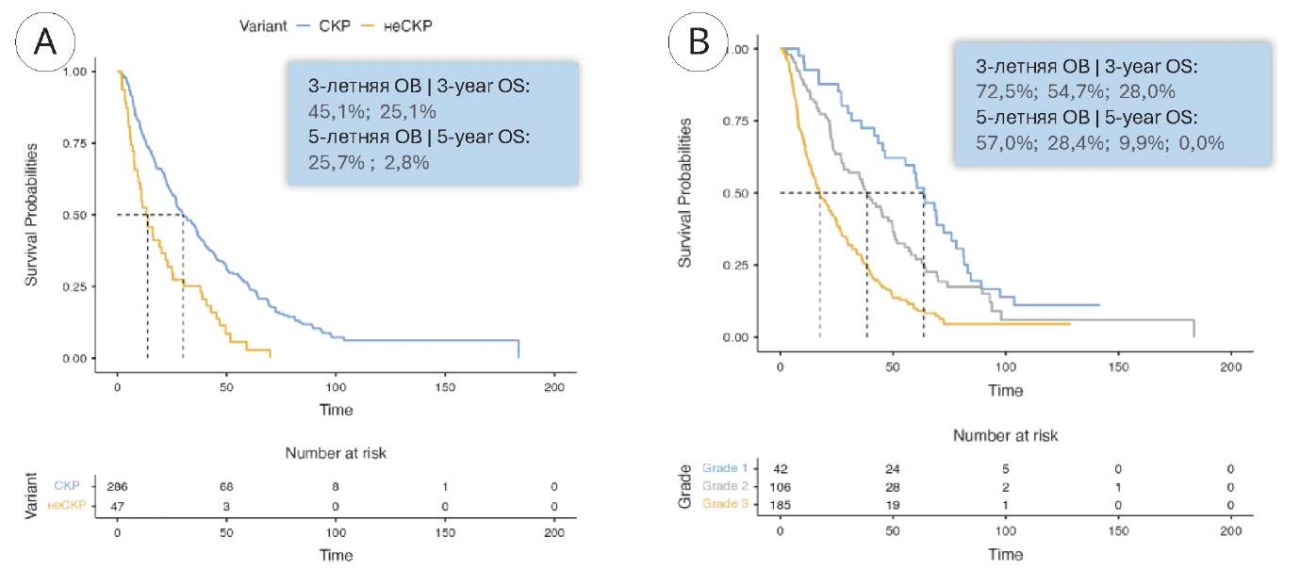
Рисунок 2. Общая выживаемость больных с метастазами в лимфатические узлы ПКР в зависимости от гистологического подтипа (A) и дифференцировки опухоли по Fuhrman (B)
Figure 2. Overall survival in patients with RCC metastases to lymph nodes depending on histologic subtype (A) and Fuhrman tumour differentiation (B)
Медиана ОВ составила при ECOG 0, 1, 2, 3 — 72,4 (95% ДИ 55,4 – NA), 51,7 (95% ДИ 45 – 60,5), 26,9 (95% ДИ 22,7 – 35,8) и 8 (95% ДИ 7,4 – 10,5) месяца соответственно, а при синхронных и метахронных метастазах — 21,6 (95% ДИ 15,6 – 26,3) и 35,9 (95% ДИ 28,2 – 45,4) месяца соответственно (рис. 3).

Рисунок 3. Общая выживаемость больных с метастазами в лимфатические узлы ПКР в зависимости от ECOG статуса (А) и типа метастазов (В)
Figure 3. Overall survival of patients with RCC metastases to lymph nodes depending on ECOG status (A) and type of metastases (B)
Медиана ОВ при отсутствии и наличии метастазов в кости составила 31,9 (95% ДИ 26,9 – 39,7) и 17,7 (95% ДИ 13,9 – 26,9) месяца соответственно, а при отсутствии и наличии метастазов в печень —31,5 (95% ДИ 26,9 – 38,1) и 13,4 (95% ДИ 9,3 – 21,9) месяца соответственно (рис. 4).
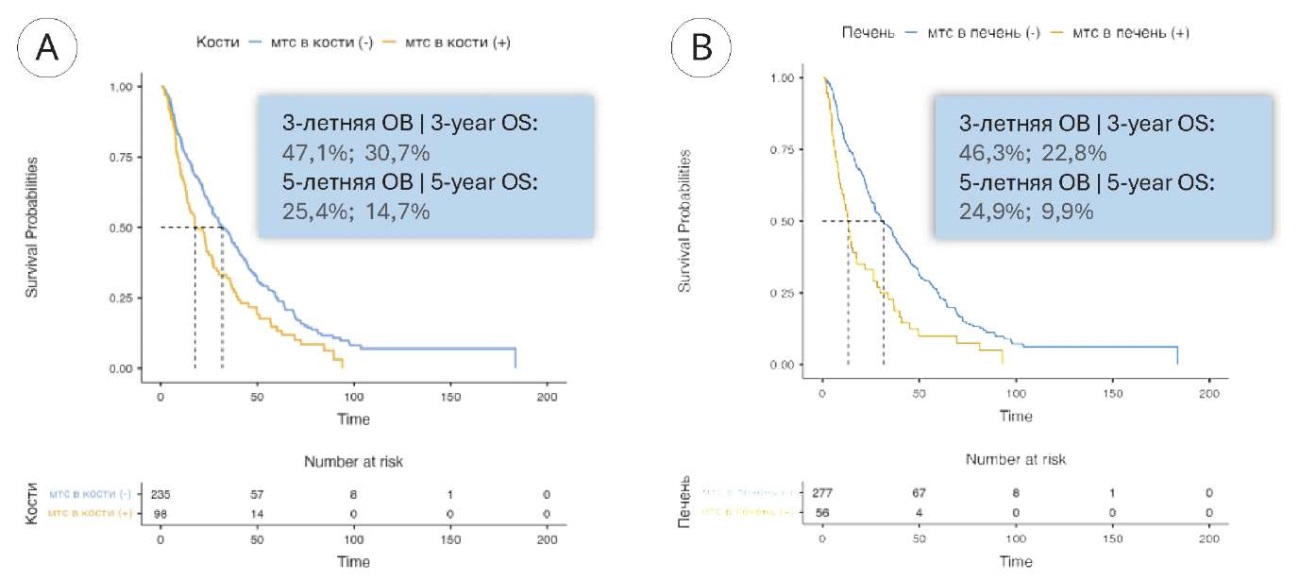
Рисунок 4. Общая выживаемость больных с метастазами в лимфатические узлы ПКР в зависимости от наличия метастазов в костях (А) и печени (В)
Figure 4. Overall survival of patients with RCC metastases to bones (A) and liver (B)
Медиана ОВ при благоприятном, промежуточном и неблагоприятном прогнозах составила 69,3 (95% ДИ 60,2 – 84,5), 38,1 (95% ДИ 31,9 – 43,9) и 13,6 (95% ДИ 11 – 17,6) месяца соответственно (рис. 5).
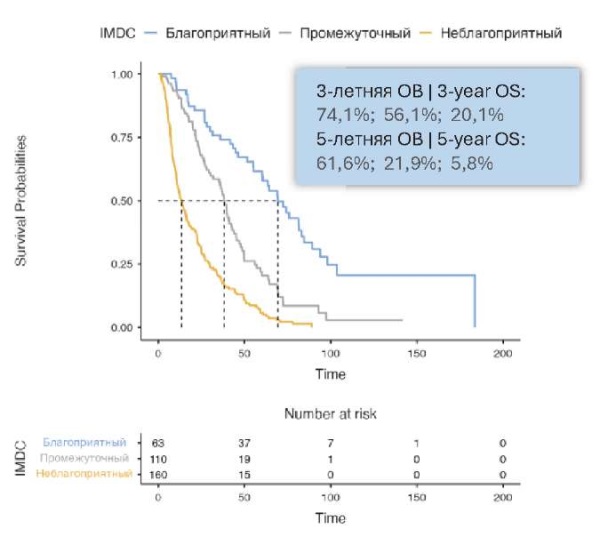
Рисунок 5. Общая выживаемость больных с метастазами в лимфатические узлы ПКР в зависимости от прогноза по IMDC
Figure 5. Overall survival of patients with RCC metastases to lymph nodes depending on IMDC prognosis
Медиана ОВ при выполнении нефрэктомии и её отсутствии составила 31,9 (95% ДИ 27 – 38,1) и 9,3 (95% ДИ 7,9 – 13,9) месяца соответственно, а при отсутствии или проведении метастазэктомии — 24,9 (95% ДИ 21,9 – 29,8) и 47,9 (95% ДИ 34,1 – 70,6) месяца соответственно (рис. 6).
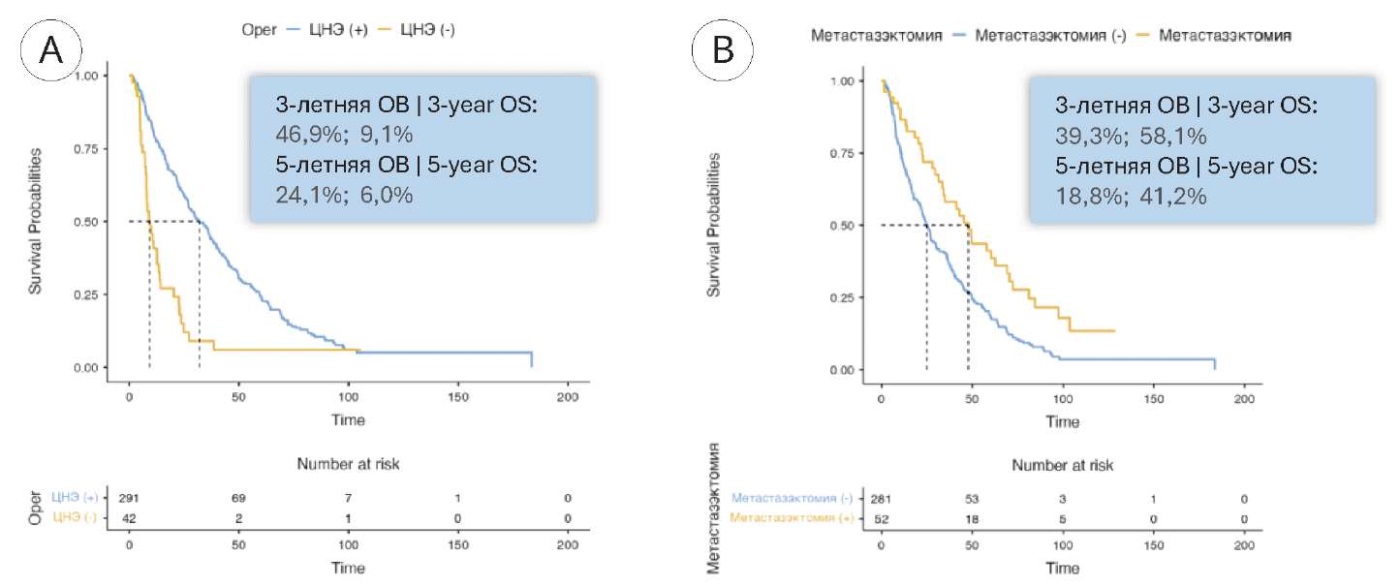
Рисунок 6. Общая выживаемость больных с метастазами в лимфатические узлы ПКР: А — при выполнении нефрэктомии и без неё; В — при проведении метастазэктомии и без неё
Figure 6. Overall survival of patients with RCC metastases to lymph nodes (n=332): with and without — nephrectomy (A) and metastasectomy (B)
При однофакторном анализе у больных с метастазами рака почки в ЛУ выявлено, что отрицательное влияние на показатели выживаемости оказывали статус по ECOG (p < 0,001), гистологический подтип (p < 0,001), степень дифференцировки опухоли по Fuhrman (p < 0,001), тип метастазов (p < 0,001), метастазы в кости (p = 0,001) и печень (p < 0,001), прогноз по IMDC (p < 0,001), проведение нефрэктомии и метастазэктомии (p < 0,001) (табл. 2).
Таблица 2. Факторы прогноза общей выживаемости больных с метастазами в лимфатические узлы ПКР (однофакторный и многофакторный анализ)
Table 2. Prognostic factors for overall survival of patients with RCC metastases to lymph nodes) (single-factor and multi-factor analysis)
Факторы Factors | Количество больных (%) Number of patients (%) | Отношение рисков (95% доверительный интервал; p) Hazard rario (95% confidence interval; p) | |
Однофакторный анализ Univariate test | Многофакторный анализ Multivariate test | ||
Статус по шкале ECOG | ECOG status | |||
0 | 15 (4,5) | – | – |
1 | 119 (35,8) | 1,59 (0,73 – 3,46; p = 0,239) | 0,69 (0,28 – 1,70; p = 0,419) |
2 | 115 (34,7) | 3,28 (1,52 – 7,07; p = 0,002) | 0,82 (0,33 – 2,07; p = 0,680) |
3 | 83 (25,0) | 10,59 (4,84 – 23,18; p < 0,001) | 1,74 (0,65 – 4,62; p = 0,270) |
Гистологический вариант | Histological type | |||
светлоклеточный рак | clear-cell carcinoma | 285 (85,8) | – | – |
несветлоклеточный рак | non-clear-cell carcinoma | 47 (14,2) | 2,16 (1,56 – 3,01; p < 0,001) | 1,50 (1,01 – 2,23; p = 0,044) |
Степень Дифференцировки | Differentiation grade | |||
G1 | 42 (12,7) | – | – |
G2 | 105 (31,6) | 1,52 (1,01 – 2,29; p = 0,045) | 1,57 (0,96 – 2,56; p = 0,072) |
G3 | 185 (55,7) | 2,97 (2,03 – 4,36; p < 0,001) | 1,74 (1,00 – 3,03; p = 0,048) |
Тип метастазов | Metastasis type | |||
метахронные | metachronous | 175 (52,7) | – | – |
синхронные | synchronous | 157 (47,3) | 0,56 (0,44 – 0,72; p < 0,001) | 1,35 (0,96 – 1,91; p = 0,084) |
Метастазы в кости | Bones metastases | |||
есть | present | 97 (29,2) | – | – |
нет | no | 235 (70,8) | 1,55 (1,19 – 2,02; p = 0,001) | 0,88 (0,60 – 1,29; p = 0,515) |
Метастазы в печень | Liver metastases | |||
есть | present | 56 (16,9) | – | – |
нет | no | 276 (83,1) | 1,95 (1,43 – 2,66; p < 0,001) | 1,03 (0,66– 1,60, p = 0,908) |
Прогноз по IMDC | IMDC prognosis | |||
благоприятный | favorable | 62 (18,7) | – | – |
промежуточный | intermediate | 110 (33,1) | 2,35 (1,58 – 3,50, p < 0,001) | 2,11 (1,24 – 3,59; p = 0,006) |
неблагоприятный | poor | 160 (48,2) | 5,68 (3,90 – 8,28; p < 0,001) | 2,60 (1,46 – 4,62; p = 0,001) |
Нефрэктомия | Prior nephrectomy | |||
да | yes | 290 (87,3) | – | – |
нет | no | 42 (12,7) | 2,60 (1,82 – 3,72; p < 0,001) | 2,39 (1,51 – 3,79, p < 0,001) |
Метастазэктомия | Metastasectomy | |||
да | yes | 52 (15,7) | – | – |
нет | no | 280 (84,3) | 0,53 (0,37 – 0,76, p < 0,001) | 0,61 (0,39 – 0,95; p = 0,029) |
Примечание. В таблице приведены только факторы, продемонстрировавшие прогностическую значимость
Note. The table only presents factors with prognostic significance
При многофакторном анализе гистологический подтип (ОР = 1,50; 95% ДИ = 1,01 – 2,23), степень дифференцировки опухоли по Fuhrman (ОР = 1,74; 95% ДИ = 1,00 – 3,03), прогноз по IMDC (ОР = 2,60; 95% ДИ = 1,46 – 4,62), а также проведение нефрэктомии (ОР = 2,39; 95% ДИ = 1,51 – 3,79) и метастазэктомии (ОР = 0,61; 95% ДИ = 0,39 – 0,95) были факторами, оказывающими независимое отрицательное влияние на показатели ОВ у пациентов с метастазами в лимфатические узлы ПКР (табл. 2).
Обсуждение
В настоящее время примерно у трети пациентов с ПКР развиваются метастазы, и от 2,7 до 10% являются метастазами в лимфатические узлы, которые значительно ухудшают прогноз течения заболевания [10][18 – 21]. Метастазирование в лимфатические узлы является наиболее важным неблагоприятным прогностическим фактором у больных ПКР, приводящим к 8-кратному риску смерти [22][23]. Показатели 3-летней ОВ пациентов с метастазами в ЛУ и без них составили 86,5% и 61,1% соответственно [24]. В нашей работе показатели 3-летней ОВ составили всего лишь 35%. Поэтому для клиницистов очень важно точно оценить риск метастазирования в лимфатические узлы и разработать оптимальный план лечения. Компьютерная томография и магнитно-резонансная томография в настоящее время являются идеальными методами лучевой диагностики ПКР, но их способность различать нормальный размер лимфатических узлов или микрометастазы ограниченна [25]. Помимо неточных результатов визуализации, низкий процент положительных результатов интраоперационной биопсии также может привести к неудаче в обнаружении и диагностике метастазов в лимфатические узлы ПКР на ранних стадиях, что ограничивает возможности дальнейшего системного лечения. Ранее были выявлены независимые факторы риска наличия метастазов в лимфатические узлы, такие как гистологический подтип опухоли, метастазы в печень, локализация опухолевого процесса и размер опухоли [26]. В нашей работе гистологический подтип, степень дифференцировки опухоли по Fuhrman, прогноз по IMDC, а также проведение нефрэктомии и метастазэктомии были статистически значимыми прогностическим факторами, влияющими на показатели общей выживаемости. Корреляция между размером опухоли и частотой встречаемости метастазов в лимфатические узлы ПКР, выявленная в работах данных авторов [27][28], не изучалась в нашем исследовании. Метастазирование в печень увеличивало риск в 1,59 раза у пациентов с метастазами в ЛУ ПКР по сравнению с пациентами без них [28], что также отмечено в нашей работе. Метастазы в лёгкие были фактором риска наличия метастазов в ЛУ ПКР по результатам однофакторного анализа (p < 0,001) [26], в нашем исследовании данная связь не выявлена (р = 0,576). Локализация первичной опухоли почки не увеличивает риск возникновения метастазов в лимфатические узлы, что подтверждено данными нашей работы (р = 0,870) [29].
Данное исследование также имеет некоторые ограничения. Прежде всего, из-за ретроспективного характера. С другой стороны, нами изучены клинико-морфологические показатели и выделены прогностические факторы у 332 больных с метастазами в лимфатические узлы ПКР.
Дальнейшие мультицентровые исследования необходимы в будущем для определения клинических, патоморфологических и молекулярно-генетических факторов прогноза для повышения эффективности системной терапии.
Заключение
В нашем исследовании гистологический подтип ПКР, степень дифференцировки опухоли по Fuhrman, прогноз по IMDC, а также проведение нефрэктомии и метастазэктомии были дополнительными независимыми прогностическими факторами, влияющими на показатели ОВ у пациентов с метастазами в лимфатические узлы ПКР в реальной клинической практике. Необходимы дальнейшие исследования для выявления прогностических факторов у больных с метастазами ПКР в лимфатические узлы с целью повышения эффективности персонализированного лечения и повышения показателей выживаемости.
Список литературы
1. Choueiri TK, Motzer RJ. Systemic Therapy for Metastatic Renal-Cell Carcinoma. N Engl J Med. 2017;376(4):354-366. DOI: 10.1056/NEJMra1601333
2. Linehan WM, Schmidt LS, Crooks DR, Wei D, Srinivasan R, Lang M, Ricketts CJ. The Metabolic Basis of Kidney Cancer. Cancer Discov. 2019;9(8):1006-1021. DOI: 10.1158/2159-8290.CD-18-1354
3. Gong D, Sun Y, Guo C, Sheu TJ, Zhai W, Zheng J, Chang C. Androgen receptor decreases renal cell carcinoma bone metastases via suppressing the osteolytic formation through altering a novel circEXOC7 regulatory axis. Clin Transl Med. 2021;11(3):e353. DOI: 10.1002/ctm2.353
4. Dabestani S, Thorstenson A, Lindblad P, Harmenberg U, Ljungberg B, Lundstam S. Renal cell carcinoma recurrences and metastases in primary non-metastatic patients: a population-based study. World J Urol. 2016;34(8):1081-1086. DOI: 10.1007/s00345-016-1773-y
5. McKay RR, Kroeger N, Xie W, Lee JL, Knox JJ, Bjarnason GA, MacKenzie MJ, Wood L, Srinivas S, Vaishampayan UN, Rha SY, Pal SK, Donskov F, Tantravahi SK, Rini BI, Heng DY, Choueiri TK. Impact of bone and liver metastases on patients with renal cell carcinoma treated with targeted therapy. Eur Urol. 2014;65(3):577-584. DOI: 10.1016/j.eururo.2013.08.012
6. Zheng W, Zhu W, Yu S, Li K, Ding Y, Wu Q, Tang Q, Zhao Q, Lu C, Guo C. Development and validation of a nomogram to predict overall survival for patients with metastatic renal cell carcinoma. BMC Cancer. 2020;20(1):1066. DOI: 10.1186/s12885-020-07586-7
7. Karakiewicz PI, Briganti A, Chun FK, Trinh QD, Perrotte P, Ficarra V, Cindolo L, De la Taille A, Tostain J, Mulders PF, Salomon L, Zigeuner R, Prayer-Galetti T, Chautard D, Valeri A, Lechevallier E, Descotes JL, Lang H, Mejean A, Patard JJ. Multi-institutional validation of a new renal cancer-specific survival nomogram. J Clin Oncol. 2007;25(11):1316-1322. DOI: 10.1200/JCO.2006.06.1218
8. Patil S, Figlin RA, Hutson TE, Michaelson MD, Négrier S, Kim ST, Huang X, Motzer RJ. Prognostic factors for progression-free and overall survival with sunitinib targeted therapy and with cytokine as first-line therapy in patients with metastatic renal cell carcinoma. Ann Oncol. 2011;22(2):295-300. DOI: 10.1093/annonc/mdq342
9. Mekhail TM, Abou-Jawde RM, Boumerhi G, Malhi S, Wood L, Elson P, Bukowski R. Validation and extension of the Memorial Sloan-Kettering prognostic factors model for survival in patients with previously untreated metastatic renal cell carcinoma. J Clin Oncol. 2005;23(4):832-841. DOI: 10.1200/JCO.2005.05.179
10. Hsieh JJ, Purdue MP, Signoretti S, Swanton C, Albiges L, Schmidinger M, Heng DY, Larkin J, Ficarra V. Renal cell carcinoma. Nat Rev Dis Primers. 2017;3:17009. DOI: 10.1038/nrdp.2017.9
11. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87-108. DOI: 10.3322/caac.21262
12. Hutterer GC, Patard JJ, Perrotte P, Ionescu C, de La Taille A, Salomon L, Verhoest G, Tostain J, Cindolo L, Ficarra V, Artibani W, Schips L, Zigeuner R, Mulders PF, Valeri A, Chautard D, Descotes JL, Rambeaud JJ, Mejean A, Karakiewicz PI. Patients with renal cell carcinoma nodal metastases can be accurately identified: external validation of a new nomogram. Int J Cancer. 2007;121(11):2556-61. DOI: 10.1002/ijc.23010
13. Zhi Y, Li X, Qi F, Hu X, Xu W. Association of Tumor Size with Risk of Lymph Node Metastasis in Clear Cell Renal Cell Carcinoma: A Population-Based Study. J Oncol. 2020;2020:8887782. DOI: 10.1155/2020/8887782
14. Li P, Peng C, Xie Y, Wang L, Gu L, Wu S, Shen D, Xuan Y, Ma X, Zhang X. A Novel Preoperative Nomogram for Predicting Lymph Node Invasion in Renal Cell Carcinoma Patients Without Metastasis. Cancer Manag Res. 2019;11:9961-9967. DOI: 10.2147/CMAR.S218254
15. Gershman B, Takahashi N, Moreira DM, Thompson RH, Boorjian SA, Lohse CM, Costello BA, Cheville JC, Leibovich BC. Radiographic size of retroperitoneal lymph nodes predicts pathological nodal involvement for patients with renal cell carcinoma: development of a risk prediction model. BJU Int. 2016;118(5):742-749. DOI: 10.1111/bju.13424
16. Babaian KN, Kim DY, Kenney PA, Wood CG Jr, Wong J, Sanchez C, Fang JE, Gerber JA, Didic A, Wahab A, Golla V, Torres C, Tamboli P, Qiao W, Matin SF, Wood CG, Karam JA. Preoperative predictors of pathological lymph node metastasis in patients with renal cell carcinoma undergoing retroperitoneal lymph node dissection. J Urol. 2015;193(4):1101-1107. DOI: 10.1016/j.juro.2014.10.096
17. Capitanio U, Abdollah F, Matloob R, Suardi N, Castiglione F, Di Trapani E, Capogrosso P, Gallina A, Dell’Oglio P, Briganti A, Salonia A, Montorsi F, Bertini R. When to perform lymph node dissection in patients with renal cell carcinoma: a novel approach to the preoperative assessment of risk of lymph node invasion at surgery and of lymph node progression during follow-up. BJU Int. 2013;112(2):E59-66. DOI: 10.1111/bju.12125
18. Tannir NM, Pal SK, Atkins MB. Second-Line Treatment Landscape for Renal Cell Carcinoma: A Comprehensive Review. Oncologist. 2018;23(5):540-555. DOI: 10.1634/theoncologist.2017-0534
19. Li X, Song D, Liu H, Wang Z, Ma G, Yu M, Zhang Y, Zeng Y. Expression levels of VEGF-C and VEGFR-3 in renal cell carcinoma and their association with lymph node metastasis. Exp Ther Med. 2021;21(6):554. DOI: 10.3892/etm.2021.9986
20. Bazzi WM, Sjoberg DD, Feuerstein MA, Maschino A, Verma S, Bernstein M, O’Brien MF, Jang T, Lowrance W, Motzer RJ, Russo P. Long-term survival rates after resection for locally advanced kidney cancer: Memorial Sloan Kettering Cancer Center 1989 to 2012 experience. J Urol. 2015;193(6):1911-1916. DOI: 10.1016/j.juro.2014.12.022
21. Zareba P, Russo P. The prognostic significance of nodal disease burden in patients with lymph node metastases from renal cell carcinoma. Urol Oncol. 2019;37(5):302.e1-302.e6. DOI: 10.1016/j.urolonc.2019.02.006
22. Dudani S, de Velasco G, Wells JC, Gan CL, Donskov F, Porta C, Fraccon A, Pasini F, Lee JL, Hansen A, Bjarnason GA, Beuselinck B, Pal SK, Yuasa T, Kroeger N, Kanesvaran R, Reaume MN, Canil C, Choueiri TK, Heng DYC. Evaluation of Clear Cell, Papillary, and Chromophobe Renal Cell Carcinoma Metastasis Sites and Association With Survival. JAMA Netw Open. 2021;4(1):e2021869. DOI: 10.1001/jamanetworkopen.2020.21869
23. Türkvatan A, Akdur PO, Olçer T, Cumhur T. Coarctation of the aorta in adults: preoperative evaluation with multidetector CT angiography. Diagn Interv Radiol. 2009;15(4):269-274. DOI: 10.4261/1305-3825.DIR.2434-08.1
24. Demir T, Aliyev A, Beşiroğlu M, Araz M, Köstek O, Sakin A, Shbair ATM, Çoban G, Ersöz C, Şeker M, Türk HM. Is lymph node dissection necessary for staging while undergoing nephrectomy in patients with renal cell carcinoma? Curr Probl Cancer. 2021;45(1):100619. DOI: 10.1016/j.currproblcancer.2020.100619
25. Coll DM, Smith RC. Update on radiological imaging of renal cell carcinoma. BJU Int. 2007;99(5 Pt B):1217-1222. DOI: 10.1111/j.1464-410X.2007.06824.x
26. Feng X, Hong T, Liu W, Xu C, Li W, Yang B, Song Y, Li T, Li W, Zhou H, Yin C. Development and validation of a machine learning model to predict the risk of lymph node metastasis in renal carcinoma. Front Endocrinol (Lausanne). 2022;13:1054358. DOI: 10.3389/fendo.2022.1054358
27. Thompson RH, Hill JR, Babayev Y, Cronin A, Kaag M, Kundu S, Bernstein M, Coleman J, Dalbagni G, Touijer K, Russo P. Metastatic renal cell carcinoma risk according to tumor size. J Urol. 2009;182(1):41-45. DOI: 10.1016/j.juro.2009.02.128
28. Kates M, Korets R, Sadeghi N, Pierorazio PM, McKiernan JM. Predictors of locally advanced and metastatic disease in patients with small renal masses. BJU Int. 2012;109(10):1463-1467. DOI: 10.1111/j.1464-410X.2011.10553.x
29. Nini A, Larcher A, Cazzaniga W, Dell’Oglio P, Cianflone F, Muttin F, Ripa F, Salonia A, Briganti A, Montorsi F, Bertini R, Capitanio U. The side and the location of the primary tumor does not affect the probability of lymph node invasion in patients with renal cell carcinoma. World J Urol. 2019;37(8):1623-1629. DOI: 10.1007/s00345-018-2573-3
Об авторах
Д. В. СеменовРоссия
Дмитрий Владимирович Семенов — д-р мед. наук.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Р. В. Орлова
Россия
Рашида Вахидовна Орлова —д-р мед. наук, профессор.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. И. Широкорад
Россия
Валерий Иванович Широкорад — д-р мед. наук.
Московская обл., пос. Истра
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
С. В. Кострицкий
Россия
Станислав Викторович Кострицкий
Московская обл., пос. Истра
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Семенов Д.В., Орлова Р.В., Широкорад В.И., Кострицкий С.В. Анализ факторов прогноза выживаемости у больных с метастазами рака почки в лимфатические узлы. Вестник урологии. 2025;13(3):82-90. https://doi.org/10.21886/2308-6424-2025-13-3-82-90
For citation:
Semyonov D.V., Orlova R.V., Shirokorad V.I., Kostritsky S.V. The analysis of overall survival and estimation of survival prognostic factors in patients diagnosed with renal cancer metastases to lymph nodes. Urology Herald. 2025;13(3):82-90. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-82-90
JATS XML













































