Перейти к:
Оценка эффективности препарата на основе соматостатинсодержащего белка при лечении бесплодия на модели лейпрорелин-индуцированного нарушения сперматогенеза у самцов крыс
https://doi.org/10.21886/2308-6424-2025-13-3-61-70
Аннотация
Введение. Разрабатываемое новое лекарственное средство на основе соматостатинсодержащего белка предполагается к применению при женском и мужском бесплодии для повышения репродуктивной способности организма, активизации фолликулов яичникового резерва и вступления их в фазу роста, ускорения начала роста покоящихся фолликулов, увеличения объёма эякулята и повышения качественных характеристик спермы.
Цель исследования. Оценить фармакологическую активность препарата на основе соматостатинсодержащего белка на модели нарушения сперматогенеза у самцов крыс, вызванного однократным введением лейпрорелина в дозе 600 мкг/кг.
Материалы и методы. В рамках исследования проводили оценку микроскопических изменений в тканях семенников, массовых коэффициентов органов репродуктивной системы (семенники, эпидидимисы, семенные пузырьки), показателей спермограммы, а также уровней тестостерона и соматотропина в плазме крови.
Результаты. Установлено, что на фоне снижения гонадотропинов и последующего снижения тестостерона, вызванных длительным воздействием лейпрорелина, тестируемый препарат на основе соматостатинсодержащего белка в диапазоне доз 10 – 250 мкг/кг приводит к увеличению уровня соматотропина и тестостерона, нормализации процесса сперматогенеза. Выявлено, что под влиянием исследуемого препарата происходило значительное увеличение концентрации и доли подвижных сперматозоидов.
Заключение. Полученные результаты схожи с данными ранее проведённых работ об улучшении показателей сперматогенеза при введении животным экзогенного соматотропного гормона, что позволяет предположить возможный механизм действия тестируемого препарата, а именно синтез специфических аутоантител к соматостатину и блокирование его действия, что, в свою очередь, приводит к увеличению содержания в организме эндогенного соматотропного и половых гормонов.
Ключевые слова
Для цитирования:
Матичин А.А., Крышень К.Л., Матичина А.А., Фаустова Н.М., Гущин Я.А., Макарова М.Н., Решетник В.В., Сухих Г.Т., Юдин С.М., Лунин В.Г. Оценка эффективности препарата на основе соматостатинсодержащего белка при лечении бесплодия на модели лейпрорелин-индуцированного нарушения сперматогенеза у самцов крыс. Вестник урологии. 2025;13(3):61-70. https://doi.org/10.21886/2308-6424-2025-13-3-61-70
For citation:
Matichin A.A., Kryshen K.L., Matichina A.A., Faustova N.M., Gushchin Ya.A., Makarova M.N., Reshetnik V.V., Sukhikh G.T., Yudin S.M., Lunin V.G. Somatostatin-containing protein-based drug in the treatment of infertility: efficacy evaluation using a leuprorelin-induced spermatogenesis impairment model in male rats. Urology Herald. 2025;13(3):61-70. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-61-70
Введение
Согласно статистическим данным, бесплодием страдает примерно 15% пар. При этом 40 – 50% всех случаев приходится на мужское бесплодие [1 – 4]. В соответствии с литературными данными мужское бесплодие может быть вызвано такими распространёнными причинами, как инфекции, передаваемые половым путём (22,1%), варикоцеле (14,9%), эндокринные нарушения (14,8%), обструкция семявыносящих путей (2%), генетические аномалии (2,8%), аутоиммунные процессы (4,7%). Есть и другие факторы, которые косвенно влияют на репродуктивную систему, например, метаболический синдром и оксидативный стресс [1][2][5 – 7]. При этом, согласно актуальным данным, доля случаев мужского бесплодия, причины которого не удалось установить, составляет от 25% до 40% [4].
Основой механизма действия разрабатываемого лекарственного средства является стимуляция выработки соматостатин-специфических антител и ингибирование действия соматостатина, что впоследствии приводит к увеличению содержания в организме соматотропина [8] и опосредованному увеличению уровня инсулиноподобного фактора роста 1 (IGF-1), что в результате может приводить к повышению качественных характеристик спермы.
С учётом основополагающей роли фолликулостимулирующего и лютеинизирующего гормонов в регуляции синтеза IGF-1 в семенниках стоит отметить, что косвенную роль в регуляции содержания IGF-1 в семенниках может играть соматотропин, потенцируя действие гонадотропинов. Исследования роли IGF-1 при идиопатическом бесплодии продолжаются и в настоящее время. Отмечается, что у 10% мужчин, страдающих бесплодием неясного генеза, наблюдается положительный эффект на фоне терапии гормоном роста [5].
В соответствии с ранее проведёнными исследованиями было выявлено значительное снижение IGF-1 у пациентов с идиопатическим мужским бесплодием. Была установлена зависимость уровня IGF-1 от стадии сперматогенеза. Экспрессия IGF-1 снижается от сперматогоний к сперматозоидам. Инсулиноподобный фактор роста 1 играет крайне важную роль в процессе сперматогенеза, селекции мужских половых клеток и элементов микроокружения семенных канальцев. Спектр действия IGF-1 и его рецепторов на мужские половые клетки, в первую очередь, заключается в стимуляции пролиферации, стероидогенеза и этапов половой дифференцировки сперматогоний в первичные сперматоциты. Концентрация IGF-1 прямо коррелирует с количеством сперматоцитов, находящихся на стадии пахитены [9 – 12]. Таким образом, снижение уровня IGF-1 может являться одним из факторов, имеющих место при идиопатическом мужском бесплодии. Гормональная терапия для улучшения мужской фертильности с использованием нескольких гормонов гонадотропной оси показала переменные результаты с небольшим улучшением клинического состояния. По существующей теории, через стимуляцию продукции IGF-1 гормон роста может воздействовать на сперматогенез [13][14].
Цель исследования: оценить фармакологическую активность препарата на основе соматостатинсодержащего белка на самцах крыс с лейпрорелин-индуцированным нарушением сперматогенеза.
Материалы и методы
Проведённое исследование входило в комплекс доклинических исследований по оценке безопасности и эффективности нового лекарственного препарата на основе рекомбинантного соматостатинсодержащего белка.
Тестируемым препаратом являлось новое лекарственное средство на основе соматостатинсодержащего белка (ООО «ЮРСФАРМ», Россия). Действующее вещество представляет собой рекомбинантный белок, содержащий соматостатин (СОМ), состоящий из белка носителя — глюкан-связывающего домена (ГСД), спейсерной последовательности (-) и двух копий антигенной детерминанты соматостатина (ГСД-СОМ-СОМ) с молекулярной массой 39 кДа [8].
Эксперимент проводили на самцах крыс линии Wistar в возрасте 3 – 4 недель и массой тела 71 – 97 г, полученных из питомника АО «НПО «ДОМ ФАРМАЦИИ» (Россия). Условия содержания животных соответствовали Директиве 2010/63/EU от 22 сентября 2010 года по охране животных, используемых в научных целях. Для питания использовали «Корм для содержания лабораторных животных» ПК-120-1, приготовленный по ГОСТу 34566-2019.
Индукцию патологии проводили путём однократного подкожного введения лейпрорелина (Люкрин депо®, Takeda Pharmaceutical Company, Ltd, Osaka, Japan) в дозе 600 мкг/кг [15]. Применение лейпрорелина нарушает сперматогенез путём десенситизации рецепторов на поверхности клеток гипофиза, реагирующих на гонадтропин-рилизинг-гормон, что приводит к уменьшению секреции гонадотропинов и половых гормонов. В соответствии с инструкцией по медицинскому применению у мужчин при длительном применении лейпрорелина концентрация тестостерона снижается до кастрационного и препубертатного уровней1.
Животные были распределены на 5 групп по 10 самцов крыс в каждой группе: группа 1 — интактная; группа 2 — негативный контроль (патология + контрольное вещество); группа 3 — патология + тестируемый препарат в дозе 10 мкг/кг; группа 4 — патология + тестируемый препарат в дозе 50 мкг/кг; группа 5 — патология + тестируемый препарат в дозе 250 мкг/кг. В качестве контрольного вещества использовали раствор натрия хлорида 0,9%. Тестируемый препарат и контрольное вещество вводили животным подкожно двукратно с интервалом 2 недели (в 1‑й и 14‑й дни эксперимента), как представлено на рисунке. Подобная схема введения широко используется для достижения необходимого иммунологического ответа2. Выбор сроков введения тестируемого препарата и индуктора патологии был сделан на основании ожидаемых параметров кинетики выработки антител и периода формирования патологии. Животных эвтаназировали на 35‑й день эксперимента с помощью диоксида углерода (CO2) с последующим обескровливанием из полостей сердца.
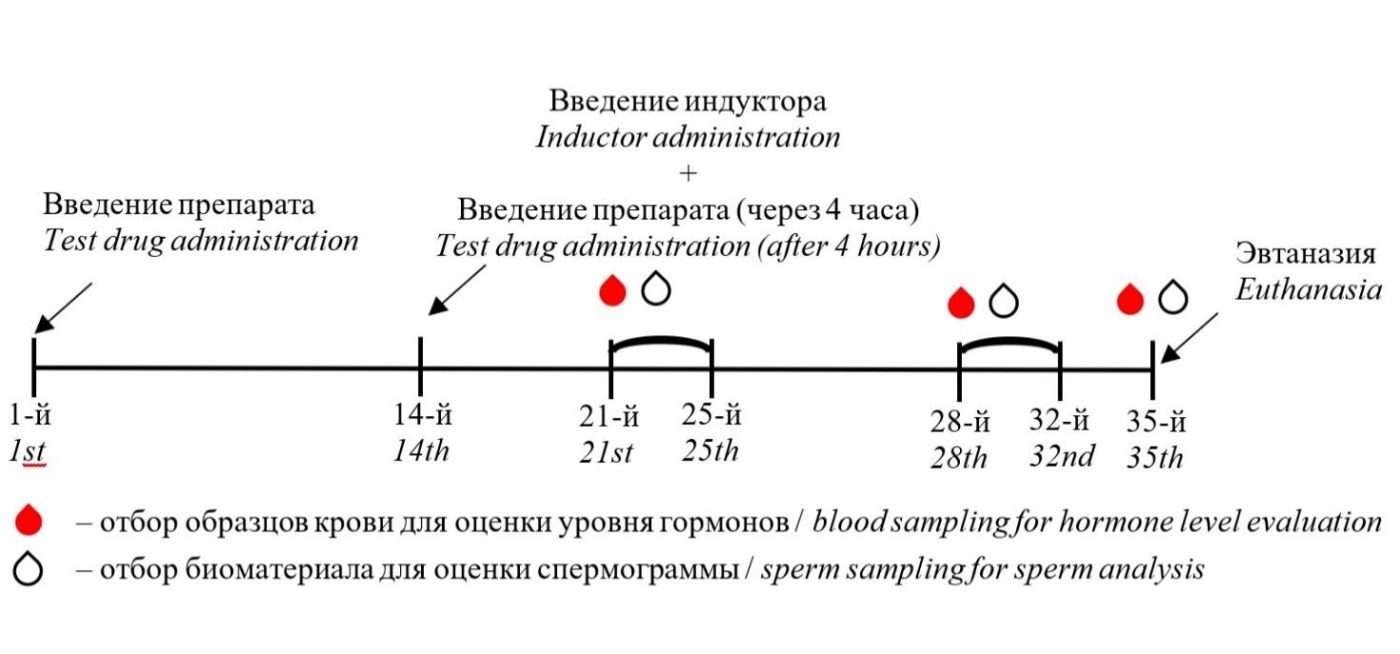
Рисунок. Дизайн эксперимента
Figure. Study design
В течение эксперимента проводили ежедневное наблюдение за общим состоянием животных, еженедельно регистрировали изменения массы тела. Для оценки уровня тестостерона у животных всех экспериментальных групп отбирали образцы крови из хвостовой вены, а также из полостей сердца во время проведения плановой эвтаназии. Образцы крови, собранные в день эвтаназии, также использовали для определения уровня соматотропина. Для оценки спермограммы прижизненно забирали образцы биологического материала методом трансректальной электростимуляции семенных бугорков [16]. В день эвтаназии образцы спермы забирали из придатков семенников.
Концентрации соматотропина и тестостерона определяли с использованием коммерчески доступных наборов: “Elisa kit for Growth Hormone (GH)” (“Cloud-Clone Corp.”, Katy, TX, USA) и «Тестостерон-ИФА-бест» («Вектор-Бест», Санкт-Петербург, Россия) при двух длинах волн 450 нм и 650 нм на многофункциональном микропланшетном анализаторе “CLARIOstar” (“BMG Labtech” GmbH, Ortenberg, Germany).
Во время эвтаназии у животных извлекали и взвешивали семенники, придатки семенников и семенные пузырьки. Далее образцы фиксировали в 10%-ном растворе нейтрального формалина для дальнейшего гистологического анализа [17]. Срезы окрашивали гематоксилином и эозином. Анализ гистологических срезов проводили при помощи светооптического микроскопа Accu-Scope 3000 SERIES (“Accu Scope Inc.”, Commak, NY, USA) при увеличении 40, 100 и 400. Оценка семенников осуществлялась по следующим критериям:
- Выраженность дистрофических изменений сперматогенного эпителия:
0 — нет изменений;
1 — минимальные изменения;
2 — умеренно выраженная дистрофия, появление в просвете канальцев отдельных изменённых сперматоцитов, умеренное нарушение стратификации слоев;
3 — максимально выраженная дистрофия сперматоцитов, множество изменённых клеток в просвете, стратификация слоев значительно нарушена.
- Нарушение сперматогенеза оценивали по методике S. G. Johnsen [18] в 10 произвольных семенных канальцах у каждого животного.
Этическое заявление. Исследование одобрено локальной независимой биоэтической комиссией АО «НПО «ДОМ ФАРМАЦИИ» (№БЭК 3.29/19 от 15 мая 2019 года). Исследование соответствовало принципам «трёх R» (Reduction, Refinement, Replacement).
Статистический анализ. Для анализа данных и построения графиков использовали лицензированное программное обеспечение Statistica v.10.0 (“StatSoft Inc.”, Tulsa, OK, USA) и Prism 9.0 (“GraphPad Software Inc.”, Graphpad Holdings LLC, San Diego, CA, USA). Все данные были проверены на соответствие закону нормального распределения с помощью критерия Shapiro-Wilk. В зависимости от типа распределения данные были представлены в виде среднего значения (M), стандартного отклонения (SD), медианы (Me) и квартильного размаха [ Q1; Q3]. Далее применяли однофакторный дисперсионный анализ (ANOVA) или критерий Kruskal-Wallis. В качестве апостериорного анализа использовали критерий Tukey с поправкой Welch на неодинаковые размеры групп или тест Dana. Различия были определены при 0,05 уровне значимости.
Результаты
На протяжении всего эксперимента отклонений в поведении и общем состоянии животных не наблюдали, отмечали равномерный прирост массы тела экспериментальных животных во всех группах.
По результатам анализа спермограммы в интактной группе животных концентрация сперматозоидов в среднем составляла 71,8 × 10⁶/мл на протяжении эксперимента. На долю подвижных сперматозоидов приходилось 73,6% от общего количества сперматозоидов. Доля живых сперматозоидов составляла 72,6%, мертвых — 21,2% и незрелых — 6,3%. В группе негативного контроля с 21-го дня эксперимента (через 7 дней после индукции патологии) наблюдалось статистически значимое уменьшение концентрации сперматозоидов, доли подвижных и живых сперматозоидов наряду с увеличением доли неподвижных и незрелых форм в сравнении с интактной группой (р < 0,05). Данные изменения в группе негативного контроля сохранялись до окончания эксперимента, что подтвердило развитие модельной патологии.
На фоне введения тестируемого препарата наблюдали дозозависимое увеличение концентрации сперматозоидов, достигшее статистической значимости при дозе 250 мкг/кг (увеличение в среднем на 20,4%) в сравнении с группой негативного контроля (р < 0,05). К 28-му и 35-му дням эксперимента (через 14 и 21 день после введения лейпрорелина) концентрация сперматозоидов у животных, получавших тестируемый препарат в дозе 250 мг/кг, соответствовала значениям животных интактной группы. В дозах 50 и 250 мкг/кг регистрировали значимое увеличение доли подвижных сперматозоидов и их живых форм наряду с уменьшением доли неподвижных сперматозоидов и незрелых форм спустя 7 – 14 дней после введения лейпрорелина (в сравнении с группой негативного контроля) (табл. 1).
Таблица 1. Показатели спермограммы на протяжении эксперимента
Table 1. Evaluation of semen parameters during the experiment
Исследуемые показатели / день эксперимента Parameters / Experimental day | Группы / доза Groups / Dose | |||||
Интактная группа Intact | Негативный контроль. Введение носителя Negative control. Vehicle administration | Экспериментальные группы. Введение тестируемого препарата Experimental groups. Test drug administration | ||||
— | 0 мкг/кг 0 µg/kg | 10 мкг/кг 10 µg/kg | 50 мкг/кг 50 µg/kg | 250 мкг/кг 250 µg/kg | ||
(M ± SD) | ||||||
Концентрация сперматозоидов, млн/мл Sperm concentration, mln/mL | 21‑й | 72,9 ± 8,49 | 56,7 ± 8,38 | 53,1 ± 4,22 | 58,7 ± 7,95 | 64,3 ± 6,22 |
28‑й | 69,7 ± 6,95 | 56,0 ± 5,90 | 56,8 ± 5,00 | 64,4 ± 4,79 | 70,7 ± 4,07 | |
35‑й | 72,4 ± 9,56 | 58,2 ± 7,86 | 57,0 ± 7,48 | 60,6 ± 7,24 | 70,8 ± 8,50 | |
Доля подвижных сперматозоидов, % Sperm motility, % | 21‑й | 75,3 ± 8,22 | 57,7 ± 11,21 | 58,9 ± 3,72 | 67,3 ± 6,99 | 65,5 ± 4,81 |
28‑й | 72,6 ± 8,24 | 57,0 ± 6,81 | 59,5 ± 10,48 | 69,0 ± 4,12 | 70,6 ± 2,88 | |
35‑й | 73,1 ± 4,72 | 64,0 ± 6,99 | 67,5 ± 5,84 | 69,8 ± 6,63 | 68,7 ± 5,38 | |
Доля живых сперматозоидов, % Proportion of live sperm, % | 21‑й | 71,0 ± 4,08 | 58,0 ± 5,60 | 60,3 ± 8,56 | 64,1 ± 4,71 | 66,8 ± 7,65 |
28‑й | 69,3 ± 5,06 | 52,7 ± 7,63 | 60,3 ± 2,66 | 65,0 ± 4,76 | 65,9 ± 6,01 | |
35‑й | 76,1 ± 5,43 | 63,6 ± 5,40 | 61,8 ± 5,69 | 67,7 ± 5,81 | 70,9 ± 7,21 | |
Доля незрелых сперматозоидов, % Proportion of immature sperm, % | 21‑й | 6,6 ± 2,30 | 22,7 ± 5,38 | 19,1 ± 9,87 | 13,6 ± 5,80 | 7,3 ± 4,89 |
28‑й | 7,3 ± 1,98 | 23,0 ± 8,46 | 16,2 ± 6,49 | 10,6 ± 1,81 | 9,71 ± 4,42 | |
35‑й | 5,3 ± 2,31 | 16,4 ± 5,62 | 14,3 ± 5,03 | 7,4 ± 2,22 | 6,2 ± 3,05 | |
Примечания: 1) M — среднее; SD — стандартное отклонение; n — количество животных. 2) На 21‑й и 28‑й дни эксперимента не удалось отобрать биоматериал у всех животных. Статистический анализ данных в данные дни был проведён с использованием поправки на неравный размер выборки. 3) * — статистически значимое отличие от интактной группы, критерий Tukey с поправкой Welch на неравные выборки и без, однофакторный ANOVA, p < 0,05. 4) # — статистически значимое отличие от группы негативного контроля, критерий Tukey с поправкой Welch на неравные выборки и без, однофакторный ANOVA, p < 0,05
Notes: 1) M — mean, SD — standard deviation, n — group size. 2) It was not possible to sample biomaterial from all animals on 21st and 28th days. On these days statistical data analysis was performed using correction for unequal sample size. 3) * — significant difference compared to intact group, Tukey’s test with or without Welch’s test for unequal group size, one-way ANOVA, p < 0,05. 4) # — significant difference compared to negative control group, Tukey’s test with or without Welch’s test for unequal group size, one-factor ANOVA, p < 0,05
Кроме вышеперечисленных изменений, в группах животных с лейпрорелин-индуцированным нарушением сперматогенеза наблюдали сперматозоиды с аномалиями строения в виде отсутствия хвоста, хаотичные колебательные движения головки с шейкой вокруг своей оси. Данные изменения регистрировали во всех экспериментальных группах с индуцированной патологией, но наиболее часто патологические формы сперматозоидов встречались в группе негативного контроля и у животных, получавших тестируемый препарат в дозе 10 мкг/кг. У животных, получавших тестируемый препарат в дозах 50 и 250 мкг/кг, патологические формы сперматозоидов наблюдали в единичных случаях.
У животных интактной группы значения концентрации тестостерона с 21-го (через 7 дней после введения индуктора) по 35‑й дни эксперимента находились в пределах 1,37 – 21,18 нмоль/л, что согласуется с литературными данными [19]. В группе негативного контроля у животных с лейпрорелин-индуцированным нарушением сперматогенеза диапазон значений тестостерона был существенно ниже, составляя 0,46 – 8,34 нмоль/л. Наиболее выраженное негативное воздействие на уровень концентрации тестостерона наблюдали на 28‑й день эксперимента (через 14 дней после введения лейпрорелина). В этот период снижение концентрации тестостерона у животных контрольной группы относительно интактной группы составило 70% (критерий Тukey, p < 0,05).
У животных, получавших тестируемый препарат в дозах 50 и 250 мкг/кг, в образцах плазмы крови на 28‑й день эксперимента отмечали дозозависимое повышение тестостерона в сравнении с группой негативного контроля на 65 и 75% соответственно (табл. 2).
Таблица 2. Уровень гормонов в плазме крови самцов аутбредных крыс (n = 10)
Table 2. Serum hormone level of male rats (n = 10)
Исследуемые показатели / день эксперимента Parameters / Experimental day | Группы / доза Groups / Dose | |||||
Интактная группа Intact | Негативный контроль. Введение носителя Negative control. Vehicle administration | Экспериментальные группы. Введение тестируемого препарата Experimental groups. Test drug administration | ||||
— | 0 мкг/кг 0 µg/kg | 10 мкг/кг 10 µg/kg | 50 мкг/кг 50 µg/kg | 250 мкг/кг 250 µg/kg | ||
(M ± SD) | ||||||
Тестостерон, нмоль/мл Testosterone, nmol/mL | 21‑й | 21st | 5,8 ± 2,95 | 4,8 ± 2,14 | 3,9 ± 0,86 | 4,4 ± 1,55 | 5,6 ± 2,03 |
28‑й | 28th | 6,7 ± 3,65 | 2,0 ± 1,37* | 2,1 ± 1,40* | 3,3 ± 2,57 | 3,5 ± 3,00 | |
35‑й | 35th | 9,0 ± 6,45 | 4,5 ± 1,99 | 6,8 ± 3,70 | 5,2 ± 3,56 | 4,3 ± 2,43 | |
Соматотропин, нг/мл Somatotropin, ng/mL | 35‑й | 35th | 1,1 ± 0,37 | 0,6 ± 0,27# | 1,1 ± 0,68 | 0,7 ± 0,12 | 1,8 ± 0,69* |
Примечания: 1) M — среднее; SD — стандартное отклонение; n — количество животных. 2) # — показатель уровня соматотропина у животного №2.2 значительно превышал среднее значение по группе и не был включён в дальнейшую статистическую обработку. 3) * — статистически значимое отличие от интактной группы, критерий Tukey, однофакторный ANOVA, p < 0,05
Notes: 1) M — mean; SD — standard deviation; n — group size. 2) # — somatotropin level of male No. 2.2 significantly exceeded the mean for the group and was not included in further statistical data analysis. 3) * — significant difference compared to intact group, Tukey’s test, one-way ANOVA, p < 0,05
У животных интактной группы уровень соматотропина в плазме крови на 35‑й день эксперимента находился в диапазоне 0,45 – 1,70 нг/мл. У самцов крыс с лейпрорелин-индуцированным нарушением сперматогенеза без лечения (группа негативного контроля) уровень соматотропина был ниже значений интактной группы в среднем на 45% (табл. 2).
Влияние тестируемого препарата на уровень соматотропного гормона (СТГ) у животных с патологией было зарегистрировано только в дозе 250 мкг/кг, отмечено статистически значимое увеличение на 67% уровня соматотропина в сравнении с группой негативного контроля и превышение значений в интактной группе в 1,5 раза.
Однократное введение индуктора патологии оказало выраженное влияние на органы репродуктивной системы. Так, наблюдали значимое уменьшение массы и массовых коэффициентов эпидидимисов у животных группы негативного контроля в сравнении с интактной группой (p < 0,05) (табл. 3). В группах, получавших тестируемый препарат в исследуемых дозах, отмечалось дозозависимое увеличение массы исследуемых органов в сравнении с группой негативного контроля, но не достигавшее статистической значимости.
Таблица 3. Масса и массовые коэффициенты семенников, эпидидимисов и семенных пузырьков аутбредных крыс (n = 10)
Table 3. Weight and weight ratios of rat testis, epididymides and semen vesicles (n = 10)
Исследуемые показатели / день эксперимента Parameters / Experimental day | Группы / доза Groups / Dose | |||||
Интактная группа Intact | Негативный контроль. Введение носителя Negative control. Vehicle administration | Экспериментальные группы. Введение тестируемого препарата Experimental groups. Test drug administration | ||||
— | 0 мкг/кг 0 µg/kg | 10 мкг/кг 10 µg/kg | 50 мкг/кг 50 µg/kg | 250 мкг/кг 250 µg/kg | ||
(M ± SD) | ||||||
Семенники Testis | Масса, г | Weight, g | 2,42 ± 0,192 | 1,84 ± 0,419 | 1,97 ± 0,387 | 2,13 ± 0,216 | 2,22 ± 0,353 |
Масс. коэф., % | WR, % | 1,26 ± 0,205 | 0,97 ± 0,250 | 1,04 ± 0,177 | 1,11 ± 0,130 | 1,13 ± 0,161 | |
Эпидидимисы Epididymides | Масса, г | Weight, g | 0,60 ± 0,129 | 0,43 ± 0,108* | 0,54 ± 0,154 | 0,57 ± 0,123 | 0,58 ± 0,105 |
Масс. коэф., % | WR, % | 0,31 ± 0,050 | 0,23 ± 0,062* | 0,29 ± 0,074 | 0,30 ± 0,060 | 0,30 ± 0,059 | |
Семенные пузырьки Semen vesicles | Масса, г | Weight, g | 0,27 ± 0,157 | 0,17 ± 0,071 | 0,17 ± 0,101 | 0,19 ± 0,075 | 0,22 ± 0,117 |
Масс. коэф., % | WR, % | 0,14 ± 0,060 | 0,09 ± 0,041 | 0,09 ± 0,046 | 0,10 ± 0,039 | 0,11 ± 0,054 | |
Примечания: 1) M — среднее; SD — стандартное отклонение; n — количество животных; масс. коэф. — массовые коэффициенты. 2) * — статистически значимое отличие от интактной группы, критерий Тьюки, однофакторный ANOVA, p < 0,05
Notes: 1) M — mean; SD — standard deviation; n — group size; WR — weight ratio. 2) * — significant difference compared to intact group, Tukey’s test, one-way ANOVA, p < 0,05
В интактной группе дистрофические изменения семенников отсутствовали. У животных с модельной патологией чаще всего встречались минимальные дистрофические изменения сперматогенного эпителия, реже — умеренно выраженная дистрофия с отдельными изменёнными сперматоцитами, максимально выраженная дистрофия сперматоцитов со множеством изменённых клеток в просвете и значительным нарушением стратификации слоёв отмечена в единичных случаях. В таблице 4 представлены данные о состоянии дистрофических изменений в семенных канальцах у самцов аутбредных крыс. Отмечено статистически значимое увеличение частоты дистрофических изменений у животных группы негативного контроля на 25% и групп, получавших тестируемый препарат в дозах 10 и 50 мкг/кг, на 25% и 15% соответственно в сравнении с животными интактной группы. В группе, получавшей тестируемый препарат в дозе 250 мкг/кг, дистрофические изменения встречались в 10% случаев без статистически значимых отличий по частоте от интактной группы. Наблюдали дозозависимую тенденцию к снижению развития дистрофических изменений в группах животных, получавших тестируемый препарат в исследуемом диапазоне доз (табл. 4).
Таблица 4. Выраженность дистрофических изменений в семенных канальцах самцов аутбредных крыс (n = 10)
Table 4. Severity of dystrophic changes in the seminiferous tubules of male outbred rats (n = 10)
Группы Groups | Доза, мкг/кг Dose, µg/kg | Выраженность дистрофических изменений Severity of dystrophic changes | |||
Балл | Score | % патологии % pathology, (min; max) | ||||
Me | [ Q1; Q3] | (min; max) | |||
Интактная группа Intact | — | 0,0 | [ 0,0; 0,0] | (0,0; 0,0) | 0,0 (0,0; 0,0) |
Негативный контроль. Введение носителя Negative control. Vehicle administration | 0 | 3,5* | [ 1,0; 5,0]* | (0,0; 7,0)* | 25,0 (0,0; 40,0)* |
Экспериментальные группы. Введение тестируемого препарата Experimental groups. Test drug administration | 10 | 2,5* | [ 0,0; 4,0]* | (0,0; 11,0)* | 25,0 (0,0; 60,0)* |
50 | 2,5* | [ 2,0; 5,0]* | (0,0; 8,0)* | 15,0 (0,0; 60,0)* | |
250 | 1,5 | [ 0,0; 4,0] | (0,0; 6,0) | 10,0 (0,0; 40,0) | |
Примечания: 1) Me — медиана; [ Q1; Q3] — квартильный размах; (min; max) — разброс значений; n — количество животных. 2) * — статистически значимое отличие от интактной группы, тест Данна, критерий Краскела-Уоллиса, p < 0,05
Notes: 1) Me — median; [ Q1; Q3] — interquartile range; (min; max) — range ; n — group size. 2) * — significant difference compared to intact group, Dana’s test, Kruskal-Wallis test, p < 0,05
При гистологической оценке сперматогенеза по критериям, предложенным S.G. Johnsen [18], у большинства животных во всех группах наблюдали нормальный сперматогенез с сохраненной рядностью эпителия (оценивали как 10 баллов). Слегка нарушенный сперматогенез со слабой дезорганизацией эпителия и наличием большого числа поздних сперматид (9 баллов) был выявлен у большинства животных. Реже наблюдали уменьшение количества сперматозоидов и поздних сперматид (8 баллов). Поскольку данная картина была зарегистрирована во всех экспериментальных группах, включая интактную, обнаруженные изменения следует считать проявлением, зависящим, возможно, от гормонального фона животных и функционального состояния отдельных извитых канальцев.
Выявленные патологические изменения не носили тотальный характер и распределялись в семенниках одного и того же животного неравномерно: канальцы с нормальным и нарушенным сперматогенезом (7 и 6 баллов) наблюдали рядом.
Обсуждение
В исследовании была проведена оценка эффективности нового лекарственного средства, предназначенного для индукции выработки специфических антител к соматостатину (анти-СОМ-IgG) и опосредованной стимуляции СТГ на модели нарушения сперматогенеза у самцов крыс, вызванного введением лейпрорелина. Соматотропный гормон оказывает влияние на репродуктивную физиологию мужчин, такое как стимулирование стероидогенеза, повышение чувствительности к гонадотропинам, а также значительное стимулирующее действие на сперматогенез.
Результаты проведённого исследования согласуются с литературными данными. В группе негативного контроля у животных с лейпрорелин-индуцированным нарушением сперматогенеза без последующего лечения в эксперименте обнаруживались патологические изменения в тканях семенников. Наблюдали выраженные дистрофические изменения в семенных канальцах, нарушение процесса сперматогенеза в сравнении с интактной группой. При анализе спермограммы значимо снижалась концентрация сперматозоидов и увеличивалась доля неподвижных сперматозоидов наряду со снижением доли подвижных, увеличивалась доля незрелых форм в сравнении с интактной. Также были выявлены патологические формы сперматозоидов без хвостов, наиболее часто встречающиеся именно в данной группе и отсутствующие в интактной. Отмечено значимое снижение концентрации тестостерона в сравнении с интактной группой через 14 дней после индукции патологии, что соответствует литературным данным.
На фоне лечения тестируемым препаратом в исследуемых дозах при гистологическом исследовании тканей семенников наблюдались относительно негативного контроля: положительная дозозависимая тенденция к нормализации процесса сперматогенеза, увеличение массы исследуемых анатомических структур и снижение дистрофических процессов в тканях семенных канальцев. Тестируемый препарат способствовал увеличению доли подвижных сперматозоидов наряду со снижением неподвижных, увеличению доли живых сперматозоидов со снижением доли незрелых, а также увеличению концентрации сперматозоидов. Полученные результаты схожи с литературными данными, показывающими, что введение СТГ приводит к увеличению концентрации и улучшению морфологии сперматозоидов.
Заключение
Полученные результаты схожи с данными ранее проведённых работ об улучшении показателей сперматогенеза при введении животным экзогенного СТГ, что позволяет предположить возможный механизм действия тестируемого препарата, а именно синтез специфических аутоантител к соматостатину и блокирование его действия, что, в свою очередь, приводит к увеличению содержания в организме эндогенного соматотропного и половых гормонов.
1. Инструкция по медицинскому применению лекарственного препарата Люкрин Депо®. П N015554/01. Ссылка активна на 03.04.2025. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=5b6b335e-5823-484d-9519-891c96e3b3a0&t=
2. Эффективность вакцины в контролируемых и реальных условиях и уровень защиты. ВОЗ. 2021. Дата обновления 10.03.2025. Ссылка активна на 03.04.2025 URL: https://www.who.int/ru/news-room/feature-stories/detail/vaccine-efficacy-effectiveness-and-protection
Список литературы
1. Achermann APP, Esteves SC. Clinical Management of Men with Nonobstructive Azoospermia due to Spermatogenic Failure. In: Parekattil S., Esteves S., Agarwal A. (eds.) Male Infertility. Springer, Cham; 2020. DOI: 10.1007/978-3-030-32300-4_23
2. Latif T, Kold Jensen T, Mehlsen J, Holmboe SA, Brinth L, Pors K, Skouby SO, Jørgensen N, Lindahl-Jacobsen R. Semen Quality as a Predictor of Subsequent Morbidity: A Danish Cohort Study of 4,712 Men With Long-Term Follow-up. Am J Epidemiol. 2017;186(8):910-917. DOI: 10.1093/aje/kwx067
3. Жанкина Р.А. Мужское бесплодие и мезенхимальные стволовые клетки: есть ли взаимосвязь? Global Science and Innovations: Central Asia. 2021;1(12):13-19. eLIBRARY ID: 46376340
4. Роживанов Р.В. Стимуляция сперматогенеза гонадотропинами и антиэстрогенами при патозооспермии и бесплодии: Дис. ... канд. мед. наук. Москва; 2019. Ссылка активна на 03.04.2025. https://www.endocrincentr.ru/sites/default/files/specialists/science/dissertation/dissertatsia_kravtsova_2020.pdf.
5. Фаниев М.В., Шевченко Н.П., Кадыров З.А. Современные стратегии ведения инфертильных мужчин с хроническим бактериальным простатитом на этапе прегравидарной подготовки в протоколе вспомогательных репродуктивных технологий. Андрология и генитальная хирургия. 2017;18(3):44-53. eLIBRARY ID: 30498695; EDN: ZRKMDH
6. Koc G, Ozdemir AA, Girgin G, Akbal C, Kirac D, Avcilar T, Guney AI. Male infertility in Sertoli cell-only syndrome: An investigation of autosomal gene defects. Int J Urol. 2019;26(2):292-298. DOI: 10.1111/iju.13863
7. Rodprasert W, Virtanen HE, Mäkelä JA, Toppari J. Hypogonadism and Cryptorchidism. Front Endocrinol (Lausanne). 2020;10:906. DOI: 10.3389/fendo.2019.00906
8. Патент РФ на изобретение №2614115/01.08.2016. Бюл. №9. Юдин С.М., Лунин В.Г. Рекомбинантный соматостатинсодержащий белок, способ его получения, инъекционный препарат для повышения мясной и молочной продуктивности сельскохозяйственных животных, а также способ использования препарата. Ссылка активна на 03.04.2025. https://www.elibrary.ru/item.asp?id=38261219 eLIBRARY ID: 38261219; EDN: ZTVFMT
9. Демяшкин Г. А. Морфологический анализ сперматогенеза–основа диагностики мужского идиопатического бесплодия (иммуногистохимический аспект): Автореф. дис. ... канд. мед. наук. Москва; 2017. Ссылка активна на 03.04.2025. https://www.sechenov.ru/upload/medialibrary/5fd/Avtoreferat.pdf
10. Демяшкин Г.А., Филиппов Е.Е. Морфофункциональная характеристика инсулиноподобного фактора роста 1 в нормальном сперматогенезе и при идиопатическом бесплодии. Международный журнал прикладных и фундаментальных исследований. 2017;(1-2):236-239. eLIBRARY ID: 28385068; EDN: XXDXLV
11. Yao J, Zuo H, Gao J, Wang M, Wang D, Li X. The effects of IGF-1 on mouse spermatogenesis using an organ culture method. Biochem Biophys Res Commun. 2017;491(3):840-847. DOI: 10.1016/j.bbrc.2017.05.125
12. Tenuta M, Carlomagno F, Cangiano B, Kanakis G, Pozza C, Sbardella E, Isidori AM, Krausz C, Gianfrilli D. Somatotropic-Testicular Axis: A crosstalk between GH/IGF-I and gonadal hormones during development, transition, and adult age. Andrology. 2021;9(1):168-184. DOI: 10.1111/andr.12918
13. Xu YM, Hao GM, Gao BL. Application of Growth Hormone in in vitro Fertilization. Front Endocrinol (Lausanne). 2019;10:502. DOI: 10.3389/fendo.2019.00502
14. Hart RJ, Rombauts L, Norman RJ. Growth hormone in IVF cycles: any hope? Curr Opin Obstet Gynecol. 2017;29(3):119-125. DOI: 10.1097/GCO.0000000000000360
15. Ohyama K, Iwatani N, Nakagomi Y, Ohta M, Shimura Y, Sano T, Sato K, Ohno R, Mabe H, Ishikawa H, Nakazawa S. Growth hormone advances spermatogenesis in premature rats treated with gonadotropin-releasing hormone agonist. Endocr J. 1999;46(4):555-562. DOI: 10.1507/endocrj.46.555
16. Зуева А.А., Крышень К.Л., Матичин А.А., Каргопольцева Д.Р., Кательникова А.Е., Трофимец Е.И., Демяновский М.Н., Ваганова Д.С., Гайдай Д.С. Апробация метода трансректальной электростимуляции семенных бугорков крыс. Лабораторные животные для научных исследований. 2019;(3). DOI: 10.29296/2618723X-2019-03-07
17. Коптяева К.Е., Мужикян А.А., Гущин Я.А., Беляева Е.В., Макарова М.Н., Макаров В.Г. Некоторые особенности фиксации органов и тканей лабораторных животных для повышения качества гистологического анализа. Лабораторные животные для научных исследований. 2018;(2). DOI: 10.29296/2618723X-2018-02-07
18. Jia YF, Feng Q, Ge ZY, Guo Y, Zhou F, Zhang KS, Wang XW, Lu WH, Liang XW, Gu YQ. Obesity impairs male fertility through long-term effects on spermatogenesis. BMC Urol. 2018;18(1):42. DOI: 10.1186/s12894-018-0360-5
19. Матичин А.А., Фаустова Н.М., Каргопольцева Д.Р., Макарова М.Н. Циркадианные колебания уровня тестостерона в плазме крови половозрелых самцов крыс. Лабораторные животные для научных исследований. 2020;2. DOI: 10.29296/2618723X-2020-02-04
Об авторах
А. А. МатичинРоссия
Александр Алексеевич Матичин
Санкт-Петербург
Конфликт интересов:
нет
К. Л. Крышень
Россия
Кирилл Леонидович Крышень — канд. биол. наук.
Санкт-Петербург
Конфликт интересов:
нет
А. А. Матичина
Россия
Алена Алексеевна Матичина
Санкт-Петербург
Конфликт интересов:
нет
Н. М. Фаустова
Россия
Наталья Михайловна Фаустова — канд. хим. Наук.
Санкт-Петербург
Конфликт интересов:
нет
Я. А. Гущин
Россия
Ярослав Александрович Гущин
Санкт-Петербург
Конфликт интересов:
нет
М. Н. Макарова
Россия
Марина Николаевна Макарова — д-р мед. наук.
Санкт-Петербург
Конфликт интересов:
нет
В. В. Решетник
Россия
Вячеслав Викторович Решетник
Москва
Конфликт интересов:
В.В. Решетник заявляет о том, что он является директором компании ООО «Юрсфарм», финансирующей данное исследование в рамках договорной работы
Г. Т. Сухих
Россия
Геннадий Тихонович Сухих — д-р мед. наук, профессор, заслуженный деятель науки РФ, академик РАН.
Москва
Конфликт интересов:
нет
С. М. Юдин
Россия
Сергей Михайлович Юдин — д-р мед. наук, профессор.
Москва
Конфликт интересов:
нет
В. Г. Лунин
Национальный исследовательский центр эпидемиологии и микробиологии им. почётного акад. Н.Ф. Гамалеи
Россия
Владимир Глебович Лунин — д-р биол. наук.
Москва
Конфликт интересов:
нет
Рецензия
Для цитирования:
Матичин А.А., Крышень К.Л., Матичина А.А., Фаустова Н.М., Гущин Я.А., Макарова М.Н., Решетник В.В., Сухих Г.Т., Юдин С.М., Лунин В.Г. Оценка эффективности препарата на основе соматостатинсодержащего белка при лечении бесплодия на модели лейпрорелин-индуцированного нарушения сперматогенеза у самцов крыс. Вестник урологии. 2025;13(3):61-70. https://doi.org/10.21886/2308-6424-2025-13-3-61-70
For citation:
Matichin A.A., Kryshen K.L., Matichina A.A., Faustova N.M., Gushchin Ya.A., Makarova M.N., Reshetnik V.V., Sukhikh G.T., Yudin S.M., Lunin V.G. Somatostatin-containing protein-based drug in the treatment of infertility: efficacy evaluation using a leuprorelin-induced spermatogenesis impairment model in male rats. Urology Herald. 2025;13(3):61-70. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-61-70













































