Перейти к:
Выраженность симптомов нижних мочевых путей в послеоперационном периоде как фактор выбора подхода к хирургическому лечению гиперплазии простаты больших размеров: гольмиевая энуклеация предстательной железы и лапароскопическая позадилонная аденомэктомия
https://doi.org/10.21886/2308-6424-2024-12-2-5-14
Аннотация
Введение. Анализ осложнений, возникающих после трансуретральной хирургии гиперплазии предстательной железы, несмотря на усовершенствования технологий и хирургических методик, демонстрирует, что от 20% до 30% пациентов нуждается в продолжительном послеоперационном лечении по поводу выраженных симптомов нижних мочевых путей. Эти осложнения являются важными факторами снижения качества жизни пациентов в послеоперационном периоде. Выраженные симптомы накопления, ургентное недержание мочи являются важными проблемами послеоперационного периода при выполнении лазерной энуклеации. Существуют ограничения также и стандартных подходов к выполнению лапароскопической аденомэктомии, что определяет необходимость разработки усовершенствованных методик.
Цель исследования. Сравнительная оценка послеоперационной динамики выраженности симптомов нарушений мочеиспускания в группах применения гольмиевой лазерной энуклеации предстательной железы (HoLEP), стандартной лапароскопической позадилонной аденомэктомии (ЛПА) по Millin и модифицированной методики лапароскопической позадилонной аденомэктомии, дополненной уретроцистоанастомозом.
Материалы и методы. В настоящее многоцентровое исследование включено 439 пациентов, которые были в случайном порядке распределены по группам в зависимости от применяемой техники хирургического лечения по поводу инфравезикальной обструкции, связанной с гиперплазией простаты большого объёма: группа применения HoLEP (151 пациент), группа стандартной лапароскопической позадилонной аденомэктомии по Millin (142 человека) и лапароскопической позадилонной аденомэктомии, дополненной временным пережатием внутренних подвздошных артерий и уретроцистоанастомозом (146 человек). Основным оцениваемым критерием в течение 6 месяцев наблюдения служила выраженность симптомов нарушений мочеиспускания по шкале IPSS (обструктивный и ирритативный компоненты). Фиксировали осложнения, развившиеся в период послеоперационного наблюдения.
Результаты. Выявлена меньшая выраженность симптомов нарушения мочеиспускания в группе лапароскопической аденомэктомии, дополненной уретроцистоанастомозом, в сравнении со стандартной лапароскопической аденомэктомией и трансуретральной гольмиевой лазерной энуклеацией простаты (p = 0,041 и р = 0,001 соответственно). Средний балл ирритативного компонента IPSS был значимо ниже в группе выполнения уретроцистоанастомоза в сравнении со стандартной лапароскопической аденомэктомией и трансуретральной гольмиевой лазерной энуклеацией простаты (p = 0,032 и р = 0,001 соответственно). Наблюдаемая тенденция сохранялась и к третьему месяцу после выполнения хирургии. Сравнение изменения показателя выраженности симптомов через 6 месяцев после хирургии позволило продемонстрировать значимое преимущество модифицированной лапароскопической аденомэктомии как в сравнении с HoLEP (p = 0,017), так и в сравнении со стандартной лапароскопической аденомэктомией (p = 0,032). Во всех трёх группах подтверждено сопоставимое значимое повышение качества жизни.
Заключение. Выраженность симптомов накопления в послеоперационном периоде является ограничением применения HoLEP, тогда как ЛПА ассоциирована с более низкой выраженностью таких симптомов в послеоперационном периоде. Предложенная авторами модификация лапароскопической техники позадилонной аденомэктомии позволяет добиться снижения выраженности симптомов накопления у пациентов в сроки до 3 месяцев после вмешательства и ассоциирована с низкой частотой развития ургентного недержания.
Ключевые слова
Для цитирования:
Волков С.Н., Пушкарь Д.Ю., Колонтарев К.Б., Степанченко В.С., Терещенко В.И., Джаримок А.Р., Шевякина А.Е., Дауров М.А. Выраженность симптомов нижних мочевых путей в послеоперационном периоде как фактор выбора подхода к хирургическому лечению гиперплазии простаты больших размеров: гольмиевая энуклеация предстательной железы и лапароскопическая позадилонная аденомэктомия. Вестник урологии. 2024;12(2):5-14. https://doi.org/10.21886/2308-6424-2024-12-2-5-14
For citation:
Volkov S.N., Pushkar D.Yu., Kolontarev K.B., Stepanchenko V.S., Tereshchenko V.I., Dzharimok A.R., Shevyakina A.E., Daurov M.A. The severity of lower urinary tract symptoms during the postoperative period as a factor in choosing an approach to surgical treatment for large prostate hyperplasia: holmium enucleation of the prostate (HoLEP) vs laparoscopic simple prostatectomy. Urology Herald. 2024;12(2):5-14. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-2-5-14
Введение
Золотым стандартом хирургического лечения доброкачественной гиперплазии предстательной железы (ДГПЖ) объёмом < 80 мл является трансуретральная резекция простаты (ТУРП). Однако при большем объёме железы в настоящее время на лидирующих позициях находятся методы трансуретральной энуклеации простаты, из которых гольмиевая энуклеация (HoLEP) подкреплена наиболее основательной доказательной базой. Показаниями к операции являются рецидивирующая острая задержка мочи, наличие остаточного объёма мочи, гематурия, рецидивирующие инфекции мочевыводящих путей, снижение функции почек [1]. Анализ осложнений, возникающих после трансуретральной хирургии ДГПЖ, несмотря на усовершенствования технологий и хирургических методик, демонстрирует, что от 20 до 30% пациентов нуждается в продолжительном послеоперационном лечении по поводу выраженных симптомов нижних мочевых путей. Эти осложнения являются важными факторами снижения качества жизни пациентов в послеоперационном периоде [2-4]. Выраженные симптомы накопления, ургентное недержание мочи являются одной из проблем послеоперационного периода при HoLEP [5]. Преходящее недержание мочи, как ургентное, так и стрессовое, по данным литературы, может сохраняться в течение 3 месяцев после операции [6]. В исследовании Y.J. Lee et al. (2017) некоторые из пациентов, низко оценивавших качество жизни в послеоперационном периоде HoLEP, связывали уровень удовлетворённости от лечения именно с недержанием мочи и дизурей [7]. Более ранние исследования предоставляли сопоставимые результаты [8-11]. Важным ограничением трансуретрального доступа к удалению аденоматозной ткани остаются особенности, связанные с длительным контактом агрессивной мочевой среды с ложем удалённых аденоматозных тканей [12]. Оптимальные подходы к хирургическому лечению ДГПЖ большого объёма всё ещё не определены, а высокий уровень неудовлетворённости пациентов результатами хирургического лечения определяет необходимость внедрения более совершенных хирургических решений.
Цель исследования: провести сравнительную оценку послеоперационной динамики выраженности симптомов нарушений мочеиспускания в группах применения гольмиевой лазерной энуклеации предстательной железы, стандартной лапароскопической позадилонной аденомэктомии (ЛПА) по Millin и модифицированной методики лапароскопической позадилонной аденомэктомии, дополненной уретроцистоанастомозом.
Материалы и методы
В настоящее открытое многоцентровое исследование включено 439 пациентов, которые были в случайном порядке распределены по группам в зависимости от применяемой техники хирургического лечения по поводу инфравезикальной обструкции, связанной с ДГПЖ большого объёма: группа применения HoLEP (151 пациент), группа стандартной лапароскопической позадилонной аденомэктомии по Millin (142 человека) и лапароскопической позадилонной аденомэктомии, дополненной временным пережатием внутренних подвздошных артерий и уретроцистоанастомозом (146 человек).
Критерии включения: наличие симптомов нижних мочевых путей, вызванных инфравезикальной обструкцией, объём предстательной железы более 80 мл, наличие показаний к хирургическому лечению ДГПЖ, подписанное информированное согласие на участие в исследовании, отсутствие острых воспалительных заболеваний, рака предстательной железы, отсутствие противопоказаний к анестезиологическому пособию. Пациенты исключались из исследования при несоответствии критериям включения.
Исследование проведено на базе ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России и Урологической клиники ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России за период с 25 февраля 2020 года по 1 июля 2022 года.
Все пациенты проходили стандартное предоперационное обследование, Урофлоуметрию выполняли с использованием двух моделей: Урофлоуметр «УФМ-01» (ООО «ЯРОВИТ», Россия; диапазон измерения объёма мочи — 0 – 1000 мл, погрешность 0,5%) и Urocap III («Laborie», Канада; диапазон измерения объёма — мочи 0 – 1200 мл с точностью ± 1%). Оценку клинических симптомов проводили с использованием опросника International Prostate Symptom Score (IPSS), оценку качества жизни — с использованием шкалы Quality of life (QoL). Все пациенты находились под наблюдением в течение 6 месяцев после операции. Основными оцениваемыми критериями служили выраженность симптомов нарушений мочеиспускания по шкале IPSS, в том числе ирритативный и обструктивный компоненты, оценка качества жизни (баллы QoL). Также фиксировали все осложнения, развившиеся за 6 месяцев послеоперационного наблюдения.
Описание методики выполнения уретроцистоанастомоза как модификации лапароскопической позадилонной аденомэктомии и теоретическое обоснование влияния на выраженность послеоперационной ирритативной симптоматики. Методика модифицированной лапароскопической позадилонной аденомэктомии, помимо стандартных этапов, подразумевала выделение ВПА и наложение на них сосудистых зажимов типа «бульдог». Капсулу предстательной железы рассекают в поперечном направлении с контролем гемостаза. После идентификации слоя между капсулой предстательной железы и аденоматозным узлом данные образования выделяют единым блоком, шейку мочевого пузыря смещают преимущественно путём тупой диссекции. Аденоматозные узлы отсекают от уретры и помещают в контейнер с последующим снятием сосудистых зажимов с ВПА. После адекватной идентификации шейки мочевого пузыря выполняют наложение анастомоза двумя нитями V-LocÔ 3/0 между уретрой и шейкой мочевого пузыря непрерывным шагом, начиная с задней стенки (6 часов условного циферблата) в обе стороны до передней поверхности анастомоза (12 часах условного циферблата) (рис.).
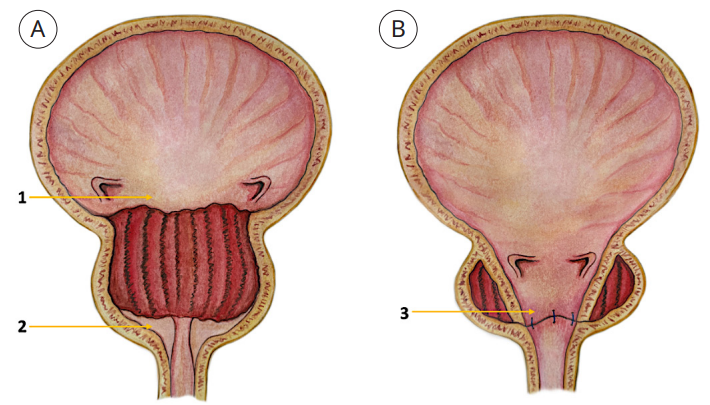
Рисунок. Основные этапы выполнения цистоуретроанастамоза: А — этап после удаления аденоматозных узлов (стрелка под цифрой 1 — слизистая шейки мочевого пузыря; стрелка под цифрой 2 — край слизистой уретры, дистальнее области ложа удалённых тканей); В — этап завершения уретроцистоанастомоза (стрелка под цифрой 3 — область реконструкции слизистого покрова в зоне удалённых аденоматозных тканей)
Figure. Main steps of vesicourethralanastomosis: A — stage after removal of hyperplasia tissue (the arrow under number 1 — bladder neck mucosa; the arrow under number 2 — edge of the urethral mucosa, distal to the area of removed tissue); В — stage of completed vesicourethral anastomosis (arrow under number 3 — area of the mucosal reconstruction around removed adenomatous tissue)
Предполагаемый эффект, достигаемый путём выполнения реконструкции слизистой в области ложа удалённых аденоматозных тканей, реализуется за счёт снижения воздействия агрессивной мочевой среды на ложе удалённых тканей, лишённое физиологического барьера, а также сокращённого времени восстановления тканей в зоне хирургической агрессии.
Статистический анализ. Расчёты проводили с использованием программного обеспечения IBMÒ SPSS Statistics 23.2 («SPSS: An IBM Company», IBM SPSS Corp., Armonk, NY, USA). Проверку нормальности выполняли с помощью метода Kolmogorov-Smirnov test. Статистическое описание количественных показателей включало расчёт средних показателей и стандартных отклонений, качественные показатели представлены в виде абсолютных чисел и частот. Для сравнительного анализа количественных показателей между группами использовался Mann-Whitney U test. Cтатистически значимым признавали уровень р < 0,05.
Результаты
В таблице 1 представлено сравнение исходных показателях в трёх группах. Проведённый анализ позволил подтвердить исходную сопоставимость групп.
Таблица 1. Сравнение исходных характеристик в исследуемых группах
Table 1. Comparison of baseline characteristics among study groups
|
Показатели Variables |
HoLEP |
ЛПА по Millin Millin LSP |
Модифицированная ЛПА Modified LSP |
Р |
|
M ± SD |
||||
|
Возраст, лет Age, years |
65,9 ± 6,4 |
66,7 ± 6,0 |
65,3 ± 7,1 |
0,591 |
|
Объём простаты, мл Prostate volume, ml |
126,1 ± 37,1 |
125,9 ± 43,1 |
129,1 ± 42,0 |
0,355 |
|
ИМТ, кг/м² BMI, m/h2 |
23,4 ± 2,5 |
24,1 ± 2,6 |
25,2 ± 1,9 |
0,407 |
|
IPSS, баллы IPSS, score |
23,5 ± 2,1 |
22,1 ± 1,9 |
23,4 ± 2,3 |
0,154 |
|
QoL, баллы QoL, score |
4,4 ± 1,0 |
4,6 ± 0,9 |
4,7 ± 1,1 |
0,658 |
|
Q max, мл/с Q max, ml/s |
6,4 ± 1,9 |
6,1 ± 2,5 |
5,9 ± 3,1 |
0,857 |
|
ООМ, мл PVR, ml |
67,9 ± 35,1 |
69,5 ± 29,8 |
70,5 ± 24,8 |
0,197 |
|
n |
151 |
142 |
146 |
|
|
Примечания: 1) IPSS — International Prostate Symptom Score / Международная система оценки симптомов болезней предстательной железы; QoL — Quality of Life / Шкала оценки качества жизни; ИМТ — индекс массы тела; Q max — пиковая скорость потока мочи; ООМ — объём остаточной мочи; ЛПА — лапароскопическая позадилонная аденомэктомия 2) * — различия показателей статистически значимы (p < 0,05; U-критерий Mann-Whitney); M ± SD — среднее ± стандартное отклонение Notes: 1) IPSS — International Prostate Symptom Score; QoL — Quality of Life; BMI — body mass index; Qmax — max urine flow rate; PVR — post-void residual volume; LSP — laparoscopic simple prostatectomy 2) * — statistically significant values (p < 0.05, Mann-Whitney U test); M ± SD — mean ± standard deviation |
||||
Анализ выраженности симптомов нарушения мочеиспускания в сроки 1, 3 и 6 месяцев после хирургического лечения ДГПЖ представлен в таблице 2. Так, результаты, полученные через 1 месяц после хирургического вмешательства, позволяют констатировать достаточно высокий средний суммарный балл по шкале IPSS во всех трёх группах. Однако в ходе сравнительного анализа выявлена меньшая выраженность симптомов нарушения мочеиспускания в группе лапароскопической аденомэктомии, дополненной уретроцистоанастомозом и временным пережатием внутренних подвздошных артерий в сравнении со стандартной лапароскопической аденомэктомией и трансуретральной гольмиевой лазерной энуклеацией простаты (p = 0,041 и р = 0,001 соответственно). Средний балл ирритативного компонента опросника IPSS был значимо ниже в группе уретроцистоанастомоза в сравнении со стандартной лапароскопической аденомэктомией и трансуретральной гольмиевой лазерной энуклеацией простаты (p = 0,032 и р = 0,001 соответственно). Наблюдаемая тенденция сохранялась и к третьему месяцу после выполнения хирургии. Общий балл IPSS и сумма ирритативных баллов в отдельности были ниже в группе лапароскопической аденомэктомии, дополненной уретроцистоанастомозом и временным пережатием внутренних подвздошных артерий в сравнении со стандартной лапароскопической аденомэктомией и трансуретральной гольмиевой лазерной энуклеацией простаты (p = 0,015 и р = 0,001; p = 0,005 и р = 0,001 соответственно). При этом, к 6-му месяцу после операции показатели общего балла IPSS и суммы ирритативных баллов в отдельности во всех трёх группах достигли минимальных значений и не имели достоверных различий.
Таблица 2. Выраженность симптомов нарушения мочеиспускания через 1, 3 и 6 месяцев после операции в группах проведения лазерной энуклеации простаты, лапароскопической позадилонной аденомэктомии по Millin в стандартном исполнении и в модификации
Table 2. Severity of LUTS 1, 3- and 6-months after HoLEP, a standard Millin and modified laparoscopic simple prostatectomy techniques
|
Показатели Variables |
HoLEP |
ЛПА по Millin Millin LSP |
Модифицированная ЛПА Modified LSP |
P 1 – 3 |
P 2 – 3 |
|
M ± SD |
|
|
|||
|
1 месяц после операции | 1 month after surgery |
|||||
|
Общий балл IPSS IPSS, score |
15,5 ± 2,9 |
12,4 ± 2,5 |
11,0 ± 2,7 |
0,001* |
0,041* |
|
Ирритативные баллы IPSS Irritative IPSS, score |
10,9 ± 1,0 |
5,1 ± 1,7 |
4,6 ± 1,1 |
0,001* |
0,032* |
|
Обструктивные баллы IPSS Irritative IPSS, score |
6,9 ± 4,0 |
7,1 ± 4,7 |
6,6 ± 3,9 |
0,789 |
0,571 |
|
3 месяца после операции | 3 months after surgery |
|||||
|
Общий балл IPSS IPSS, score |
14,5 ± 2,8 |
12,2 ± 2,6 |
10,1 ± 2,0 |
0,001* |
0,015* |
|
Ирритативные баллы IPSS Irritative IPSS, score |
10,2 ± 0,7 |
5,2 ± 1,4 |
4,1 ± 1,0 |
0,001* |
0,005* |
|
Обструктивные баллы IPSS Irritative IPSS, score |
5,7 ± 4,2 |
6,5 ± 3,2 |
6,1 ± 3,7 |
0,691 |
0,791 |
|
6 месяцев после операции | 6 months after surgery |
|||||
|
Общий балл IPSS IPSS, score |
11,0 ± 2,4 |
10,8 ± 2,4 |
10,6 ± 2,0 |
0,311 |
0,565 |
|
Ирритативные баллы IPSS Irritative IPSS, score |
5,9 ± 1,9 |
4,1 ± 1,1 |
4,0 ± 1,5 |
0,561 |
0,743 |
|
Обструктивные баллы IPSS Irritative IPSS, score |
5,6 ± 4,8 |
6,3 ± 2,9 |
5,9 ± 3,2 |
0,856 |
0,701 |
|
Примечания: 1) IPSS — International Prostate Symptom Score / Международная система оценки симптомов болезней предстательной железы; ЛПА — лапароскопическая позадилонная аденомэктомия 2) * — различия показателей статистически значимы (p < 0,05; U-критерий Mann-Whitney); M ± SD — среднее ± стандартное отклонение Notes: 1) IPSS — International Prostate Symptom Score; LSP — laparoscopic simple prostatectomy 2) * — statistically significant (p < 0.05, Mann-Whitney U test); M ± SD — mean ± standard deviation |
|||||
В таблице 3 представлены данные изменения выраженности симптомов нарушения мочеиспускания через 6 месяцев после хирургии. Так, среднее изменение показателя IPSS в группе модифицированной ЛПА не имело статистически значимых отличий в сравнении с группами HoLEP и стандартной лапароскопической аденомэктомией (p = 0,115 и p = 0,097 соответственно). Аналогично, сопоставимыми оказались средние показатели изменения обструктивного компонента по IPSS (p = 0,681 и p = 0,877 соответственно), а также уровня качества жизни, оцениваемого по шкале QoL (p = 0,596 и p = 0,793 соответственно). Однако сравнение изменения показателя выраженности симптомов накопления позволило продемонстрировать статистически значимое преобладание показателя в группе модифицированной лапароскопической аденомэктомии как в сравнении с HoLEP (p = 0,017), так и в сравнении со стандартной лапароскопической аденомэктомией (p = 0,032).
Таблица 3. Изменение выраженности симптомов нарушения мочеиспускания через 6 месяцев после операции в группах проведения лазерной энуклеации простаты, лапароскопической позадилонной аденомэктомии по Millin в стандартной модификации и с выполнением уретроцистоанастомоза
Table 3. Changes in the severity of LUTS six months after surgery in the groups HoLEP, a standard Millin and modified laparoscopic simple prostatectomy techniques
|
Показатели Variables |
HoLEP |
ЛПА по Millin Millin LSP |
Модифицированная ЛПА Modified LSP |
P 1 – 3 |
P 2 – 3 |
|
M ± SD |
|||||
|
Изменение общего балла IPSS Mean IPSS change, score |
- 12,7 ± 6,9 |
- 12,5 ± 5,9 |
- 13,1 ± 4,1 |
0,115 |
0,097 |
|
Изменение ирритативных баллов IPSS Mean irritative IPSS change, score |
- 3,9 ± 3,6 |
- 4,1 ± 3,4 |
- 4,9 ± 1,9 |
0,017* |
0,032* |
|
Изменение обструктивных баллов IPSS Mean irritative IPSS change, score |
- 9,1 ± 5,6 |
- 8,4 ± 6,1 |
- 8,9 ± 5,0 |
0,681 |
0,877 |
|
Изменение качества жизни QoL Mean QoL change, score |
- 2,9 ± 1,6 |
- 3,1 ± 1,7 |
- 3,4 ± 0,9 |
0,596 |
0,793 |
|
Примечания: 1) IPSS — International Prostate Symptom Score / Международная система оценки симптомов болезней предстательной железы; ЛПА — лапароскопическая позадилонная аденомэктомия 2) * — различия показателей статистически значимы (p < 0,05; U-критерий Mann-Whitney); M ± SD — среднее ± стандартное отклонение Notes: 1) IPSS — International prostate symptom score; LPS — laparoscopic simple prostatectomy 2) * — statistically significant (p < 0.05, Mann-Whitney U test); M ± SD — mean ± standard deviation |
|||||
Необходимо отметить, что в группе применения модифицированного лапароскопического вмешательства ни у одного пациента не наблюдалось развитие ургентного недержания мочи, тогда как в группах HoLEP и стандартной лапароскопической позадилонной аденомэктомии их число составило 6 (3,9%) и 5 (3,5%) случаев соответственно.
Обсуждение
Результаты, сообщаемые пациентами, важны для оценки результатов хирургического вмешательства. Традиционно оцениваемые хирургические исходы, такие как уровни заболеваемости и смертности, важны, но этих показателей недостаточно для того, чтобы сообщать о результативности малоинвазивных вмешательств при ДГПЖ. Наиболее важными показателями эффективности трансуретральной хирургии ДГПЖ в большинстве исследований являлись показатели максимальной скорости потока мочеиспускания, остаточный объём мочи, динамика оценки симптомов с использованием опросника IPSS. Не менее важным показателем эффективности хирургии является удовлетворённость пациента вмешательством. Польза от лечения, удовлетворённость и готовность продолжать лечение — всё это атрибуты успешного лечения [13]. С целью оценить удовлетворённость пациентов после HoLEP, P.J. Gilling et al. (2008) провели телефонное корреспондирование участников проспективных исследований HoLEP через 6 лет после операции [14]. Так, из 71 участника 38 ответили на запрос, и 92% из них остались довольны результатами проведённой хирургии.
Важное исследование провели Y.J. Lee et al. (2017) [7]. Так, в ходе проспективного изучения удовлетворённости пациентов, подвергшихся гольмиевой лазерной энуклеации простаты, средний предоперационный балл IPSS составил 18,5 ± 7,8, что сопоставимо с высокими исходными показателями по шкале IPSS в нашем исследовании, составившими 23,5 ± 2,1, 22,1 ± 1,9 и 23,4 ± 2,3 баллов в группах HoLEP, а также стандартной и модифицированной лапароскопической позадилонной аденомэктомии соответственно. В целях сравнения, целесообразно обсуждение результатов, полученных в исследовании A. Fuschi (2021), где исходные показатели IPSS составили 23,4 ± 2,8 и 24,1 ± 3,0 в группах лапароскопической аденомэктомии и HoLEP соответственно [15]. Через 3 месяца после проведения HoLEP уровень IPSS в исследовании Y.J. Lee et al. (2017) составил 6,8 ± 5,6 и 11,7 ± 5,9 баллов среди удовлетворённых и неудовлетворенных результатами проведённого вмешательства пациентов соответственно, при этом уровень симптомов накопления составил 3,0 ± 2,4 и 6,0 ± 3,4 баллов соответственно, а уровень симптомов опорожнения — 1,4 ± 2,4 и 7,0 ± 5,3 баллов соответственно [7]. В работе A. Fuschi (2021) суммарный балл IPSS через 3 месяца после хирургии в среднем составлял 8,26 и 8,35 баллов в группах HoLEP и лапароскопической аденомэктомии соответственно [15]. В нашей работе уровень суммарного балла IPSS через 3 месяца после хирургии составил 14,5 ± 2,8, 12,2 ± 2,6 и 10,1 ± 2,0 в группах HoLEP, а также стандартной и модифицированной лапароскопической позадилонной аденомэктомии соответственно. Ирритативный компонент был выражен в пределах 10,2 ± 0,7, 5,2 ± 1,4 и 4,1 ± 1,0 баллов IPSS соответственно, а обструктивный компонент составлял 5,7 ± 4,2, 6,5 ± 3,2 и 6,1 ± 3,7 баллов соответственно.
Через 6 месяцев после проведения вмешательства участники нашего исследования демонстрировали следующие показатели — общий балл IPSS в трёх группах достиг 11,0 ± 2,4, 10,8 ± 2,4 и 10,6 ± 2,0 баллов соответственно. Эти данные корреспондирую с представленными в работе Y.J. Lee et al. (2017) показателями, где через полгода после проведения HoLEP суммарный балл IPSS в среднем варьировался от 4,4 ± 4,1 баллов среди пациентов, довольных результатами хирургии, до 13,0 ± 6,9 баллов среди участников исследования, обладавших неудовлетворённость по поводу проведённой операции через полгода наблюдения. Снижение общего показателя IPSS достигало 13,7 ± 7,9 баллов, ирритативный компонент в среднем снижался на 9,4 ± 5,6 баллов в период 6 месяцев наблюдения [7]. В работе A. Fuschi (2021) суммарный балл IPSS через полгода после проведения вмешательства в среднем составлял 7,90 и 8,12 баллов в группах HoLEP и лапароскопической аденомэктомии соответственно [15]. В нашем исследовании общий балл IPSS снижался на 12,7 ± 6,9, 12,5 ± 5,9 и 13,1 ± 4,1 баллов в трёх исследуемых группах, а среднее снижение ирритативного компонента составило 3,9 ± 3,6, 4,1 ± 3,4 и 4,9 ± 1,9 балла соответственно.
Ограничения исследования: небольшой срок наблюдения — 6 месяцев, число центров было ограничено двумя лечебными учреждениями.
Заключение
Результаты настоящего исследования позволяют подвергнуть дискуссии роль трансуретральной лазерной энуклеации предстательной железы как золотого стандарта хирургического лечения ДГПЖ объёмом > 80 мл. Выраженность симптомов накопления в послеоперационном периоде является ограничением применения HoLEP, тогда как лапароскопический доступ ассоциирован с более низкой выраженностью таких симптомов в послеоперационном периоде. Предложенная авторами модификация лапароскопической техники позадилонной аденомэктомии, обеспечивающая оптимальную реконструкцию тканей в зоне удалённых аденоматозных структур, позволяет добиться снижения выраженности симптомов накопления у пациентов в сроки до 3 месяцев после вмешательства и ассоциирована с низкой частотой развития ургентного недержания.
Ключевым результатом настоящего исследования служит подтверждение преимущества выбора лапароскопического доступа в отношении выраженности послеоперационных ирритативных симптомов в сроки до 3 месяцев послеоперационного наблюдения.
Теоретическая значимость работы заключается в подтверждении потенциальной роли реконструкции ложа удалённых аденоматозных тканей в процессах регенерации в области хирургического вмешательства.
Список литературы
1. EAU Guidelines. Edn. presented at the EAU Annual Congress Milan 2023. ISBN 978-94-92671-19-6
2. Han KS, Hong SJ, Chung BH. Changing trends in the management of benign prostatic hyperplasia during recent 5 years. Korean J Urol. 2005;46(5):458-462.
3. Doll HA, Black NA, McPherson K, Flood AB, Williams GB, Smith JC. Mortality, morbidity and complications following transurethral resection of the prostate for benign prostatic hypertrophy. J Urol. 1992;147(6):1566-1573. DOI: 10.1016/s0022-5347(17)37628-0
4. Коган М.И., Набока Ю.Л., Иванов С.Н. Факторы риска, антибиотикопрофилактика и лечение инфекции мочевых путей при трансуретральной хирургии гиперплазии простаты. Вестник урологии. 2022;10(2):99-108. DOI: 10.21886/2308-6424-2022-10-2-99-108
5. Shigemura K, Tanaka K, Yamamichi F, Chiba K, Fujisawa M. Comparison of Predictive Factors for Postoperative Incontinence of Holmium Laser Enucleation of the Prostate by the Surgeons' Experience During Learning Curve. Int Neurourol J. 2016;20(1):59-68. DOI: 10.5213/inj.1630396.198
6. Nam JK, Kim HW, Lee DH, Han JY, Lee JZ, Park SW. Risk Factors for Transient Urinary Incontinence after Holmium Laser Enucleation of the Prostate. World J Mens Health. 2015;33(2):88-94. DOI: 10.5534/wjmh.2015.33.2.88
7. Lee YJ, Oh SA, Kim SH, Oh SJ. Patient satisfaction after holmium laser enucleation of the prostate (HoLEP): A prospective cohort study. PLoS One. 2017;12(8):e0182230. DOI: 10.1371/journal.pone.0182230
8. Yin L, Teng J, Huang CJ, Zhang X, Xu D. Holmium laser enucleation of the prostate versus transurethral resection of the prostate: a systematic review and meta-analysis of randomized controlled trials. J Endourol. 2013;27(5):604-611. DOI: 10.1089/end.2012.0505
9. Rigatti L, Naspro R, Salonia A, Centemero A, Ghezzi M, Guazzoni G, Briganti A, Rigatti P, Montorsi F. Urodynamics after TURP and HoLEP in urodynamically obstructed patients: are there any differences at 1 year of follow-up? Urology. 2006;67(6):1193-1198. DOI: 10.1016/j.urology.2005.12.036
10. Montorsi F, Naspro R, Salonia A, Suardi N, Briganti A, Zanoni M, Valenti S, Vavassori I, Rigatti P. Holmium laser enucleation versus transurethral resection of the prostate: results from a 2-center, prospective, randomized trial in patients with obstructive benign prostatic hyperplasia. J Urol. 2004;172(5 Pt 1):1926-1929. DOI: 10.1097/01.ju.0000140501.68841.a1
11. Gilling PJ, Wilson LC, King CJ, Westenberg AM, Frampton CM, Fraundorfer MR. Long-term results of a randomized trial comparing holmium laser enucleation of the prostate and transurethral resection of the prostate: results at 7 years. BJU Int. 2012;109(3):408-411. DOI: 10.1111/j.1464-410X.2011.10359.x
12. Волков С.Н., Пушкарь Д.Ю., Колонтарев К.Б., Степанченко В.С., Терещенко В.И., Джаримок А.Р., Андреева Е.Н., Григорян О.Р., Шевякина А.Е., Дауров М.А. Оценка эффективности и безопасности модифицированной лапароскопической позадилонной аденомэктомии, дополненной временным пережатием внутренних подвздошных артерий и уретроцистоанастомозом при гиперплазии простаты больших размеров. Вестник урологии. 2023;11(4):16-26. DOI: 10.21886/2308-6424-2023-11-4-16-26
13. Pleil AM, Coyne KS, Reese PR, Jumadilova Z, Rovner ES, Kelleher CJ. The validation of patient-rated global assessments of treatment benefit, satisfaction, and willingness to continue--the BSW. Value Health. 2005;8 Suppl 1:S25-34. DOI: 10.1111/j.1524-4733.2005.00069.x
14. Gilling PJ, Aho TF, Frampton CM, King CJ, Fraundorfer MR. Holmium laser enucleation of the prostate: results at 6 years. Eur Urol. 2008;53(4):744-749. DOI: 10.1016/j.eururo.2007.04.052
15. Fuschi A, Al Salhi Y, Velotti G, Capone L, Martoccia A, Suraci PP, Scalzo S, Annino F, Khorrami S, Asimakopoulos A, Bozzini G, Falsaperla M, Carbone A, Pastore AL. Holmium laser enucleation of prostate versus minimally invasive simple prostatectomy for large volume (≥120 mL) prostate glands: a prospective multicenter randomized study. Minerva Urol Nephrol. 2021;73(5):638-648. DOI: 10.23736/S2724-6051.20.04043-6
Об авторах
С. Н. ВолковРоссия
Станислав Николаевич Волков — канд. мед. наук; заведующий отделением урологии и андрологии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Д. Ю. Пушкарь
Россия
Дмитрий Юрьевич Пушкарь — д-р мед. наук, профессор, академик РАН; заведующий кафедрой урологии ФГБОУ ВО «Российский университет медицины» Минздрава России
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
К. Б. Колонтарев
Россия
Константин Борисович Колонтарев — д-р мед. наук; профессор кафедры урологии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. С. Степанченко
Россия
Владимир Сергеевич Степанченко — врач-уролог-андролог лечебно-диагностического отделения андрологии и урологии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. И. Терещенко
Россия
Виталий Игоревич Терещенко — врач-уролог лечебно-диагностического отделения андрологии и урологии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Р. Джаримок
Россия
Анзаур Рамазанович Джаримок — канд. мед. наук; врач-уролог отделения урологии ГБУЗ РА АРКБ
Майкоп, Республика Адыгея
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Е. Шевякина
Россия
Анастасия Евгеньевна Шевякина — врач-уролог лечебно-диагностического отделения андрологии и урологии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
М. А. Дауров
Россия
Мурат Асланович Дауров — заведующий отделением урологии
Майкоп
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Волков С.Н., Пушкарь Д.Ю., Колонтарев К.Б., Степанченко В.С., Терещенко В.И., Джаримок А.Р., Шевякина А.Е., Дауров М.А. Выраженность симптомов нижних мочевых путей в послеоперационном периоде как фактор выбора подхода к хирургическому лечению гиперплазии простаты больших размеров: гольмиевая энуклеация предстательной железы и лапароскопическая позадилонная аденомэктомия. Вестник урологии. 2024;12(2):5-14. https://doi.org/10.21886/2308-6424-2024-12-2-5-14
For citation:
Volkov S.N., Pushkar D.Yu., Kolontarev K.B., Stepanchenko V.S., Tereshchenko V.I., Dzharimok A.R., Shevyakina A.E., Daurov M.A. The severity of lower urinary tract symptoms during the postoperative period as a factor in choosing an approach to surgical treatment for large prostate hyperplasia: holmium enucleation of the prostate (HoLEP) vs laparoscopic simple prostatectomy. Urology Herald. 2024;12(2):5-14. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-2-5-14













































