Перейти к:
Влияние adherent perinephric fat на результаты органосохраняющего лечения почечно-клеточного рака
https://doi.org/10.21886/2308-6424-2023-11-2-47-55
Аннотация
Введение. С целью определения грамотной хирургической тактики и более точного прогнозирования интраоперационных показателей разработаны нефрометрические шкалы, учитывающие особенности опухоли почки. В то же время существует необходимость оценки состояние паранефральной жировой клетчатки. Шкала Mayo Adhesive Probability (MAP) направлена на выявление adherent perinephric fat (APF) или «сложной» паранефральной жировой клетчатки на предоперационном этапе.
Цель исследования. Оценить влияние APF на интраоперационные и функциональные результаты у пациентов с почечно-клеточным раком (ПКР), которым проведена лапароскопическая резекция почки (РП).
Материалы и методы. В исследование включено 118 пациентов с локализованным ПКР, которым выполнена лапароскопическая РП. На дооперационном этапе по результатам МСКТ с контрастированием произведена оценка наличия APF с помощью шкалы MAP. При этом производили измерение толщины задней паранефральной жировой клетчатки и оценку степени её скрученности. В результате пациенты были разбиты на две группы: группа 1 (34 пациента) — MAP 0 – 2 балла (отсутствие APF) и группа 2 (84 пациента) — MAP 3 – 5 баллов (наличие APF). В каждой из групп произведена оценка следующих показателей: возраст, индекс массы тела, скорость клубочковой фильтрации, стадия опухоли по классификации TNM, баллы нефрометрии по системе R.E.N.A.L.
Результаты. Медиана продолжительности операции для пациентов группы 1 составила 115,0 [92,5; 142,5] мин, для группы 2 — 130,0 [101,3; 180,0] мин. Медиана времени тепловой ишемии у пациентов группы 1 составила 15 [0; 20] мин, а у группы 2 — 12 [0; 18] мин. Показатель медианы объёма кровопотери в группах составил 50 [15; 100] и 50 [0; 100] мл соответственно. Среднее значение СКФ на первые сутки после операции составила в группе 1 — 63,34 ± 18,40 мл/мин/1,73 м2, в группе 2 — 55,09 ± 16,01 мл/мин/1,73 м2. Вскрытие чашечно-лоханочной системы отмечено у 8 (23,53%) и у 23 (27,38%) пациентов в группах 1 и 2, соответственно. Положительный хирургический край был выявлен у одного пациента в группе 1 и у двух — в группе 2. Ранние послеоперационные осложнения в группе 1 отмечены у 4 пациентов, а в группе 2 — у 15.
Заключение. Наличие APF и степень её выраженности может быть эффективно оценена с помощью шкалы MAP, которая является многообещающей, но она ограничена только прогнозированием APF без корреляционной зависимости от нефрометрических шкал, оценивающих анатомические параметры опухоли. Однако вопрос разработки единой системы оценки, включающей APF и морфометрию почек, в настоящее время остаётся открытым, также определение APF по-прежнему субъективно и требует объективного анализа для получения более точных результатов.
Ключевые слова
Для цитирования:
Котов С.В., Гуспанов Р.И., Юсуфов А.Г., Неменов А.А., Манцов А.А. Влияние adherent perinephric fat на результаты органосохраняющего лечения почечно-клеточного рака. Вестник урологии. 2023;11(2):47-55. https://doi.org/10.21886/2308-6424-2023-11-2-47-55
For citation:
Kotov S.V., Guspanov R.I., Yusufov A.G., Nemenov A.A., Mantsov A.A. Effect of adherent perinephric fat on outcomes of nephron-sparing treatment of renal cell cancer. Urology Herald. 2023;11(2):47-55. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-2-47-55
Введение
Частота случайной диагностики опухолей почки за последние десятилетия возросла в разы в связи с большой распространённостью использования современных методов визуализации [1]. Одновременно резекция почки (РП) стала вариантом выбора при образованиях небольших размеров. С целью определения грамотной хирургической тактики и более точной оценки интраоперационных показателей были разработаны нефрометрические шкалы, учитывающие конкретные особенности самой опухоли [2].
В настоящее время известно 28 нефрометрических шкал разного поколения, однако прогнозирование конкретных исходов не превосходит показатели систем первого поколения (R.E.N.A.L., PADUA), а также C-index, которые полностью коррелированы с основными интраоперационными показателями при РП [3][4].
В то же время неучтёнными остаются специфические показатели пациента, что снижает прогностический уровень значимости этих шкал. Необходимо также оценивать состояние паранефральной жировой клетчатки и характер её изменений или «токсичности» для каждого конкретного пациента [5][6]. Шкала Mayo Adhesive Probability (MAP) как раз направлена на выявление adherent perinephric fat (APF) или «сложной» паранефральной жировой клетчатки ещё на предоперационном этапе [7].
Авторы шкалы MAP предложили использование двух критериев. Первым из которых является оценка толщины задней паранефральной жировой клетчатки как прямой линии кзади от почечной капсулы до задней брюшной стенки на уровне большего сечения почечной вены. В зависимости от измеренного расстояния присваивается баллы от 0 до 2: 0 баллов соответствует толщине задней паранефральной жировой клетчатки < 1,0 см; 1 балл — 1,0 – 1,9 см; 2 балла — ≥ 2 см (рис. 1). Также оценивается скручивание околопочечной жировой клетчатки. Баллы присваиваются следующим образом: 0 баллов — без скручивания (тип 0); 2 балла — тонкое, похожее на ободок скручивание (тип 1), 3 балла — диффузное, с толстыми полосами сильное скручивание (тип 2) (рис. 2). Баллы суммируются и в результате 0 – 2 балла расцениваются как отсутствии APF, 3 – 5 баллов трактуются как наличие у пациента APF [8].
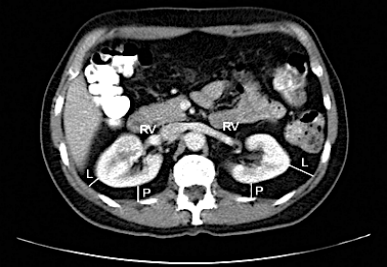
Рисунок 1. Метод оценки толщины паранефральной жировой клетчатки на уровне почечной вены. P — задний (используемый в шкале оценки вероятности адгезии по Mayo) L — латеральный, RV — почечная вена [8]
Figure 1. Method for determining perinephric fat measurements at the level of the renal vein. P — posterior (modality used in Mayo Adhesive Probability score), L — lateral, RV — renal vein [8]
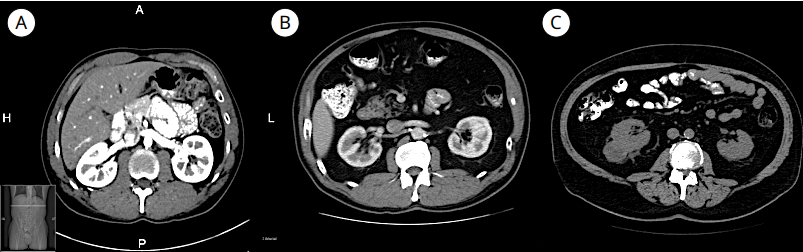
Рисунок 2. Классификация степени скрученности паранефральной жировой клетчатки. (A) Нет скручивания (тип 0): 0 баллов. Паранефральная жировая клетчатка без скручивания. На данном изображении компьютерной томографии ткань, окружающая почку, полностью чёрная. (B) Умеренное / среднее скручивание (тип 1): 2 балла. В паранефральной жировой клетчатке присутствуют небольшое количество полос скручивания, незначительной толщины, без признаков воспаления. (C) Сильное скручивание (тип 2): 3 балла. На изображении видно скручивание значительной толщины с признаками воспаления [8]
Figure 2. Grading of perinephric fat stranding. (A) None: 0 points. The perinephric fat demonstrates no stranding. On this CT scan, the tissue surrounding the kidney is completely black. (B) Moderate / intermediate stranding (type 1): 2 pts. The perinephric fat has some image-dense stranding present but no thick bars of inflammation. (C) Severe stranding (type 2): 3 pts. CT scan shows stranding of considerable thickness with signs of inflammation [8]
Цель исследования. Оценить влияние adherent perinephric fat на интраоперационные и функциональные результаты у пациентов с почечно-клеточным раком (ПКР), которым проведена лапароскопическая РП.
Материалы и методы
В Университетской клинике урологии РНИМУ им. Н. И. Пирогова на базе Первой Градской больницы им. Н. И. Пирогова с 2016 года по май 2022 года проведён анализ пациентов с ПКР, которым выполнена лапароскопическая РП. Критериями включения явились следующие показатели: локализованный ПКР, размер опухоли ≤ 10 см (клиническая стадия cT1aN0M0, cT1bN0M0 и cT2aN0M0). Из отобранной группы были исключены пациенты с недостаточными предоперационными характеристиками опухоли. В исследование включено 118 пациентов.
На предоперационном этапе выполняли мультиспиральную компьютерную томографию (МСКТ) с внутривенным контрастированием, по результатам которой было произведено измерение толщины задней паранефральной жировой клетчатки (рис. 3), а также произведена оценка степени её скрученности (рис. 4).
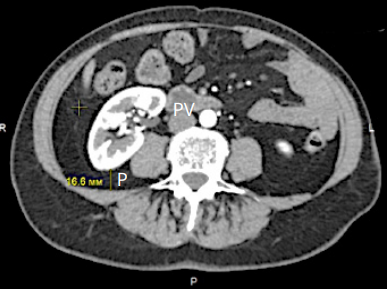
Рисунок 3. Оценка толщины задней паранефральной жировой клетчатки на уровне почечной вены. P — задний, RV — почечная вена, P = 16,6 мм, что соответствует 1 баллу
Figure 3. Determining the posterior perinephric fat measurement at the level of the renal vein. P — posterior, RV — renal vein, P = 16.6 mm, which correspond to 1 pts
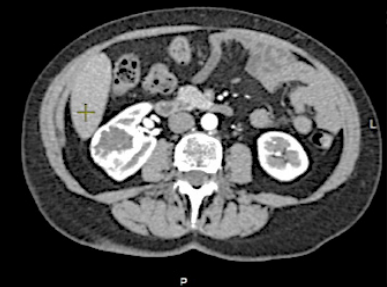
Рисунок 4. Оценка степени скрученности паранефральной жировой клетчатки. Умеренное / среднее скручивание (тип 1): 2 балла
Figure 4. Determining of perinephric fat stranding. Moderate / intermediate (type 1): 2 pts
По результатам измерений все пациенты распределены на две группы по шкале MAP: группа 1 (34 пациента) — MAP 0 – 2 (отсутствие APF) и группа 2 (84 пациента) — MAP 3 – 5 (наличие APF). В каждой из групп произведена оценка следующих показателей: средний возраст, средний показатель индекса массы тела (ИМТ), стадия по классификации TNM, средний балл нефрометрии по системе R.E.N.A.L. Также проведён анализ скорости клубочковой фильтрации (СКФ) по формуле MDRD (Modification of diet in renal disease).
Статистический анализ. Статистическая обработка данных выполнена с помощью программы GraphPad Prism 8 («GraphPad Software» Inc., Graphpad Holdings LLC, San Diego, CA, USA). Количественные показатели представлены в виде медиан и интерквартильного размаха — Ме [Q1 —нижний квартиль; Q3 — верхний квартиль] / среднего ± cтандратного отклонения — M ± SD. Качественные показатели были закодированы условными символами, их подсчёт представлен в абсолютных (n) и относительных величинах (%). При нормальном виде распределения числовых данных для оценки различий в группах применяли методы параметрической статистики (t-критерий Student). При отсутствии нормального распределения данных использовали методы непараметрической статистики (U-критерий Mann-Whitney). Для нахождения различий между качественными показателями использовали χ2-критерий Pearson с поправкой Yates на непрерывность, а также точный критерий Fisher для малых выборок. Статистически значимыми считались различия при p < 0,05 (95%-й уровень значимости).
Результаты
Дооперационные показатели двух групп представлены в таблице 1.
Таблица 1. Основные дооперационные показатели
Table 1. Basic pre-op demographics
Показатель Ratio | MAP 0 – 2 балла MAP 0 – 2 pts | MAP 3 – 5 балла MAP 3 – 5 pts | p |
Всего пациентов, n (%) Patients, n (%) | 34 (100) | 84 (100) |
|
Мужчины, n (%) Men, n (%) | 11 (32,35) | 47 (55,95) | 0,034* |
Женщины, n (%) Women, n (%) | 23 (67,65) | 37 (44,05) | |
Средний возраст, лет Mean age, yr | 57,59 ± 12,95 | 62,23 ± 10,85 | 0,049** |
Средний показатель ИМТ, кг/м2 Mean BMI, kg/m2 | 24,77 ± 3,73 | 30,75 ± 5,19 | < 0,0001** |
Стадирование по TNM, n (%) | TNM staging, n (%) | |||
cT1aN0M0 | 26 (76,47) | 55 (65,48) | 0,493 |
cT1bN0M0 | 6 (17,65) | 23 (2,38) | |
cT2aN0M0 | 2 (5,88) | 6 (7,14) | |
Сторона поражения, n (%) | Side of injury, n (%) | |||
Левая | Left | 15 (44,12) | 49 (58,33) | 0,230 |
Правая | Right | 19 (55,88) | 35 (41,67) | |
Баллы нефрометрии по шкале R.E.N.A.L., n (%) | R.E.N.A.L. scoreм, n (%) |
| ||
4 – 6 | 12 (35,29) | 32 (38,10) | 0,920 |
7 – 9 | 18 (52,94) | 41 (48,81) | |
10 – 12 | 4 (11,76) | 11 (13,10) | |
Примечание. MAP — Mayo Adhesive Probability score (оценка вероятности адгезии Mayo); ИМТ — индекс массы тела; TMN — tumor, node, metastasis (опухоль, лимфоузлы, метастазы); R.E.N.A.L. — radius, exophytic / endophytic, nearness the collecting system or sinus, anterior/posterior, location relative to the polar lines (радиус, экзофитный / эндофитный рост, близость к собирательной системе или синусу, передний / задний размер, расположение относительно полярных линий) * — χ2-критерий Pearson с поправкой Yates на непрерывность; ** — t-критерий Student Note. MAP — Mayo Adhesive Probability score; BMI — body mass index; TMN — tumor, node, metastasis; R.E.N.A.L. — radius, exophytic / endophytic, nearness the collecting system or sinus, anterior / posterior, location relative to the polar lines * — Pearson’ χ2- test with Yates' correction. ** — Student’s t-test | |||
Медиана продолжительности операции для пациентов группы 1 составила 115,0 [ 92,5; 142,5] мин, для группы 2 — 130,0 [ 101,3; 180,0] мин. Медиана времени тепловой ишемии у пациентов группы 1 составила 15 [ 0; 20] мин, а у группы 2 — 12 [ 0; 18] мин. Показатель медианы объёма кровопотери в группах 1 и 2 составил 50 [ 15; 100] и 50 [ 0; 100] мл, соответственно.
Среднее значение СКФ по формуле MDRD (Modification of diet in renal disease) на первые сутки после операции составило в группе 1 — 63,34 ± 18,40 мл/мин/1,73 м2, в группе 2 — 53,90 ± 16,01мл/мин/1,73 м2. Вскрытие чашечно-лоханочной системы отмечено у 8 (23,53%) пациентов в группе 1, в то время как у группы 2 этот показатель отмечен у 23 (27,38%). Положительный хирургический край был выявлен у одного пациента в группе 1 и у двух пациентов в группе 2.
Для оценки ранних послеоперационных осложнений использовали шкалу Clavien-Dindo. В группе 1 осложнения отмечены у 4 пациентов, а в группе 2 — у 15. Сравнительные характеристики групп представлены в таблице 2.
Таблица 2. Основные интра- и постоперационные показатели
Table 2. Basic intra-op and post-op demographics
Показатель Ratio | MAP 0 – 2 балла MAP 0 – 2 pts | MAP 3 – 5 баллов MAP 3 – 5 pts | p |
Медиана продолжительности операции, мин Median surgery time, min | 115,0 [ 92,5; 142,5] | 130,0 [ 101,3; 180,0] | 0,040* |
Медиана времени тепловой ишемии, мин Median warm ischemia time, min | 15 [ 0; 20] | 12 [ 0; 18] | 0,869 |
Медиана объёма кровопотери, мл Median blood loss, ml | 50 [ 15; 100] | 50 [ 0; 100] | 0,849 |
Среднее значение СКФ на 1-е сутки, мл/мин/1,73 м2 Mean GFR on day 1, ml/min/1.73 m2 | 63,34 ± 18,40 | 53,90 ± 16,01 | 0,015** |
Вскрытие ЧЛС: да / нет, n (%) PCS opening: yes / no, n (%) | 8 / 26 (23,53 / 76,47) | 23 / 61 (27,38 / 72,62) | 0,842 |
Дренажи: да / нет, n (%) Drain tube: yes / no, n (%) | 34 / 0 (100 / 0) | 84 / 0 (100 / 0) | > 0,9999 |
Хирургический край | Surgical margin: положительный / отрицательный, n (%) positive / negative, n (%) | 1 / 33 (2,94 / 97,06) | 2 / 82 (2,38 / 97,62) | > 0,9999 |
Осложнения ранние по Clavien-Dindo, n (%): Early post-ope complications to Clavien-Dindo, n (%): | |||
I – II | 4 (11,76) | 8 (9,52) | 0,245 |
III – IV | 0 (0) | 7 (8,33) | |
нет | no | 30 (88,24) | 69 (82,14) | |
Примечание. MAP — Mayo Adhesive Probability score (оценка вероятности адгезии Mayo); СКФ — скорость клубочковой фильтрации; ЧЛС — чашечно-лоханочная система * — U-критерий Mann-Whitney; ** — t-критерий Student Note. MAP — Mayo Adhesive Probability score; GFR — Glomerular filtration rate; PCS — pyelocalyceal system * — Mann-Whitney’s U-test; ** — Student’s t-test | |||
Обсуждение
Злокачественным новообразованиям почки отводится 14-е место в структуре всех онкологических процессов, среди них наиболее распространённым гистологическим вариантом является светлоклеточный вариант ПКР [9]. Первая РП была выполнена в 1887 году Czerny, более чем за век претерпела различные модификации техники и способы её проведения, от открытой до лапароскопической и робот-ассистированной, став золотым стандартом лечения локализованного рака почки [10][11].
J. E. Choi et al. и P. Lin et al. (2015) в своих мета-анализах производили сравнение интраоперационных результатов лапароскопической и робот-ассистированной РП. Согласно их данным обе методики сопоставимы, но преимуществами по ряду показателей обладает именно роботическая РП [12][13]. Однако G. Sharma et al. (2022) в последнем мета-анализе не выявил статистически значимых различий в интраоперационных результатах обеих методик [14]. Вероятно, это связано с большей распространённостью за последние годы лапароскопической методики лечения и лучшей степенью её освоения хирургами, а также ограниченностью применения робот-ассистированной РП, связанной со стоимостью медицинской техники и самой операции. Наше исследование посвящено анализу лапароскопической методики РП.
Пациенты по результатам МСКТ на дооперационном периоде с помощью шкалы MAP разделены на две группы. У 71,19% пациентов выявлена «токсичная» паранефральная жировая клетчатка. Обнаружение APF во многом субъективно, поэтому частота встречаемости составляет от 10,6% до 55,2%. В настоящее время точно не определено ни одного этиологического фактора APF. Существуют лишь теории, основанные на субъективном анализе хирургом МСКТ пациента с последующей корреляцией с его соматическим статусом. Полученные данные позволили предположить в качестве основного этиологического фактора системное хроническое воспаление [15]. Группа авторов во главе с S.M. Lee (2017) считает, что наличие APF может быть связано как с метаболическим синдромом, так и с совокупностью расстройств (непереносимость глюкозы, дислипидемия и артериальная гипертензия) [7]. В нашем исследовании у 73,81% пациентов II группы, имеющих APF, в анамнезе присутствовали сопутствующие заболевания (артериальная гипертензия, сахарный диабет, ожирение), которые могли послужить этиологическим фактором в развитии «сложной» паранефральной жировой клетчатки.
Для каждой из двух групп был рассчитан балл нефрометрии по системе R.E.N.A.L. Анализ результатов подтвердил высокую эффективность этой системы в отношении характеристик самой опухоли и низкую в учёте индивидуальных критериев пациентов, которые могут оказать влияние на течение самой РП, что соответствует выводам A. Veccia et al. (2020) [4].
Медиана времени продолжительности операции напрямую связана с наличием APF: в группе 2 длительность оперативного вмешательства на 15 минут больше, так как требует более длительного процесса мобилизации почки и дифференцировки элементов почечной ножки у этой когорты пациентов. Полученные нами результаты нашли подтверждение в работе L. Fang et al. (2021) [16].
Показатели медианы времени тепловой ишемии были сопоставим в обеих группах (в группе 1 составил 15 мин, а в группе 2 — 12 мин). L. Fang et al. (2021) также не отметили различий в продолжительности времени тепловой ишемии у пациентов без «токсичной» паранефральной жировой клетчаткой и в группе исследуемых, которые имели APF [16].
Положительный хирургический край был зафиксирован в одном случае в группе 1 и в двух случаях в группе 2, что соответствует данным исследования Е. С. Сирота и соавт. (2020) [17].
Количество послеоперационных осложнений превалировало у пациентов группы 2, обладающих более высоким баллом по шкале MAP 3 – 5, что было ранее подтверждено M. Sempels et al. (2021) в своём исследовании [18].
Ограничением исследования служит количество пациентов, а также субъективная оценка наличия APF.
Заключение
Присутствие APF отмечается у пациентов пожилого возраста и с высоким уровнем ИМТ, но не зависит от стадии заболевания. APF увеличивает время проведения лапароскопической РП и объем кровопотери, но не влияет на продолжительность тепловой ишемии и количество осложнений.
Наличие APF, а также степень её выраженности может быть эффективно оценены с помощью шкалы MAP, которая является полезной с точки зрения хирургии, но она ограничена только прогнозированием APF без корреляционной зависимости от нефрометрических шкал, оценивающих анатомические параметры опухоли. Однако вопрос разработки единой системы оценки, включающей APF и морфометрию почек, в настоящее время остаётся открытым, также определение APF по-прежнему субъективно и требует объективного анализа для получения более точных результатов.
Ключевые моменты исследования:
- При оценке сложности предстоящей резекции почки необходимо также оценивать состояние паранефральной жировой клетчатки и характер её изменений или «токсичности» для каждого конкретного пациента.
- Наличие APF и степень её выраженности может быть эффективно оценено с помощью шкалы MAP.
- Присутствие APF увеличивает время проведения лапароскопической РП и среднюю кровопотерю, но не влияет на продолжительность тепловой ишемии и количество осложнений.
Список литературы
1. Volpe A. The role of active surveillance of small renal masses. Int J Surg. 2016;36(Pt C):518-524. DOI: 10.1016/j.ijsu.2016.06.007
2. Kriegmair MC, Mandel P, Moses A, Lenk J, Rothamel M, Budjan J, Michel MS, Wagener N, Pfalzgraf D. Defining Renal Masses: Comprehensive Comparison of RENAL, PADUA, NePhRO, and C-Index Score. Clin Genitourin Cancer. 2017;15(2):248-255.e1. DOI: 10.1016/j.clgc.2016.07.029
3. Xiao Y, Shan ZJ, Yang JF, Len JJ, Yu YH, Yang ML. Nephrometric scoring system: Recent advances and outlooks. Urol Oncol. 2023;41(1):15-26. DOI: 10.1016/j.urolonc.2022.06.019
4. Veccia A, Antonelli A, Uzzo RG, Novara G, Kutikov A, Ficarra V, Simeone C, Mirone V, Hampton LJ, Derweesh I, Porpiglia F, Autorino R. Predictive Value of Nephrometry Scores in Nephron-sparing Surgery: A Systematic Review and Meta-analysis. Eur Urol Focus. 2020;6(3):490-504. DOI: 10.1016/j.euf.2019.11.004
5. Macleod LC, Hsi RS, Gore JL, Wright JL, Harper JD. Perinephric fat thickness is an independent predictor of operative complexity during robot-assisted partial nephrectomy. J Endourol. 2014;28(5):587-91. DOI: 10.1089/end.2013.0647
6. Hagiwara M, Miyajima A, Hasegawa M, Jinzaki M, Kikuchi E, Nakagawa K, Oya M. Visceral obesity is a strong predictor of perioperative outcome in patients undergoing laparoscopic radical nephrectomy. BJU Int. 2012;110(11 Pt C):E980-4. DOI: 10.1111/j.1464-410X.2012.11274.x
7. Lee SM, Robertson I, Stonier T, Simson N, Amer T, Aboumarzouk OM. Contemporary outcomes and prediction of adherent perinephric fat at partial nephrectomy: a systematic review. Scand J Urol. 2017;51(6):429-434. DOI: 10.1080/21681805.2017.1357656
8. Davidiuk AJ, Parker AS, Thomas CS, Leibovich BC, Castle EP, Heckman MG, Custer K, Thiel DD. Mayo adhesive probability score: an accurate image-based scoring system to predict adherent perinephric fat in partial nephrectomy. Eur Urol. 2014;66(6):1165-71. DOI: 10.1016/j.eururo.2014.08.054
9. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. DOI: 10.3322/caac.21492
10. Herr HW. A history of partial nephrectomy for renal tumors. J Urol. 2005;173(3):705-8. DOI: 10.1097/01.ju.0000146270.65101.1d
11. Campbell SC, Novick AC, Belldegrun A, Blute ML, Chow GK, Derweesh IH, Faraday MM, Kaouk JH, Leveillee RJ, Matin SF, Russo P, Uzzo RG; Practice Guidelines Committee of the American Urological Association. Guideline for management of the clinical T1 renal mass. J Urol. 2009;182(4):1271-9. DOI: 10.1016/j.juro.2009.07.004
12. Choi JE, You JH, Kim DK, Rha KH, Lee SH. Comparison of perioperative outcomes between robotic and laparoscopic partial nephrectomy: a systematic review and meta-analysis. Eur Urol. 2015;67(5):891-901. DOI: 10.1016/j.eururo.2014.12.028
13. Lin P, Wu M, Gu H, Tu L, Liu S, Yu Z, Chen Q, Liu C. Comparison of outcomes between laparoscopic and robot-assisted partial nephrectomy for complex renal tumors: RENAL score ≥7 or maximum tumor size >4 cm. Minerva Urol Nephrol. 2021;73(2):154-164. DOI: 10.23736/S2724-6051.20.04135-1
14. Sharma G, Sharma AP, Tyagi S, Bora GS, Mavuduru RS, Devana SK, Singh SK. Robot-assisted partial nephrectomy for moderate to highly complex renal masses. A systematic review and meta-analysis. Indian J Urol. 2022;38(3):174-183. DOI: 10.4103/iju.iju_393_21
15. Kocher NJ, Kunchala S, Reynolds C, Lehman E, Nie S, Raman JD. Adherent perinephric fat at minimally invasive partial nephrectomy is associated with adverse peri-operative outcomes and malignant renal histology. BJU Int. 2016;117(4):636-41. DOI: 10.1111/bju.13378
16. Fang L, Li H, Zhang T, Liu R, Zhang T, Bi L, Xie D, Wang Y, Yu D. Analysis of predictors of adherent perinephric fat and its impact on perioperative outcomes in laparoscopic partial nephrectomy: a retrospective case-control study. World J Surg Oncol. 2021;19(1):319. DOI: 10.1186/s12957-021-02429-6
17. Сирота Е.С., Рапопорт Л.М., Гридин В. Н., Цариченко Д.Г., Кузнецов И.А., Сирота А.Е., Аляев Ю.Г. Анализ кривой обучения хирургов в зависимости от сложности нефрометрической оценки при выполнении лапароскопической резекции почки у пациентов с локализованными образованиями паренхимы почки. Урология. 2020;6:11-18. DOI: 10.18565/urology.2020.6.11-18
18. Sempels M, Ben Chehida MA, Meunier P, Waltregny D. Open and Laparoscopic Partial Nephrectomy: Comparison and Validation of Preoperative Scoring Systems, Including PADUA, RENAL, ABC Nephrometric Scores and Perinephric Fat Evaluation with Mayo Adhesive Probability Score. Res Rep Urol. 2021;13:509-517. DOI: 10.2147/RRU.S293864
Об авторах
С. В. КотовРоссия
Сергей Владиславович Котов — доктор медицинских наук, профессор; заведующий кафедрой урологии и андрологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; руководитель Университетской клинки урологии, онкоурологии и андрологии ГБУЗ «ММКЦ «Коммунарка» ДЗМ»; врач-уролог урологического отделения ГБУЗ «ГКБ № 1 им. Н.И. Пирогова ДЗМ».
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Р. И. Гуспанов
Россия
Ренат Иватуллаевич Гуспанов — кандидат медицинских наук; доцент кафедры урологии и андрологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; врач-уролог урологического отделения ГБУЗ «ГКБ № 1 им. Н.И. Пирогова ДЗМ»; врач-онколог 4 онкологического отделения (онкоурологии) ГБУЗ «ММКЦ «Коммунарка» ДЗМ».
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Г. Юсуфов
Россия
Анвар Гаджиевич Юсуфов — кандидат медицинских наук; доцент кафедры урологии и андрологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; заведующий урологическим отделением ГБУЗ «ММКЦ «Коммунарка» ДЗМ».
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. А. Неменов
Россия
Александр Александрович Неменов — ассистент кафедры урологии и андрологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; врач-уролог урологического отделения ГБУЗ «ГКБ им. С. С. Юдина ДЗМ».
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. А. Манцов
Россия
Артём Андреевич Манцов — ординатор кафедры урологии и андрологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Котов С.В., Гуспанов Р.И., Юсуфов А.Г., Неменов А.А., Манцов А.А. Влияние adherent perinephric fat на результаты органосохраняющего лечения почечно-клеточного рака. Вестник урологии. 2023;11(2):47-55. https://doi.org/10.21886/2308-6424-2023-11-2-47-55
For citation:
Kotov S.V., Guspanov R.I., Yusufov A.G., Nemenov A.A., Mantsov A.A. Effect of adherent perinephric fat on outcomes of nephron-sparing treatment of renal cell cancer. Urology Herald. 2023;11(2):47-55. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-2-47-55













































