Перейти к:
Злокачественные новообразования кожи у пациентов после трансплантации почки
https://doi.org/10.21886/2308-6424-2022-10-3-36-43
Аннотация
Введение. Появление и широкое внедрение современных схем имуносупрессивной терапии позволило увеличить продолжительность функционирования трансплантированного органа. Однако с увеличением продолжительности жизни пациентов с пересаженным органом стал отмечаться рост числа злокачественных новообразований.
Цель исследования. Представить собственный клинический опыт лечения пациентов со злокачественными новообразованиями кожи после трансплантации почки.
Материалы и методы. В период с 2010 по 2017 год наблюдали 4 пациента со злокачественными новообразованиями кожи. У трёх из них в период от 6 месяцев до 6 лет после трансплантации почки развилась саркома Капоши, у одного спустя 10 лет после операции был диагностирован плоскоклеточный рак кожи.
Результаты. После гистологической верификации саркомы Капоши в двух случаях были выполнены иссечения новообразований с последующим снижением дозировки иммуносупрессивных препаратов. В одном случае произведена полная конверсия иммуносупрессивной терапии. На фоне терапии отмечена стабилизация онкологического процесса, однако в дальнейшем у всех пациентов регистрировали ухудшение функции трансплантата вплоть до её утраты, что привело к удалению почки. Пациенту с плоскоклеточным раком кожи было проведено хирургическое лечение с курсом близкофокусного рентгеновского излучения, однако дальнейшая прогрессия привела к смерти пациента.
Заключение. Реципиенты трансплантата почки пожизненно получают иммуносупрессивную терапию и представляют собой группу высокого риска развития злокачественных образований кожи и повышенного риска смерти от онкологических заболеваний. Отмена иммуносупрессивных препаратов — ингибиторов кальциневрина — всё ещё остаётся главным условием полного излечения пациентов с саркомой Капоши, однако сопровождается крайне высокой вероятностью потери функции трансплантата.
Ключевые слова
Для цитирования:
Перлин Д.В., Александров И.В., Перлина А.Д., Шманев А.О., Дымков И.Н. Злокачественные новообразования кожи у пациентов после трансплантации почки. Вестник урологии. 2022;10(3):36-43. https://doi.org/10.21886/2308-6424-2022-10-3-36-43
For citation:
Perlin D.V., Alexandrov I.V., Perlina A.D., Shmanev A.O., Dymkov I.N. Malignant skin neoplasms in patients after kidney transplantation. Urology Herald. 2022;10(3):36-43. (In Russ.) https://doi.org/10.21886/2308-6424-2022-10-3-36-43
Введение
Современные достижения в области трансплантологии за последние несколько десятилетий привели к значительному увеличению количества выполненных операций и увеличению продолжительности жизни реципиентов. Однако с успехом трансплантации растёт число возможных осложнений, связанных с иммуносупрессивной терапией. К ним относятся прежде всего инфекционные и онкологические заболевания. Частота встречаемости последних примерно в 100 раз превышает заболеваемость в общей популяции [1][2]. Существенную долю онкологических заболеваний после пересадки почки составляют новообразования кожи [3][4].
Цель исследования. Представить собственный клинический опыт лечения пациентов со злокачественными новообразованиями кожи после трансплантации почки.
Материалы и методы
В Волгоградском областном уронефрологическом центре с 2010 по 2017 год наблюдали 4 пациента со злокачественными новообразованиями кожи. У трёх из них в период от 6 месяцев до 6 лет после трансплантации почки развилась саркома Капоши, у одного спустя 10 лет после операции был диагностирован плоскоклеточный рак кожи (ПРК). Во всех случаях саркомы Капоши опухоли были локализованы на коже нижних конечностей, у одного из них новообразования были также на лице. ПРК был первоначально обнаружен в левой височной области головы. Общие данные пациентов приведены в таблице.
Таблица. Характеристика пациентов
Table. Patients demographics
| Пациент 1 Patient 1 | Пациент 2 Patient 2 | Пациент 3 Patient 3 | Пациент 4 Patient 4 |
Пол Gender | мужской male | мужской male | женский female | мужской male |
Возраст, лет Age, years | 45 | 52 | 58 | 42 |
Донор Donor | Трупный Deceased | Трупный Deceased | Трупный Deceased | Трупный Deceased |
Вид диализа Type of dialysis | Додиализная трансплантация No dialysis | Гемодиализ Hemodialysis | Перитонеальный диализ Peritoneal dialysis | Гемодиализ Hemodialysis |
Продолжительность диализа до ТП Duration of dialysis before KT | – | 2 года 2 years | 1 год 1 year | 6 лет 6 years |
Функция трансплантата Transplant function | Отсроченная Delayed | Немедленная Immediate | Немедленная Immediate | Немедленная Immediate |
Период от ТП до выявления новообразования The period from KT to the detection of a neoplasm | 5 месяцев 5 months | 6 лет 6 years | 1 год 1 year | 10 лет 10 years |
Гистологический тип опухоли Neoplasm histological type | Саркома Капоши Kaposi's sarcoma | Саркома Капоши Kaposi's sarcoma | Саркома Капоши Kaposi's sarcoma | Плоскоклеточный рак кожи Squamous cell skin cancer |
Исход Outcome | Трансплантэктомия (Пациент жив) Transplantectomy (Alive) | Трансплантэктомия (Пациент жив) Transplantectomy (Alive) | Трансплантэктомия (Пациент жив) Transplantectomy (Alive) | Прогрессирования заболевания (Летальный исход) Disease progression (Died) |
Примечание. ТП — трансплантация почки Note. KT — kidney transplantation | ||||
Всем четырём пациентам трансплантация почки была выполнена от трупного донора. Функция трансплантата у трёх из четырёх реципиентов была немедленная, у одного пациента (с развившейся впоследствии саркомой Капоши) — отсроченная, с началом восстановления диуреза на восьмые сутки. Двое из трёх пациентов с саркомой Капоши с момента операции получали базовую иммуносупрессивную терапию, включающую такролимус, микофенолаты и метилпреднизолон, один — циклоспорин, микофенолаты и метилпреднизолон. Пациенту с отсроченной функцией трансплантата в ближайшем послеоперационном периоде дополнительно проведён 7-дневный курс терапии препаратом антитимоцитарных антител (ATG). Пациент с ПРК получал терапию такролимусом, мофетилом микофенолатом и метилпреднизолоном.
Результаты
Во всех трёх случаях саркомы Капоши первым этапом выполняли биопсию новообразований. После гистологической верификации в двух случаях были выполнены иссечения новообразований с последующим снижением дозировки иммуносупрессивных препаратов, в одном случае выполнена полная конверсия с такролимуса на эверолимус в стартовой дозе 3,5 мг/сутки с достижением целевой концентрации препарата 4,0 – 8,0 нг/мл. После проведённой конверсии отмечена стабилизация состояния с последующим регрессом образований в течение последующих 17 месяцев (рис. 1А – 1В). На фоне снижения концентрации иммуносупрессивного препарата отмечено появление протеинурии до 2,4 г/сутки и рост уровня креатинина крови до 260,0 мкмоль/л, потребовавшие увеличить дозу метилпреднизолона до 10,0 мг в сутки. В течение последующих 3 месяцев вновь отмечен прогрессивный рост новообразований и появление новых очагов, что явилось причиной прекращения иммуносупрессивной терапии, приведшей к потере функции почки и удалению трансплантата. Через 2 месяца отмечен полный регресс образований (рис. 1С).
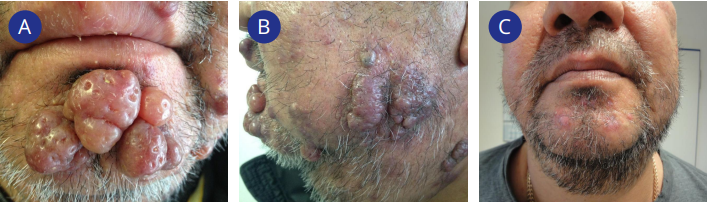
Рисунок 1. Пациент с саркомой Капоши: А — кожные проявления до конверсии терапии; В — частичный регресс кожных элементов через 1 месяц после конверсии терапии; С — полный регресс кожных элементов через 2 месяца после конверсии терапии
Figure 1. Change in skin manifestations: А — a patient with Kaposi's sarcoma before conversion of therapy; B — partial regression of skin elements 1 month after conversion of therapy; C — complete response, complete regression 2 month after conversion of therapy
У остальных двух пациентов с саркомой Капоши, несмотря на снижение дозировки такролимуса до 1 мг/сутки (пациент 2) и циклоспорина 50 мг/сутки (пациент 3) соответственно, кожные изменения быстро прогрессировали. В обоих случаях также вынужденно была отменена иммуносупрессивная терапия, что также привело к быстрой потере функции трансплантата и его удалению.
У четвёртого пациента новообразование кожи в области височной области головы было обнаружено спустя 10 лет после трансплантации. Опухоль была иссечена, верифицирована плоскоклеточная карцинома. Через 2 года был отмечен локальный рецидив образования, кроме того, выявлены новые очаги на коже лобной области и передней стенке грудной клетки. Все образования были широко иссечены с основанием, при гистологическом исследовании верифицирован ПРК, дополнительно проведён курс близкофокусной лучевой терапии в дозировке 80 Гр. Функция трансплантата оставалась на протяжении всего периода наблюдения стабильной. В связи с категорическим отказом пациента от прекращения иммуносупрессии схема терапии была конвертирована на двухкомпонентную (такролимус + метилпреднизолон). Тем не менее, ещё через 6 месяцев вновь зафиксировано прогрессирование заболевания в мягкие ткани теменной области с поражением костей черепа (рис. 2). Несмотря на проводимую терапию, дальнейшая прогрессия привела к смерти пациента через три года после начала онкологического заболевания.
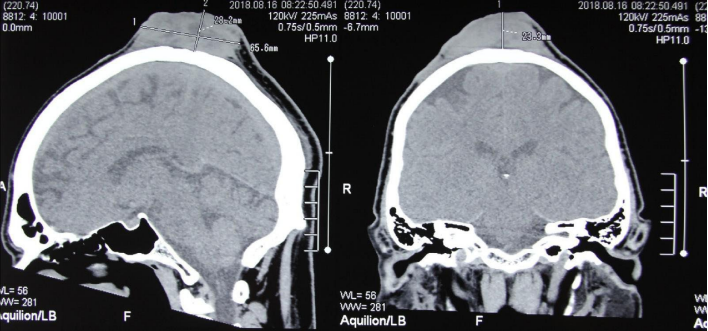
Рисунок 2. Компьютерная томограмма пациента с метастазом в кости черепа
Figure 2. Computed tomography scan of skull bones metastases
Обсуждение
Саркома Капоши — это заболевание, ассоциированное с вирусом герпеса человека 8 типа (ВГЧ-8) и характеризующееся множественными кожными и внекожными новообразованиями эндотелиальной природы. Частота распространения классической формы саркомы Капоши значительно варьируется в различных географических областях от 0,14 на 1 млн жителей (как мужчин, так и женщин) до 10,50 на 1 млн мужчин и 2,7 на 1 млн женщин.
Большую роль в развитии саркомы Капоши после пересадки почки, возможно, играет активация репликации ВГЧ-8 в крови, сопровождающаяся диссеминацией и поражением лимфатических эндотелиальных клеток. Последние превращаются в веретенообразные клетки, которые считаются предшественниками заболевания [5]. Некоторые веретенообразные клетки, вступая в фазу пролиферации, экспрессируют онкопротеины, которые стимулируют секрецию сосудистого эндотелиального фактора роста (VEGF), одновременно повышая экспрессию рецепторов VEGF на эндотелиальных клетках. Таким образом, возникает порочный круг, играющий ключевую роль в развитии конечной пролиферативной фазы опухоли. Ингибиторы кальциневрина способствуют нарушению регуляции экспрессии рецепторов VEGF, тем самым стимулируя ангиогенез и повышая инвазивность опухолевых клеток за счёт механизмов, зависимых от факторов опухолевого роста (TGF-β) [6]. Это определённым образом подтверждается полной регрессией саркомы Капоши у некоторых пациентов после отмены всей иммуносупрессивной терапии. Однако такая тактика почти неизбежно приводит к развитию острого отторжения и потере трансплантата.
В отличие от ингибиторов кальциневрина ингибиторы мишени рапамицина у млекопитающих (mTOR) блокируют индуцируемую факторами роста пролиферацию гемопоэтических и негемопоэтических клеток, включая гладкомышечные клетки сосудов и бронхов. Их антипролиферативный эффект не ограничен иммунной системой [7, 8]. Связывая mTOR, ингибиторы mTOR подавляют активацию киназы p70S6, что приводит к остановке клеточного цикла между фазами G и S. В частности, антиангиогенная активность эверолимуса связана в большой степени со снижением продукции VEGF. Таким образом эверолимус угнетает рост некоторых васкуляризированных опухолей. Назначение mTOR-ингибиторов в сочетании с редукцией базовой иммуносупрессивной терапии уже применялось с большим или меньшим успехом при лечении саркомы Капоши у пациентов после трансплантации почки [5][6]. Однако их эффективность в подобных случаях пока не является достаточно доказанной [9]. Начало деградации кожных элементов саркомы некоторые исследователи наблюдали в среднем через 3 – 4 месяца [6][7]. В нашем наблюдении прекращение появления новых кожных элементов и деградация старых отмечены через месяц после конверсии на эверолимус. В отличие от G. Stallone et al. (2005) [6] нам не удалось добиться полного исчезновения всех кожных проявлений саркомы Капоши, однако мы получили стойкую ремиссию заболевания в течение более 17 месяцев последующего наблюдения при продолжающейся постепенной регрессии новообразований. Ранее мы наблюдали в ряде случаев полную регрессию всех элементов саркомы после полной отмены иммуносупрессии, которая сопровождалась в итоге потерей трансплантата [10]. Поэтому в данном случае сложно определить, является ли достигнутая стойкая ремиссия результатом прямого воздействия эверолимуса или же следствием отмены такролимуса. Возможно, сочетанием этих факторов. Ранее некоторыми исследованиями было показано достоверное увеличение протеинурии после перевода пациентов на терапию mTOR-ингибиторами как с циклоспорина, так и с азатиоприна. Поэтому это явление не может быть объяснено только гемодинамическим эффектом отмены ингибиторов кальциневрина [11]. Значительный рост протеинурии до 2,5 г/сутки у описанного нами пациента отмечен через 3 недели после отмены такролимуса и назначения эверолимуса. По некоторым данным, это явление носит обратимый характер после возвращения CNI [11]. Мы не сочли возможным вновь перейти на такролимус в связи большим риском прогрессии саркомы. Тем не менее уровень протеинурии удалось стабилизировать и даже снизить до 0,4 – 0,5 г/сутки увеличением пероральной дозы метилпреднизолона до 10,0 мг/сутки. Главная опасность уменьшения иммуносупрессии заключается в опасности развития острого и хронического отторжения. Несмотря на довольно быстрое увеличение протеинурии у нашего пациента уровень креатинина плазмы не повышался в течение всего периода наблюдения после полной отмены такролимуса.
Базальноклеточный (БРК) и ПРК объединены в группу немеланомных опухолей кожи и происходят из эпителиальных клеток. Источником развития БРК являются клетки базального слоя эпителия, источником ПРК — кератиноциты кожи. Самым значимым фактором риска спорадических (ненаследственных) форм немеланомных опухолей кожи следует считать воздействие на кожу ультрафиолетового излучения. Во многих случаях немеланомные опухоли кожи развиваются на фоне предсуществующих предопухолевых новообразований (вроде актинического кератоза или кератоакантомы).
В 2014 году в Российской Федерации под наблюдением находилось 393 536 больных с немелономными опухолями кожи (269,3 на 100 000 населения). Прирост заболеваемости составил 2,6% у мужчин (9-е место по величине прироста) и 10,6% у женщин (7-е место по величине прироста). Средний возраст заболевших оказался равным 68,7 лет. Доля больных с I и II стадией на момент выявления заболевания достигла 96,6% [12]. Около половины всех злокачественных новообразований среди пациентов после трансплантации — злокачественные образования кожи [3][4]. Наиболее важными факторами риска развития злокачественных новообразований кожи у пациентов после трансплантации органов являются количество солнечного света и возраст на момент трансплантации. В значительной мере заболеваемость зависит от продолжительности пребывания на солнце. В регионах с ограниченным воздействием солнца, таких как Нидерланды, риск кожной опухоли составляет 10,0% через 10 лет после трансплантации и 40,0% через 20 лет [13]. В регионах с высокой степенью воздействия солнца, таких как Австралия, заболеваемость составляет 45% через 11 лет после трансплантации и 70,0% через 20 лет [14].
БРК встречается намного чаще, чем ПРК. Тем не менее, частота ПРК у реципиентов трансплантата в 40 – 250 раз выше, чем в общей популяции, тогда как частота БРК в 10 раз выше у пациентов после трансплантации [15][16]. Это приводит к изменению отношения БРК / ПРК. Нормальная популяция имеет соотношение 5:1, тогда как у пациентов с трансплантатами среднее соотношение составляет от 1:1,8 до 2,3 (диапазон от 1:1,2 до 1:15) [1][2][16]. Степень солнечного повреждения в возрасте до 20 лет влияет на частоту ПРК [17]. На участках тела пациентов с трансплантатами, подвергающихся высокому воздействию солнечного света, наблюдается 21-кратное увеличение случаев рака кожи по сравнению с населением в целом по сравнению с 4 – 7-кратным увеличением рака кожи в местах ограниченного солнечного воздействия [1, 16]. Солнечное повреждение в возрасте до 30 лет является основным фактором риска ПРК после трансплантации [15], и риск выше у тех, кто был подвергнут пересадке после 35 лет [18]. Другими независимыми факторами риска являются количество кератотических поражений кожи, таких как вирусные бородавки и актинические кератозы [15], а также сахарный диабет [19], мужской пол и работа на открытом воздухе [20-22]. ПРК у пациентов с трансплантатами гораздо более агрессивны, часто рецидивируют и приводят к летальному исходу [23][24]. Развитие метастазов в лимфатических узлах при злокачественных новообразованиях кожи встречаются у 5,8% пациентов, при этом у 75,0% пациентов причиной метастазирования является ПРК [16].
Из 5,1% пациентов после трансплантации, которые умирают от рака кожи, 60,0% имели ПРК и 33,0% имели меланому [16], что представляет собой 10-кратное увеличение смертности от ПРК [25]. Это резко контрастирует со смертностью от рака кожи среди населения в целом, где меланома является наиболее частой причиной смерти. Исследователи установили, что количество выявленных случаев рака увеличивалось в зависимости от продолжительности иммуносупрессии и составило 20,7% через 5 лет, 37,35% через 10 лет и 53,08% через 15 лет после трансплантации [26]. Важным в стратегии лечения злокачественных новообразований кожи являются профилактические меры, включающие в себя защиту от ультрафиолетового излучения, исключение избыточной иммуносупрессивной терапии, элиминацию персистирующей папилломавирусной инфекции. Воздействие УФ-излучения представляется наиболее важным фактором. Все пациенты, перенёсшие трансплантацию, должны пройти осмотр дерматолога до и после трансплантации. Основы защиты от солнца включают использование солнцезащитных кремов с фактором защиты от солнца (SPF) не менее 15, использование защитной одежды и головных уборов и избегание солнца, особенно в часы с 10:00 до 16:00.
Заключение
Реципиенты трансплантата почки пожизненно получают иммуносупрессивную терапию и представляют собой группу высокого риска развития злокачественных образований кожи и повышенного риска смерти от онкологических заболеваний. Необходимо обязательное периодическое наблюдение всех реципиентов дерматологом с целью раннего выявления новообразований кожи. Полная отмена иммуносупрессивных препаратов — ингибиторов кальциневрина — всё ещё остаётся главным условием полного излечения пациентов с саркомой Капоши, однако сопровождается крайне высокой вероятностью потери функции трансплантата.
Список литературы
1. Penn I. Occurrence of cancers in immunosuppressed organ transplant recipients. Clin Transpl. 1998:147-58. PMID: 10503093
2. Gupta AK, Cardella CJ, Haberman HF. Cutaneous malignant neoplasms in patients with renal transplants. Arch Dermatol. 1986;122(11):1288-93. https://doi.org/10.1001/archderm.1986.01660230080015
3. Penn I. Cancers in cyclosporine-treated vs azathioprine-treated patients. Transplant Proc. 1996;28(2):876-8. PMID: 8623443
4. London NJ, Farmery SM, Will EJ, Davison AM, Lodge JP. Risk of neoplasia in renal transplant patients. Lancet. 1995;346(8972):403-6. Erratum in: Lancet 1995;346(8976):714. https://doi.org/10.1016/s0140-6736(95)92780-8
5. Montaner S, Sodhi A, Molinolo A, Bugge TH, Sawai ET, He Y, Li Y, Ray PE, Gutkind JS. Endothelial infection with KSHV genes in vivo reveals that vGPCR initiates Kaposi's sarcomagenesis and can promote the tumorigenic potential of viral latent genes. Cancer Cell. 2003;3(1):23-36. https://doi.org/10.1016/s1535-6108(02)00237-4
6. Stallone G, Schena A, Infante B, Di Paolo S, Loverre A, Maggio G, Ranieri E, Gesualdo L, Schena FP, Grandaliano G. Sirolimus for Kaposi's sarcoma in renal-transplant recipients. N Engl J Med. 2005;352(13):1317-23. https://doi.org/10.1056/NEJMoa042831
7. Campistol JM, Gutierrez-Dalmau A, Torregrosa JV. Conversion to sirolimus: a successful treatment for posttransplantation Kaposi's sarcoma. Transplantation. 2004;77(5):760-762. https://doi.org/10.1097/01.tp.0000115344.18025.0b
8. Peters T, Traboulsi D, Tibbles LA, Mydlarski PR. Sirolimus: a therapeutic advance for dermatologic disease. Skin Therapy Lett. 2014;19(4):1-4. PMID: 25188522
9. Descoeudres B, Giannini O, Graf T, Steiger J, Mayr M. No effect of sirolimus for kaposi sarcoma in a renal transplant recipient. Transplantation. 2006;81(10):1472-1474. https://doi.org/10.1097/01.tp.0000203322.99037.d2
10. Александров И.В., Молочков В.А., Перлина А.Д., Перлин Д.В. Применение эверолимуса при лечении саркомы Капоши после трансплантации почки. Вестник трансплантологии и искусственных органов. 2015;17(2):60-63.
11. Van den Akker JM, Wetzels JF, Hoitsma AJ. Proteinuria following conversion from azathioprine to sirolimus in renal transplant recipients. Kidney Int. 2006;70(7):1355-1357. https://doi.org/10.1038/sj.ki.5001792
12. Злокачественные новообразования в России в 2014 году (заболеваемость и смертность). Под редакцией А.Д. Каприна, В.В. Старинского, Г.В. Петровой. Москва: РИИС ФИАН; 2016.
13. Hartevelt MM, Bavinck JN, Kootte AM, Vermeer BJ, Vandenbroucke JP. Incidence of skin cancer after renal transplantation in The Netherlands. Transplantation. 1990;49(3):506-509. https://doi.org/10.1097/00007890-199003000-00006
14. Sheil AG, Disney AP, Mathew TG, Amiss N, Excell L. Malignancy following renal transplantation. Transplant Proc. 1992;24(5):1946-1947. PMID: 1412921
15. Bavinck JN, De Boer A, Vermeer BJ, Hartevelt MM, van der Woude FJ, Claas FH, Wolterbeek R, Vandenbroucke JP. Sunlight, keratotic skin lesions and skin cancer in renal transplant recipients. Br J Dermatol. 1993;129(3):242-9. https://doi.org/10.1111/j.1365-2133.1993.tb11841.x
16. Penn I. Skin disorders in organ transplant recipients. External anogenital lesions. Arch Dermatol. 1997;133(2):221-223. PMID: 9041837
17. Marks R, Jolley D, Lectsas S, Foley P. The role of childhood exposure to sunlight in the development of solar keratoses and non-melanocytic skin cancer. Med J Aust. 1990;152(2):62-66. https://doi.org/10.5694/j.1326-5377.1990.tb124456.x
18. Dyall-Smith D, Ross JB. Cutaneous malignancies in renal transplant recipients from Nova Scotia, Canada. Australas J Dermatol. 1995;36(2):79-82. https://doi.org/10.1111/j.1440-0960.1995.tb00937.x
19. Gruber SA, Gillingham K, Sothern RB, Stephanian E, Matas AJ, Dunn DL. De novo cancer in cyclosporine-treated and non-cyclosporine-treated adult primary renal allograft recipients. Clin Transplant. 1994;8(4):388-95. PMID: 7949545
20. Liddington M, Richardson AJ, Higgins RM, Endre ZH, Venning VA, Murie JA, Morris PJ. Skin cancer in renal transplant recipients. Br J Surg. 1989;76(10):1002-5. https://doi.org/10.1002/bjs.1800761005
21. Euvrard S, Kanitakis J, Pouteil-Noble C, Dureau G, Touraine JL, Faure M, Claudy A, Thivolet J. Comparative epidemiologic study of premalignant and malignant epithelial cutaneous lesions developing after kidney and heart transplantation. J Am Acad Dermatol. 1995;33(2 Pt 1):222-9. https://doi.org/10.1016/0190-9622(95)90239-2
22. Naldi L, Fortina AB, Lovati S, Barba A, Gotti E, Tessari G, Schena D, Diociaiuti A, Nanni G, La Parola IL, Masini C, Piaserico S, Peserico A, Cainelli T, Remuzzi G. Risk of nonmelanoma skin cancer in Italian organ transplant recipients. A registry-based study. Transplantation. 2000;70(10):1479-84. https://doi.org/10.1097/00007890-200011270-00015
23. Ramsay HM, Fryer AA, Reece S, Smith AG, Harden PN. Clinical risk factors associated with nonmelanoma skin cancer in renal transplant recipients. Am J Kidney Dis. 2000;36(1):167-176. https://doi.org/10.1053/ajkd.2000.8290
24. Barrett WL, First MR, Aron BS, Penn I. Clinical course of malignancies in renal transplant recipients. Cancer. 1993;72(7):2186-9. PMID: 8374876
25. Euvrard S, Chardonnet Y, Pouteil-Noble C, Kanitakis J, Chignol MC, Thivolet J, Touraine JL. Association of skin malignancies with various and multiple carcinogenic and noncarcinogenic human papillomaviruses in renal transplant recipients. Cancer. 1993;72(7):2198-206. PMID: 8397062
26. Moloney FJ, Comber H, O'Lorcain P, O'Kelly P, Conlon PJ, Murphy GM. A population-based study of skin cancer incidence and prevalence in renal transplant recipients. Br J Dermatol. 2006;154(3):498-504. https://doi.org/10.1111/j.1365-2133.2005.07021.x
Об авторах
Д. В. ПерлинРоссия
Дмитрий Владиславович Перлин — доктор медицинских наук, профессор; заведующий кафедрой урологии, нефрологии и трансплантологии
404120, Россия, г. Волжский, ул. им. генерала Карбышева, д. 86
И. В. Александров
Россия
Илья Вячеславович Александров — кандидат медицинских наук; заместитель главного врача по клинико-экспертной работе
404120, Россия, г. Волжский, ул. им. генерала Карбышева, д. 86
А. Д. Перлина
Россия
Анастасия Дмитриевна Перлина — врач-дерматолог
129110, Россия, г. Москва, ул. Щепкина, д. 61/2, корп. 1
А. О. Шманев
Россия
Артём Олегович Шманев — врач-онколог
404120, Россия, г. Волжский, ул. им. генерала Карбышева, д. 86
И. Н. Дымков
Россия
Иван Николаевич Дымков — кандидат медицинских наук; заместитель главного врача по медицинской части
404120, Россия, г. Волжский, ул. им. генерала Карбышева, д. 86
Рецензия
Для цитирования:
Перлин Д.В., Александров И.В., Перлина А.Д., Шманев А.О., Дымков И.Н. Злокачественные новообразования кожи у пациентов после трансплантации почки. Вестник урологии. 2022;10(3):36-43. https://doi.org/10.21886/2308-6424-2022-10-3-36-43
For citation:
Perlin D.V., Alexandrov I.V., Perlina A.D., Shmanev A.O., Dymkov I.N. Malignant skin neoplasms in patients after kidney transplantation. Urology Herald. 2022;10(3):36-43. (In Russ.) https://doi.org/10.21886/2308-6424-2022-10-3-36-43
JATS XML













































