Перейти к:
Симптомы нижних мочевых путей как следствие отмены препаратов тестостерона, длительно применявшихся в немедицинских целях
https://doi.org/10.21886/2308-6424-2022-10-3-05-12
Аннотация
Введение. Процесс старения у мужчин сопровождается прогрессирующим снижением уровня тестостерона (Тс), циркулирующего в сыворотке крови. В дополнение к хронологическому старению, снижению эндогенного Тс и развитию вторичного гипогонадизма способствуют различные другие факторы. Одним из таких факторов является длительный приём препаратов тестостерона (ПТ), применявшихся в немедицинских целях.
Цель исследования. Оценить характер симптомов нижних мочевых путей у мужчин после отмены ПТ, длительно применявшихся в немедицинских целях.
Материалы и методы. Проведён клинико-статистический анализ результатов обследования 31 мужчины в возрасте 22 – 46 лет, которые получали ПТ в немедицинских целях при посещении тренажёрных залов и в последующем обратились к урологу с жалобами на наличие симптомов нижних мочевых путей (СНМП). В исследовании применяли опросник International Prostatic Symptom Score (IPSS) и лабораторно-инструментальные методы обследования: общеклинические исследования мочи и крови, микроскопическое исследование секрета простаты, исследования общего Тс, фолликулостимулирующего и лютеинизирующего гормонов, пролактина, эстрадиола в сыворотке крови, ультразвуковое исследование мочевого пузыря и простаты, урофлоуметрию.
Результаты. При оценке СНМП отмечено превалирование ирритативной симптоматики над обструктивной. Уровень общего Тс сыворотки крови у 13 (41,9%) мужчин был в диапазоне 8 – 11 нмоль/л, у 18 (58,1%) — ниже 8 нмоль/л. У большинства (77,4%) пациентов имели место гиповаскулярные участки в предстательной железе, а у 67,7% мужчин выявлен фиброз простаты.
Заключение. Отмена ПТ, длительно применявшихся в немедицинских целях, может сопровождаться развитием вторичного гипогонадизма и СНМП, которые в превалирующем большинстве случаев носят ирритативный характер. В лечении данных пациентов должна разрабатываться программа реабилитации, носящая междисциплинарный характер.
Ключевые слова
Для цитирования:
Ибишев Х.С., Шарбабчиев В.А., Палёный А.И., Ужахов М.М., Межидова А.Д. Симптомы нижних мочевых путей как следствие отмены препаратов тестостерона, длительно применявшихся в немедицинских целях. Вестник урологии. 2022;10(3):5-12. https://doi.org/10.21886/2308-6424-2022-10-3-05-12
For citation:
Ibishev Kh.S., Sharbabchiev V.A., Paleny A.I., Uzhakhov M.M., Mezhidova A.D. Lower urinary tract symptoms following discontinuation of long-term non-medical use of testosterone preparations. Urology Herald. 2022;10(3):5-12. (In Russ.) https://doi.org/10.21886/2308-6424-2022-10-3-05-12
Введение
Процесс старения у мужчин сопровождается прогрессирующим снижением уровня тестостерона (Тс) в сыворотке крови [1][2]. В дополнение к хронологическому старению различные соматические заболевания (сахарный диабет, артериальная гипертензия, ожирение и др.), возникающие, как правило, в пожилом возрасте, и некоторые лекарственные средства, используемые для их лечения (атенолол, анаприлин, верошпирон, гипотазид и др.), также способствуют снижению уровня циркулирующего в сыворотке крови Тс [2–6]. У эугонадных мужчин транзиторный гипогонадотропный гипогонадизм может развиться вследствие любого тяжёлого острого заболевания или травмы [7][8]. Кроме того, вредные привычки, такие как употребление табака, наркотических средств и алкоголя, а также факторы питания, от недоедания до ожирения, усиливают возрастное снижение уровня андрогенов. В связи с этим заболевания ассоциированные с дефицитом Тс, нередко регистрируются в молодом возрасте.
Одним из широко обсуждаемых в последние годы факторов снижения уровня эндогенного Тс у лиц молодого возраста является длительный приём препаратов тестостерона (ПТ) в немедицинских целях [9][10]. К группе риска немедицинского применения ПТ относятся непрофессиональные спортсмены и лица, занимающиеся в спортивных центрах для рекреационной физической активности [11][12].
Модели длительного употребления ПТ, включая супратерапевтические дозы и комбинации ПТ, с последующей их отменой повышают риск неблагоприятных психических и других медицинских последствий, вызванных дефицитом Тс. При этом потребители немедицинского применения ПТ чаще обращаются к врачам по поводу непсихиатрических медицинских последствий, чем по поводу изменений в своём психическом статусе. В то же время мотивация к постоянному использованию ПТ, несмотря на неблагоприятные последствия, в значительной степени поддерживается психологическими факторами [12].
К наиболее распространённым нежелательным явлениям со стороны мочевых путей и органов репродуктивной системы, связанным с отменой длительно применяемых ПТ, ингибирующих синтез собственного Тс, относят эректильную дисфункцию, снижение либидо, инфертильность и симптомы нижних мочевых путей (СНМП) [11][13][14].
Цель исследования. Оценить характер СНМП у мужчин после отмены ПТ, длительно применявшихся в немедицинских целях.
Материалы и методы
Проведён клинико-статистический анализ результатов обследования 31 мужчины в возрасте 22 – 46 лет, которые получали ПТ в немедицинских целях при посещении тренажёрных залов и в последующем обратились к урологу с жалобами на наличие СНМП. Приём ПТ был инициирован без медицинских показаний самостоятельно мужчинами или сотрудниками спортивных центров. СНМП мужчины стали отмечать после отмены ПТ. Из анамнестических данных известно, что до назначения ПТ уровень гормонального статуса (Тс, фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), пролактин, эстрадиол) соответствовал нормативным значениям, данных об инфекционно-воспалительном процессе мочевых путей и простаты не было. Длительность приёма ПТ в течение 2-х лет отмечена у 10 (32,3%) мужчин, от 2-х до 4-х лет — у 8 (25,8%), свыше 4-х лет — у 13 (41,9%) мужчин.
При обследовании пациентов применяли шкалу International Prostatic Symptom Score (IPSS). Для каждого пациента рассчитывали общую сумму баллов СНМП (max = 35 баллов), а также отдельно изучали симптомы накопления (max = 20 баллов) и симптомы опорожнения (max = 15 баллов). Выполняли лабораторные и инструментальные тесты, такие как общеклинические исследования мочи и крови, микроскопическое исследование секрета простаты (СПЖ), исследования уровня общего Тс, ФСГ, ЛГ, пролактина, эстрадиола в сыворотке крови, ультразвуковое исследование (УЗИ) мочевого пузыря и простаты, урофлоуметрию.
Гормональные исследования выполняли на полностью автоматизированном иммунохимическом анализаторе Cobas 6000 (Roche Diagnostics International Ltd.», Rotkreuz, Switzerland) с применением инновационной запатентованной технологии электрохемилюминесценции и использованием количественного метода измерения антигена или антитела, основанном на изменении сигнала электрохемилюминесценции (ECL) до и после иммунореакции.
Методы статистического анализа. Результаты исследования были обработаны с использованием электронных таблиц Microsoft Excel из пакета программ Microsoft Office, 2007. Статистическую обработку данных проводили с использованием статистического пакета Statistica ver.6.1 (StatSoft Inc., Tulsa, OK, USA). Оценку соответствия распределения признаков закону нормального распределения проводили с применением критерия Shapiro-Wilk. Все количественные данные описывались как среднее (М) ± стандартное отклонение (SD). При описании качественных данных использовали абсолютные значения (n) и проценты (%).
Результаты
Клинико-лабораторные показатели на момент обращения отражены в таблице.
Таблица. Клинико-лабораторные показатели
Table. Clinical and laboratory indicators
Показатели Indicators | Значение | Value | Норма Reference | |
Среднее (M) Mean (M) | Стандартное отклонение (SD) Standard Deviation (SD) | ||
Возраст, лет Age, years | 37,96 | 4,43 | – |
Тс, нмоль/л Тс, nmol/l | 13,82 | 4,19 | ≥ 12,10 |
ФСГ, мМЕ/мл FSH, mIU/ml | 7,41 | 4,07 | 0,70 – 11,20 |
ЛГ, ЕД/л LH, U/l | 8,21 | 3,22 | 1,14 – 8,75 |
Пролактин, мкМЕ/мл Prolactin, µIU/ml | 205,00 | 36,21 | 86,00 – 324,00 |
Эстрадиол, пмоль/л Estradiol, pmol/l | 63,19 | 9,21 | 40,00 – 161,00 |
ПСА, нг/мл PSA, ng/ml | 1,21 | 0,44 | ≤ 4,00 |
Лейкоциты в моче, х/ Leukocytes in urine, x/ | 2,85 | 1,01 | 0,00 – 3,00 |
Лейкоциты в СПЖ, х/ Leukocytes in EPS, x/ | 4,06 | 1,05 | ≤ 10,00 |
Объём простаты, см3 Prostate volume, cm3 | 34,19 | 5,07 | ≤ 25,00 – 30,00 |
Qmax, мл/c Qmax, ml/s | 14,18 | 2,40 | > 15,00 |
Остаточная моча, мл Residual urine, ml | 24,15 | 10,11 | < 50,00 |
Шкала IPSS | IPSS scale |
0 – 7 — лёгкая (mild) 8 – 19 — умеренная (moderate) ≥ 20 — тяжёлая (severe)
| ||
Ирритативные симптомы, баллы Irritative symptoms, score | 8,87 | 3,06 | |
Обструктивные симптомы, баллы Obstructive symptoms, score | 2,61 | 1,35 | |
Суммарно, баллы Total score | 11,51 | 4,13 | |
Примечание. Тс — общий тестостерон; ФСГ — фолликулостимулирующий гормон; ЛГ — лютеинизирующий гормон; ПСА — простатспецифический антиген; СПЖ — секрет предстательной железы; IPSS — шкала International Prostatic Symptom Score Note. Tc — total testosterone; FSH — follicle-stimulating hormone; LH — luteinizing hormone; PSA — prostate-specific antigen; EPS — expressed prostatic secretion; IPSS — International Prostatic Symptom Score scale | |||
Анализ результатов шкалы IPSS выявил, что у 27 (87,1%) пациентов регистрировалась симптоматика умеренной степени выраженности (8 – 19 баллов), а у 4 (12,9%) лёгкая (0 – 7 балла) (рис. 1). При оценке характера СНМП было отмечено, что у пациентов превалировали ирритативные симптомы как по количеству наблюдений, так и по степени выраженности (рис. 2, 3)
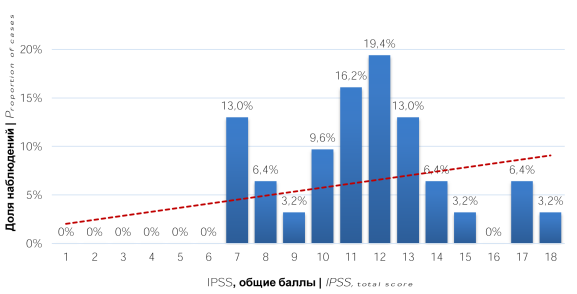
Рисунок 1. Распределение пациентов по баллам шкалы IPSS (общая сумма балов)
Figure 1. Distribution of patients by IPSS scores (total scores)
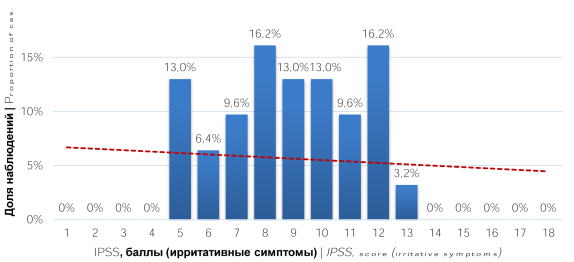
Рисунок 2. Распределение пациентов по баллам шкалы IPSS (ирритативная симптоматика)
Figure 2. Distribution of patients by IPSS scores (irritative symptoms)
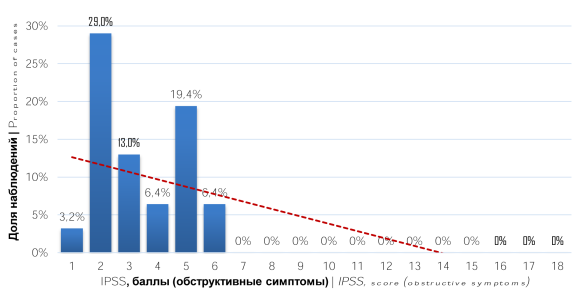
Рисунок 3. Распределение пациентов по баллам шкалы IPSS (обструктивная симптоматика)
Figure 3. Distribution of patients by IPSS scores (obstructive symptoms)
Уровень общего Тс сыворотки крови у 13 (41,9%) мужчин был в диапазоне от 8 – 11 нмоль/л, у 18 (58,1%) — ниже 8 нмоль/л. Повышение уровня ФСГ выше нормативных значений было отмечено у 5 (16,1%) мужчин, ЛГ и пролактина — у 9 (29,0%) и 5 (16,1%) мужчин соответственно. Снижение уровня эстрадиола ниже референсного значения было выявлено у 6 (19,4%) мужчин.
УЗИ простаты выявило гиповаскулярные участки в 24 (77,4%) наблюдениях: 11 (35,5%) — односторонняя локализация, 13 (41,9%) — двусторонняя локализация (рис. 4A). У 8 (25,8%) обследуемых они располагались в транзиторной зоне, у 4 (12,9%) — в центральной зоне, и у 12 (38,7%) пациентов были затронуты обе зоны простаты. Кроме того, у 21 (67,7%) пациента имел место фиброз простаты, причём у 7 (22,6%) пациентов фиброзный процесс был выявлен в одной доле простаты, а у 14 (45,2%) пациентов — в двух долях (рис. 4B, 4C).
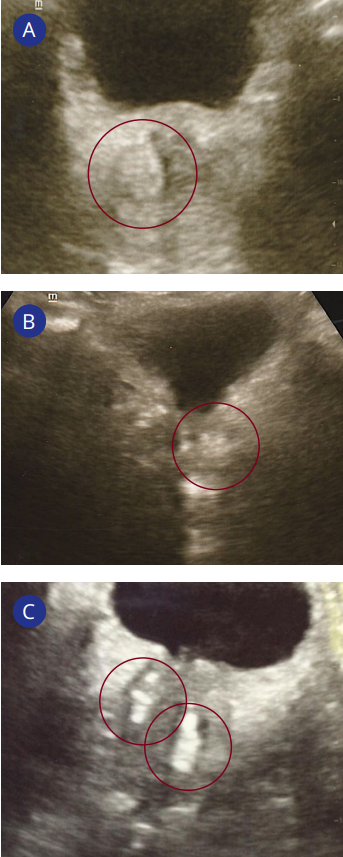
Рисунок 4. Сонограммы предстательной железы: A — гиповаскулярный участок в правой доле простаты; B — фиброз в левой доле простаты; C — фиброз в обеих долях простаты
Figure 4. Prostate ultrasound scans: A — low blood flow area in the prostate right lobe; B — fibrosis in the prostate left lobe; C — fibrosis in prostate both lobes
Обсуждение
В современной литературе скудно освещены патогенетические механизмы развития нежелательных явлений вследствие длительного приёма ПТ, в том числе со стороны мочевых путей и репродуктивных органов. Однако известно, что патогенез СНМП на фоне дефицита Тс имеет сложные нейроэндокринные механизмы, главенствующую роль среди которых играет эндотелиальная дисфункция. При дефиците Тс отмечаются снижение или полная утрата способности эндотелиальных клеток сосудов организма обеспечивать адекватный синтез сосудосуживающих и сосудорасширяющих факторов, определяющих структурно-функциональную целостность эндотелия и профилактические антиатерогенные эффекты [15][16]. Также доказано, что функциональная активность детрузора, простаты и уретры снижается при дефиците Тс. Как известно, в условиях длительного снижения уровня Тс в сыворотке крови нарушается синтез оксида азота (NO) в нейроэндотелии сосудов, что приводит к стойкому спазму стенки сосудов различных органов и систем, что в свою очередь способствует развитию сначала гемической, а затем и клеточно-тканевой гипоксии. Развивающаяся далее локальная и системная ишемия, в частности тазовая, ведущая к гипоксии тазово-уретро-простатической зоны, рассматривается важнейшим индуктором СНММ [13].
СНМП является важной детерминантой качества жизни мужчин в любом возрастном периоде [17][18]. В нашем исследовании мужчины, длительно принимавшие ПТ в немедицинских целях, в превалирующем большинстве случаев (87,1%) были молодого возраста (18 – 44 лет). Регистрируемые у них СНМП во всех наблюдениях носили ирритативный характер, а в 24 (77,4%) случаях сочетались с симптомами опорожнения. Сумма баллов ирритативных симптомов у 22 (71,0%) пациентов была > 7 баллов, и лишь у 9 (29,0%) — от 5 – 7 баллов, тогда как сумма баллов обструктивных симптомов у обследованных мужчин была < 7. При этом у 77,4% пациентов в простате регистрировали гиповаскулярные и аваскулярный участки, являющиеся УЗ-признаками ишемии и в последующем служащие, возможно, инициатором клинической манифистации СНМП. Также, у 29,0% мужчин, помимо снижения уровня Тс, регистрировали снижение других составляющих гормонального статуса, которые являются важными звеньями функционирования мочевых путей и репродуктивных органов.
Заключение
У мужчин, длительно применяющих ПТ в немедицинских целях, развивается вторичный гипогонадизм, сопровождающийся нежелательными явлениями со стороны мочевыводящих путей и органов репродуктивной системы. Одним из нежелательных явлений, ухудшающим качество жизни мужчин после отмены приёма ПТ, являются СНМП, которые в большинстве случаев носят ирритативный характер и, как правило, обусловлены развитием гиповаскулярных и аваскулярных изменений в транзиторной и центральной зонах предстательной железы, что необходимо учитывать при назначении терапии. Кроме того, в отношении данных пациентов должна разрабатываться система лечебных мер, носящая междисциплинарный характер.
Список литературы
1. Wu FC, Tajar A, Pye SR, Silman AJ, Finn JD, O'Neill TW, Bartfai G, Casanueva F, Forti G, Giwercman A, Huhtaniemi IT, Kula K, Punab M, Boonen S, Vanderschueren D; European Male Aging Study Group. Hypothalamic-pituitary-testicular axis disruptions in older men are differentially linked to age and modifiable risk factors: the European Male Aging Study. J Clin Endocrinol Metab. 2008;93(7):2737-45. https://doi.org/10.1210/jc.2007-1972
2. Коган М.И., Воробьев С.В., Хрипун И.А., Белоусов И.И., Ибишев Х.С. Тестостерон: от сексуальности к метаболическому контролю. Ростов-на-Дону: Феникс; 2017.
3. Гусова З.Р., Дзантиева Е.О. Роль висцерального ожирения и дефицита тестостерона в формировании метаболических нарушений у мужчин. Вестник урологии. 2019;7(3):14-22.
4. Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А., Проценко А.А., Шишонкова Н.С. Эректильная дисфункция как следствие психологических и соматических заболеваний у мужчин разных возрастных групп. Тенденции развития науки и образования. 2020;61(1) 44-47.
5. Мехтиев Т.В., Мамедов М.Н. Лечение возрастного андрогенного дефицита у больных сахарным диабетом 2 типа. Курортная медицина. 2015;2;122-6.
6. Хрипун И.А., Воробьев С.В., Моргунов М.Н., Белоусов И.И., Дзантиева Е.О., Гусова З.Р., Ибишев Х.С., Коган М.И. Генетические аспекты формирования нарушения функции эндотелия у больных сахарным диабетом 2 типа. Медицинский вестник Северного Кавказа. 2015;10(4):339-43.
7. Коган М.И., Ибишев Х.С. Вторичный гипогонадизм у больных с повреждением мочеиспускательного канала. Consilium Medicum. 2007;9(4):50-54.
8. Ибишев Х.С., Прокоп Я.О. Новая коронавирусная инфекция: возможно ли влияние на репродуктивное здоровье мужчин? Вестник урологии. 2022;10(1):128-134.
9. Isidori AM, Lenzi A. Risk factors for androgen decline in older males: lifestyle, chronic diseases and drugs. J. Endocrinol Invest. 2005;28(3):14-22. PMID: 16042355
10. Robertson C, Link CL, Onel E, Mazzetta C, Keech M, Hobbs R, Fourcade R, Kiemeney L, Lee C, Boyle P, McKinlay JB. The impact of lower urinary tract symptoms and comorbidities on quality of life: the BACH and UREPIK studies. BJU Int. 2007 Feb;99(2):347-54. https://doi.org/10.1111/j.1464-410X.2007.06609.x
11. Ибишев Х.С., Волкова Н.И., Гусова З.Р., Евсеев П.А., Шарбабчиев В.А., Коган М.И. Нежелательные явления со стороны мочеполовых органов у мужчин, использовавших препараты тестостерона анаболические стероиды в немедицинских целях. Урология. 2022;(3):92-97.
12. Brower KJ. Anabolic steroid abuse and dependence in clinical practice. Phys Sportsmed. 2009;37(4):131-40. https://doi.org/10.3810/psm.2009.12.1751
13. Тюзиков И.А. Патогенетические механизмы влияния дефицита тестостерона на симптомы нижних мочевых путей у мужчин. Эффективная фармакотерапия. 2020;16(20):32-42.
14. Лихоносов Н.П., Бабенко А.Ю., Макарьин В.А., Федотов Ю.Н. Особенности восстановления системы гипофиз-гонады у мужчин после использования андрогенных анаболических стероидов. Проблемы Эндокринологии. 2020;66(1):104-12.
15. Hotta Y, Kataoka T, Kimura K. Testosterone Deficiency and Endothelial Dysfunction: Nitric Oxide, Asymmetric Dimethylarginine, and Endothelial Progenitor Cells. Sex Med Rev. 2019;7(4):661-8. https://doi.org/10.1016/j.sxmr.2019.02.005
16. Traish AM, Johansen V. Impact of Testosterone Deficiency and Testosterone Therapy on Lower Urinary Tract Symptoms in Men with Metabolic Syndrome. World J Mens Health. 2018;36(3):199-222. https://doi.org/10.5534/wjmh.180032
17. Дударев В.А., Старцев В.Ю., Бакшеева Е.Г. Клиническая оценка использования опросников симптомов нижних мочевых путей у мужчин. Вестник урологии. 2020;8(4):23-31.
18. Yassin AA, El-Sakka AI, Saad F, Gooren LJ. Lower urinary-tract symptoms and testosterone in elderly men. World J Urol. 2008;26(4):359-64. https://doi.org/10.1007/s00345-008-0284-x
Об авторах
Х. С. ИбишевРоссия
Халид Сулейманович Ибишев — доктор медицинских наук, доцент; профессор кафедры урологии и репродуктивного здоровья человека (с курсом детской урологииандрологии)
344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29
В. А. Шарбабчиев
Россия
Владислав Андреевич Шарбабчиев — врач уролог
356240, Россия, г. Михайловск, ул. Ленина, д. 1
А. И. Палёный
Россия
Андрей Иванович Палёный — ассистент кафедры ультразвуковой диагностики
344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29
М.-Х. М. Ужахов
Россия
Магомед-Хаджи Магомедович Ужахов — аспирант кафедры урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии)
344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29
А. Д. Межидова
Россия
Анита Джамалайловна Межидова — врач ультразвуковой диагностики
344023, Россия, г. Ростов-на-Дону, ул. Пешкова, д. 34
Рецензия
Для цитирования:
Ибишев Х.С., Шарбабчиев В.А., Палёный А.И., Ужахов М.М., Межидова А.Д. Симптомы нижних мочевых путей как следствие отмены препаратов тестостерона, длительно применявшихся в немедицинских целях. Вестник урологии. 2022;10(3):5-12. https://doi.org/10.21886/2308-6424-2022-10-3-05-12
For citation:
Ibishev Kh.S., Sharbabchiev V.A., Paleny A.I., Uzhakhov M.M., Mezhidova A.D. Lower urinary tract symptoms following discontinuation of long-term non-medical use of testosterone preparations. Urology Herald. 2022;10(3):5-12. (In Russ.) https://doi.org/10.21886/2308-6424-2022-10-3-05-12













































