Перейти к:
Паллиативная цистэктомия. Есть ли место в хирургии рака мочевого пузыря?
https://doi.org/10.21886/2308-6424-2020-8-3-18-29
Аннотация
Введение. Пациенты с диагнозом рак мочевого пузыря (РМП) Т4Ь представляют собой относительно ограниченную группу пациентов, обращающихся в урологическую клинику. Кроме того, эта категория пациентов редко выбирается для цистэктомии. Фактически, пациенты с T4b должны быть направлены на химиотерапию и/или лучевую терапию и только позднее, в конечном итоге, на цистэктомию. Однако в настоящее время нет никаких исследований о реальном влиянии различных инвазий органов с точки зрения выживаемости и осложнений, связанных с хирургическим вмешательством у пациентов cT4b. Кроме того, в данной подгруппе пациентов, цистэктомия, помогает смягчить текущие или будущие симптомы РМп и предполагается, что операция после химиотерапии может улучшить выживаемость по сравнению только с химиотерапией.
Цель исследования. Оценить эффективность консолидирующей хирургии при раке мочевого пузыря cT4b, учитывая опыт цистэктомии с точки зрения клинических и онкологических результатов.
Материалы и методы. В исследование включено 29 пациентов с РМп, подвергнутых паллиативной цистэктомии (пЦ) и 404 больных после радикальной цистэктомии (РЦЭ) с лимфаденэктомией и различными методами деривации мочи в период 1995 - 2019 года Паллиативность лечения определялась крайними стадиями развития онкологического процесса (наличие стадии Т4Ь).
Результаты. Дооперационно планировалось выполнение ПЦ только у 10 пациентов, тогда как после проведения РЦЭ она носила паллиативный характер в 29 случаях. По данным нашего исследования различия в основных результатах лечения оказались не в пользу пациентов с ПЦ. За период наблюдения подавляющая часть пациентов — 24 из 29 (82,8%) — умерли, тогда как в группе после РЦЭ умерли только 34,0% пациентов (р <0,05. Различий в уровне послеоперационной летальности не было выявлено (р >0,05): в обоих случаях (3,4% и 3,0%) она была сопоставима с данными современной литературы. Это в определенной мере отражает равную степень безопасности выполнения цистэктомии у пациентов с РМП в стадии T4b в сравнении с больными подвергнутыми РЦЭ. Продолжительность наблюдения выживших в группе с ПЦ колеблется от 3 до 51 месяцев с медианой в 25,7 ± 13,9 против 73,9 ± 3,9 месяцев в группе РЦЭ у выживших пациентов (р <0,05). Однако из анализа выявлено, что через 2 года в группе пациентов, перенёсших ПЦ, остается более 15% выживших, что может свидетельствовать о возможности применения данного вида лечения у больных с последний стадией РМП.
Заключение. Паллиативная цистэктомия может быть эффективной в избранной группе пациентов с РМП T4b с одинаковой безопасностью ее выполнения в сравнении с РЦЭ при сохранении вероятности продолжительности жизни до 48 месяцев. Важно разработать и внедрить в практическую деятельность новые протоколы мультимодальной терапии для пациентов с РМП pT4b с целью увеличения продолжительности жизни больных и улучшения ее качества.
Ключевые слова
Для цитирования:
Васильев О.Н., Перепечай В.А., Коган М.И., Рыжкин А.В. Паллиативная цистэктомия. Есть ли место в хирургии рака мочевого пузыря? Вестник урологии. 2020;8(3):18-29. https://doi.org/10.21886/2308-6424-2020-8-3-18-29
For citation:
Vasilyev O.N., Perepechay V.A., Kogan M.I., Ryzhkin A.V. Palliative cystectomy. Is there a place in bladder cancer surgery? Urology Herald. 2020;8(3):18-29. (In Russ.) https://doi.org/10.21886/2308-6424-2020-8-3-18-29
Введение
Радикальная цистэктомия является основой лечения инвазивного рака мочевого пузыря (РМП) и часто сочетается с многоагентной химиотерапией при резектабельных заболеваниях высокого риска для улучшения результатов терапии пациентов. Состояние, которое считается неоперабельным, обычно лечится химиотерапией, а хирургическое удаление не проводится, поскольку полагают, что заболевание неизлечимо. Стадия T4b считается неоперабельной, поскольку опухоль распространяется на брюшную / тазовую стенку или в соседние органы, кроме тех, которые поддаются резекции во время радикальной цистэктомии (cT4a; предстательная железа, влагалище или матка) [1][2]. Однако, к сожалению, повышение и понижение стадии при диагностике не редкость (диапазон 27 - 62%) и это несоответствие между клинической и патологической стадией вызвано отчасти с неточностью радиологических инструментов и представляет собой один из наиболее важных барьеров на пути улучшения стратегии лечения больных из данной когорты [3][4].
В целом, пациенты с диагнозом Т4 РМП представляют собой относительно ограниченную группу пациентов, обращающихся в урологическую клинику. Кроме того, эта категория пациентов редко выбирается для цистэктомии. Фактически, в соответствии с рекомендациями NCCN и EAU, только пациенты с T4a должны рассматриваться для хирургического подхода, в то время как пациенты с T4b должны быть направлены на химиотерапию и/или лучевую терапию и только позднее, в конечном итоге, на цистэктомию. В настоящее время нет никаких исследований о реальном влиянии различных инвазий органов с точки зрения выживаемости и осложнений, связанных с хирургическим вмешательством у пациентов c T4. Кроме того, в данной подгруппе пациентов, цистэктомия, помогает смягчить текущие или будущие симптомы РМП. Другие предполагают, что операция после химиотерапии может улучшить выживаемость по сравнению только с химиотерапией. Так пациенты, которым была сделана полная резекция жизнеспособной опухоли во время операции после химиотерапии, достигли медианной выживаемости 25 месяцев, а некоторые выжили 5 лет [5][6][7][8][9][10][11][12][13].
Сегодня до сих пор 10 - 15% пациентов с РМП имеют метастатические поражения [14][15]. Как правило, у этих пациентов плохие долговременные перспективы, а лечение носит в основном паллиативный характер. Пациенты с болезнью pT4 имеют 25 - 33% 5-летнюю общую выживаемость после радикальной цистэктомии. Естественный анамнез pT4 РМП остается плохо описанным из-за относительно ограниченного числа пациентов с этой стадией заболевания [16][17][18].
Чтобы избежать хирургического вмешательства или улучшить работоспособность и / или послеоперационный клинический результат у пациентов с Т4, подходы к лечению включают консервативные мультимодальные стратегии, а также неоадъювантную химиотерапию отдельно или в сочетании с лучевой терапией. Тем не менее, у пациентов с раком мочевого пузыря, интенсивно растущим в эндопельвиальной области, консервативное лечение редко гарантирует достаточный контроль первичной опухоли. Когда цистэктомия спасения становится необходимой из-за серьезных осложнений, которые являются результатом неконтролируемой локальной ситуации, эта процедура, вероятно, будет связана с повышенной заболеваемостью и значительным ухудшением клинического исхода. Напротив, когда ответ на химиотерапию во время неоадъювантной концепции недостаточен, дальнейший рост опухоли может помешать работоспособности первичной опухоли. Кроме того, системное химиотерапевтическое лечение до операции способно повысить смертность, связанную с цистэктомией [14][15][16][17][18][19][20][21].
Стоит отметить, что за последние три десятилетия не было достигнуто значительных успехов, но новые достижения, такие как иммунотерапия и таргетная терапия, обещают в будущем значительно изменить на статус-кво. Чтобы понять, как лучше всего помочь пациентам сегодня, и оценить возможные взаимосвязи между сегодняшними и завтрашними терапиями, необходим хорошо продуманный анализ наших текущих знаний о естественной истории этого болезненного состояния, доступных стратегий лечения и возможных терапевтических методов, альтернативы для этой группы пациентов [18][19][22][23]. В частности, остаются вопросы относительно долгосрочной выживаемости и выбора случаев для хирургического вмешательства.
Цель исследования: оценить эффективность консолидирующей хирургии при раке мочевого пузыря cT4b, учитывая опыт цистэктомии с точки зрения клинических и онкологических результатов.
Материалы и методы
В исследование включено 29 пациентов с РМП, подвергнутых паллиативной цистэктомии (ПЦ) и 404 больных после радикальной цистэктомии (РЦЭ) с лимфаденэктомией и различными методами деривации мочи в период 1995 - 2019 года. Ни один больной не получал неоадъювантную химиотерапию. Ведущими показателями, которые определяли паллиативность лечения были крайние стадии развития онкологического процесса (наличие стадии Т4b), распространённость поражения лимфоузлов (N3), наличие метастазов (M1) и низко- и недифференцированные по гистологической структуре опухоли (G3-4), как наиболее агрессивные формы переходно-клеточного рака. Пациентам стадию T4b устанавливали в соответствии с классификацией TNMG, при наличии фиксированной и неподвижной опухоли при бимануальном исследовании под наркозом и/или при определении прямой инвазии в соседние органы (за исключением предстательной железы, влагалища и матки) по данным СКТ/МРТ малого таза. Всем больным пЦ выполнили одной хирургической бригадой. Для морфологической оценки удаленные образцы обрабатывали в соответствии со стандартами патологических исследований макропрепаратов, которые анализировали штатные патологами. Окончательная патологическая стадия определялась как наибольшая из предоперационных клинических и патологических стадий, положительный хирургический край расценивали как наличие опухолевых клеток в краях резекции удаленного органокомплекса.
Представленная группа больных оперировалась в те годы, когда эффективность неоадъювантной химиотерапии не была доказана, а участи больных она была противопоказана в связи с имеющейся коморбидностью. Адъювантная химиотерапия проведена у 18 больных, в остальных случаях не проводилась ввиду также имеющейся коморбидности.
Последующее наблюдение пациентов после пЦ проводили в соответствии с институциональными протоколами: как правило пациенты наблюдались каждые 3 - 4 месяца в течение 1 года, каждые полгода в течение 2 года и ежегодно после этого. Визиты состояли из физического осмотра, лабораторных анализов, включая печеночные тесты и щелочную фосфатазу, СКТ грудной клетки и ультразвуковое исследование почек, сКТ-исследование брюшной полости и таза с контрастированием проводили ежегодно. Дополнительную рентгенологическую оценку, такую как сканирование костной системы, выполняли по показаниям.
Клинические исходы оценивали от даты операции до даты смерти или последнего наблюдения. причину смерти больных определяли по результатам наблюдения как смерть в результате прогрессии заболевания (наличие местного рецидива или отдаленных метастазов опухоли) или смерть от других причин, не связанных с РМп.
Статистический анализ был проведён при помощи программы Statistics 7.0. Различия в распределениях вариант наблюдения по нескольким градациям признаков оценивали по критерию Фишера и «Хи-квадрат», используя абсолютные значения частот, в модуле непараметрической статистики. Кроме того, сравнение альтернативных показателей, представленных в виде процентов, проводили по критерию t стьюдента — с помощью дифференцировочного теста в модуле описательной статистики. Расчет показателей выживаемости по годам наблюдения выполняли по методике Kaplan-Meier с учётом последовательного выбывания из анализа больных, ушедших из-под наблюдения или прошедших лишь частичный срок наблюдения в рамках общего срока исследования. Кривые функции общей выживаемости пациентов после пЦ и остальных больных РМп рассчитывали по 5 критериям: Гехана-Вилкоксона, F-критерию Кокса, Кокса-Ментела, Вилкоксона-пето, Лог-ранговому критерию. Во всех случаях сравнения результаты различий считали статистически достоверными при вероятности ошибки менее 5% (р <0,05).
Результаты
Все больные, которым выполнена пЦ были мужчинами со средним возрастом 58,7 ± 1,7 лет (LQ: 26, UQ: 74), при этом достоверных отличий от группы пациентов подвергнутых радикальной цистэктомии выявлено не было (59,5 ± 0,5 лет; р >0,05). показатели по критериям TNMG у пациентов с РМп, полученные до и после ПЦ показаны в таблице.
Ранжирование показателей TNMG среди 29 больных показывает, что только у 10 пациентов до операции была выявлена стадия Т4b. при подробном анализе среди этих больных у 2 выявлены метастазы (М1), у 6 человек - поражённость ЛУ, в стадии N2 — у 2 и N3 — у 4 пациентов соответственно, а также G3 — у 6 и G4 — у 1 из этих 10 больных.
Кроме того, определены значительные различия в степени выраженности базовых показателей развития онкопроцесса по данным «до» и «после» выполнения ПЦ — в сторону повышения стадии заболевания по большинству критериев после патоморфологического исследования. Например, по критерию Т после ПЦ выявлено значительно меньше (в 4 раза) пациентов с РМп в стадии ТЗb, зато вдвое увеличилась доля лиц со стадией — Т4b (р <0,05). при этом в 3,5 раза (р <0,05) возросло количество пациентов с регионарным поражением лимфатических узлов (стадия N3) и определено значительно большее число больных с низко- и недифференцированными опухолями — 89,7% против 67,0% соответственно. Распределение пациентов по критерию М не изменилось: только у 10 из них (у 34,5%) подтвердилось наличие метастазов и после пЦ. В целом же, распределения этой группы пациентов по 3 основным критериальным характеристикам РМп после ПЦ оказались более тяжёлыми, чем они представлялись до операции: по критерию Т (Хи-квадрат = 18,82, р = 0,00081), по критерию N (Хи-квадрат = 14,09, р = 0,00087) и критерию G (Хи-квадрат = 14,22, р = 0,00082), что подтверждало обоснованность выбора для этого контингента пациентов паллиативной тактики выполнения цистэктомии. Однако, вероятно, не только характеристики развития опухолевого процесса влияют на определение выбора паллиативного вида операции. Таким образом дооперационно планировалось выполнение пЦ только у 10 пациентов, тогда как после проведения РЦЭ она носила паллиативный характер в 29 случаях.
Таблица. Показатели пациентов по критериям TNMG
Table. Indicators according to TNMG criteria in patients

Примечание: ПЦ - паллиативная цистэктомия
Note: PC — palliative cystectomy
Помимо более «тяжёлых» характеристик течения РМп больные, которым выполнялась ПЦ, достоверно отличались от остальных пациентов с проведенной РЦЭ по продолжительности периода от момента постановки диагноза РМп до даты операции (38,7 против 17,4 месяцев), по среднему числу циклов лучевой терапии (24,1 против 10,1) и по среднему числу проведенных этим больным резекций Мп до РЦ (69,0 против 24,5) на 100 больных. Также у больных с пЦ втрое чаще выполнялась эпицистостомия (24,1% против 7,7%), операции на брюшной полости и малом тазу (106,9 против 46,3 операций на 100 больных), а общее количество оперативных вмешательств до выполнения цистэктомии было вдвое больше в подгруппе пЦ (158,6 против 76,0 операций на 100 больных), чем в остальной группе больных (р <0,05). В подгруппе пц достоверно чаще диагностировалась анемия (у 79,3% против 41,3%) при достоверно более низких средних уровнях гемоглобина, как следствие мочепузырного кровотечения, выявлялся одно- и двухсторонний гидронефроз, поражение опухолевым процессом шейки МП и простатического отдела уретры, а также более часто отмечалось развитие микроциста, что также свидетельствует о глубокой инвазии опухоли и прогрессировании онкологического процесса у исследуемых пациентов.
Важно подчеркнуть, что сопоставление коэффициентов дооперационной коморбидности пациентов подвергнутых ПЦ и РЦЭ по симптомам Чарлсона и Чарлсона-скорректированного на возраст не выявляло достоверных различий, при этом число всех дооперационных хирургических вмешательств, урологических осложнений и уровень анемии, сопутствующих хронических заболеваний в анамнезе, были достоверно выше у больных с пц: 10,9 ± 0,9 против 7,6 ± 0,2 случая на 1 больного в группе РЦЭ (р <0,05). Все это подтверждает «тяжесть» больных из подгруппы ПЦ не только по основным онкологическим характеристикам РМп, но и по своему общему состоянию, также побуждающего хирурга выбирать тактику выполнения пЦ.
Онкологический статус и общее состояние пациентов вынуждали хирурга после пЦ выполнять наружные способы уродеривации: 24 из 29 (82,8%) пациентов; в группе пациентов с РЦЭ этот способ применяли значительно реже - у 153 из 404 пациентов, т.е. в 37,8% (р <0,05). при этом в 12 (41,4%) случаях выполняли чрескожную пункционную нефростомию (ЧПНс), в 11 (37,9%) — уретерокутанеостомию и в 1 случае (3,4%) — операцию по Bricker. Из других 5 пациентов в 3 случаях (10,3%) выполнена ортотопическая деривация мочи (2 операции по Studer и 1 инвертированная илеоцистопластика), у 1 пациента сформирован гетеротопический резервуар (Kock pouch в модификации) и ещё у одного — применён способ внутренней деривации мочи (Mainz pouch II).
По данным нашего исследования различия в основных результатах лечения оказались не в пользу пациентов с ПЦ, что представлялось вполне ожидаемым. Так, за период наблюдения подавляющая часть пациентов — 24 из 29 (82,8%) — умерли, тогда как в группе после РЦЭ умерли только 34,0% пациентов (р <0,05); соответственно, выживших оказалось в 5 раз меньше — только 10,3% против 50,4% в группе сравнения (р <0,05). Различий в уровне послеоперационной летальности не было выявлено (р >0,05): в обоих случаях (3,4% и 3,0%) она была сопоставима с данными современной литературы. Это в определенной мере отражает равную степень безопасности выполнения цистэктомии у пациентов с РМп в стадии T4b в сравнении с больными подвергнутыми радикальной цистэктомии.
Основная причина смерти у пациентов после ПЦ — в 22 случаях из 24 (91,7%) — канцерспецифическая, т.е. из-за продолженного роста опухоли и ее прогрессии; 1 пациент из этой группы умер от острого инфаркта миокарда и ещё 1 — от хронической почечной недостаточности в терминальной стадии, среди пациентов с РЦЭ канцерспецифическая причина смерти определялась у 77 из137 умерших (56,2%) пациентов, что с высокой вероятностью (р = 0,0003) указывает на значимость стадии РМп в исходе лечения пациентов с пЦ.
Общая средняя продолжительность наблюдаемого периода жизни в группе пациентов с пЦ была в 3,5 раза ниже средней продолжительности жизни больных в группе РЦЭ (15,7 против 53,0 месяцев), а средняя продолжительность жизни умерших пациентов - меньше в 2 раза (14,1 против 29,8 месяцев; все р <0,05). продолжительность наблюдения выживших в группе с пЦ колеблется от 3 до 51 месяцев с медианой в 25,7 ± 13,9 против 73,9 ± 3,9 месяцев в группе РЦЭ у выживших пациентов (р <0,05).
На рисунке 1 представлена общая выживаемость больных после ПЦ в сравнении с группой больных после РЦЭ.
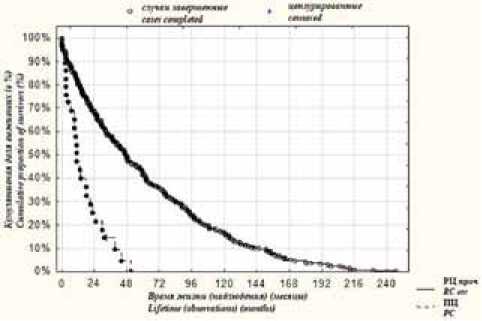
Рисунок 1. Общая выживаемость пациентов после паллиативной и радикальной цистэктомии
Figure 1. Overall survival in patients with bladder cancer after PC and RCE
Общий период наблюдений за пациентами, перенесшими ПЦ, практически завершается 4 годами (несколько больше 48 месяцев), тогда как в группе пациентов с другими видами РЦ после 4 лет еще остается не менее 50 % выживших. В целом, достоверность различий в кривых функции общей выживаемости пациентов после ПЦ и больных после РЦЭ подтверждается по всем 5 критериям (Гехана-Вилкоксона, F-критерию Кокса, Кокса-Ментела, Вилкоксона-пето, Логранговому критерию) с вероятностью ошибки от р = 0,00001 до р = 0,00009.
Анализируя график функции канцерспецифической выживаемости больных РМп после ПЦ, можно отметить его сходство с графиком общей выживаемости больных этой группы и общее завершение периода наблюдений (времени жизни) этой группы к 4 годам (рис. 2).

Рисунок 2. Канцерспецифическая выживаемость пациентов после паллиативной и радикальной цистэктомии
Figure 2. Cancer-specific survival in patients after PC and RCE
Однако из анализа графика на рисунке 2 видно, что через 2 года (24 месяца) в группе пациентов, перенесших ПЦ, остается более 15% выживших, что может свидетельствовать о возможности применения данного вида лечения у больных с последний стадией РМп.
Структура отдалённого метастазирования и продолженного роста опухоли представлена на рисунке 3.

Рисунок 3. Структура отдаленного метастазирования и продолженного роста опухоли у пациентов, перенёсших паллиативную цистэктомию
Figure 3. The structure of distant metastasis and continued tumour growth in patients undergoing PC
Анализ показывает, что наиболее частыми случаями рецидивов у пациентов, перенесших ПЦ, был продолженный рост опухоли (1/5 всех случаев). В 14,5% случаев отмечены исходные метастазы в легких. У 12,7% пациентов имели место метастазы в отдаленных лимфоузлах и метастазы в печень. Еще в 9,1% выявлены метастазы в кости, 3 случая метастазов в регионарные лимфоузлы, и по 1 случаю - метастазов в уретру и в головной мозг. Наибольшее количество в процентном отношении составил продолженный рост опухоли — 29,1% случаев.
Все выше описанное отражает тенденции развития патологического процесса в поздних стадиях РМП и вполне сопоставимо с данными литературы: самая низкая выживаемость, самая высокая смертность, самая высокая частота рецидивов у пациентов с РМП в поздних стадиях.
Обсуждение
Несмотря на большой объём современной литературы по результатам радикальной цистэктомии, имеются только ограниченные данные о пациентах с РМп pT4b, частично из-за ограниченного числа пациентов подвергнутых паллиативной цистэктомии с этой патологической стадией и предполагаемой прогностической однородностью этой подгруппы, при этом цистэктомия обычно не рассматривается большинством практикующих урологов для пациентов с опухолями cT4b. Мы применили агрессивный подход к лечению таких пациентов путем выполнения паллиативной цистэктомии без предоперационной химиотерапии и наши результаты демонстрируют, что у некоторых из пациентов может быть достигнут устойчивый ответ до 48 месяцев.
Пациенты с pT4b, у которых была лимфоваскулярная инвазия и/или метастатическое поражение регионарных лимфатических узлов, имели значительно худшую выживаемость, чем те, у кого определялась стадия N0, что соответствует полученным результатам нашего исследования. Таким образом, в запущенных случаях заболевания метастатический потенциал связан с худшим исходом [24]. Помимо диссеминации опухолевых клеток, местный контроль заболевания в виде возможности полной резекции является важным предиктором выживаемости у пациентов с РМП рТ4. Положительный край в случаях pT4b является вторичным по отношению к хирургической технике, патологической оценке удаленных образцов или степени опухоли. Хотя первая из этих причин может быть изменена, последняя иногда является неизбежной, поскольку резекция за пределами определенного уровня может привести к развитию недопустимых осложнений и/или смертности. Как мы и ожидали, в нашем исследовании у пациентов в подгруппе с pT4b была значительно хуже выживаемость, чем у больных подвергнутых РЦЭ что также коррелирует с данными зарубежных исследований [24]. Неудивительно, что наличие патологического узлового метастазирования и наличие положительных хирургических краев предсказывали плохую выживаемость в этой группе пациентов. Оба этих фактора продемонстрировали высокую степень прогнозирования в других исследованиях [2][6][25].
Наши результаты показывают, что хирургическая экстирпация может быть эффективной в избранной группе пациентов с cT4b уротелиальным раком мочевого пузыря, что соотносится с данными полученными P.C. Black et al. [26].
Следует подчеркнуть, что пациенты, о которых мы сообщаем, являются селективной группой. Не все пациенты с клиническим раком мочевого пузыря T4b будут кандидатами на цистэктомию. Кроме того, мы рассматривали только тех пациентов, которые были подвергнуты только цистэктомии, причем в ряде случаев для смягчения местных симптомов, тогда как ряд авторов показывают устойчивые результаты до 60% в течение 5 лет при комбинированной терапии (неоадъювантная химиотерапия + цистэктомия) [27]. Таким образом мы не можем оценить, какая доля наших пациентов с карциномой мочевого пузыря cT4b, ответила бы адекватно на предоперационную химиотерапию, чтобы обеспечить улучшение хирургических результатов путем понижения патологической стадии Т. Так в серии зарубежных исследований пациенты с понижением стадии рака имели долгосрочную выживаемость, несмотря на наличие заболевания cT4b. Это перекликается с результатами исследований, оценивающих неоадъювантную химиотерапию при резектабельном заболевании [1][2], а также аналогично отчетам по хирургии после химиотерапии [27].
Кроме того, в международных исследованиях больных с прогрессирующей карциномой мочевого пузыря, получавших химиотерапию в стадии cT4b без регионарного или отдаленного метастазирования показано, что часть этих пациентов подверглась ПЦ с медианой выживаемости 13,4 месяцев, что сопоставимо с нашими данными. Так, медиана выживаемости больных нашего центра составила 15,7 месяцев без применения неоадъювантной химиотерапии [28]. Примечательно, что в исследовании H.W. Herr et al. сообщили о 10 пациентах с полным ответом на химиотерапию, но которые отказались от операции, и в результате только 1 из них прожил до 3 лет (8%) [25].
Кроме того, клиническая эффективность мультимодальной стратегии сохранения мочевого пузыря для управления мышечно-инвазивным раком мочевого пузыря неоднократно описывалась для аппроксимации радикальной цистэктомии. Хотя этот подход может быть приемлемым вариантом для отдельных пациентов с инвазивным раком мочевого пузыря [29][30][31][32], было показано, что он вызывает тяжелые местные осложнения со значительным отрицательным влиянием на качество жизни в не отобранных группах пациентов [33][34][35]. Дополнительные аргументы, которые ставят под сомнение ценность такого подхода, включают увеличение смертности и морбидности после химиотерапии, а цистэктомия становится необходимой в случае развития серьезных локальных осложнений из-за недостаточного контроля опухоли [34]. Безрецидивная, а также долгосрочная выживаемость были значительно дольше в группе с применением ПЦ [33].
При достаточном локальном контроле опухоли, достигнутом с помощью цистэктомии, 50% пациентов выживают после наблюдения 20 (6 - 36) месяцев [37], что сопоставимо с данными, полученными в нашем исследовании.
Таким образом, хотя мы определили особенности, которые помогают стратифицировать прогноз у пациентов подвергнутых паллиативной цистэктомии, мы не рекомендуем отказываться от адъювантной химио- или иммунотерапии ни у одного пациента с РМП pT4b. Однако мы не можем сделать выводы о влиянии оптимизированной адъювантной терапии на этих пациентов ввиду необходимости проведения крупных проспективных исследований.
Заключение
Исследования позволяют считать, что прогноз у пациентов с РМП pT4b, как правило, плохой, особенно у пациентов с особенностями диссеминации опухолевых клеток (например, исходного отдаленного метастазирования или метастазирования в лимфатические узлы и лимфоваскулярной инвазии) и/или неэффективным локальным контролем рака.
Наши результаты свидетельствуют о том, что паллиативная цистэктомия может быть эффективной в избранной группе пациентов с РМП pT4b с одинаковой безопасностью её выполнения в сравнении с РЦЭ при сохранении вероятности продолжительности жизни до 48 месяцев.
В части случаев радикальная цистэктомия носит в итоге паллиативный характер в послеоперационном периоде, что связано с неточностью стадирования процесса до выполнения РЦЭ.
Важно разработать и внедрить в практическую деятельность новые протоколы мультимодальной терапии для пациентов с РМП pT4b с целью увеличения продолжительности жизни больных и улучшения её качества.
Список литературы
1. Grossman HB, Natale RB, Tangen CM, Speights VO, Vogelzang NJ, Trump DL, deVere White RW, Sarosdy MF, Wood Dp Jr, Raghavan D, crawford ED. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med. 2003;349(9):859-866. DOI: 10.1056/NEJMoa022148
2. Millikan R, Dinney C, Swanson D, Sweeney P, Ro JY, Smith TL, Williams D, Logothetis C. Integrated therapy for locally advanced bladder cancer: final report of a randomized trial of cystectomy plus adjuvant M-VAC versus cystectomy with both preoperative and postoperative M-VAC. J Clin Oncol. 2001;19(20):4005-4013. DOI: 10.1200/JCO.2001.19.20.4005
3. Shariat SF, Palapattu GS, Karakiewicz PI, Rogers CG, Vazina A, Bastian PJ, Schoenberg MP, Lerner SP, Sagalowsky AI, Lotan Y. Discrepancy between clinical and pathologic stage: impact on prognosis after radical cystectomy. Eur Urol. 2007;51(1):137-149; discussion 149-151. DOI: 10.1016/j.eururo.2006.05.021
4. Zehnder P, Studer UE, Daneshmand S, Birkhauser FD, Skinner EC, Roth B, Miranda G, Burkhard FC, Cai J, Skinner DG, Thalmann GN, Gill IS. Outcomes of radical cystectomy with extended lymphadenectomy alone in patients with lymph node-positive bladder cancer who are unfit for or who decline adjuvant chemotherapy. BJUInt. 2014;113(4):554-560. DOI: 10.1111/bju.12520
5. Dimopoulos MA, Finn L, Logothetis CJ. Pattern of failure and survival of patients with metastatic urothelial tumors relapsing after cisplatinum-based chemotherapy. J Urol. 1994;151(3):598-600; discussion 600-601. DOI: 10.1016/s0022-5347(17)35025-5
6. Herr HW, Donat SM, Bajorin DF. Post-chemotherapy surgery in patients with unresectable or regionally metastatic bladder cancer. J Urol. 2001;165(3):811-814. PMID: 11176475
7. Васильев О.Н., Коган М.И., Перепечай В.А. Онкологические результаты первичной, спасительной и паллиативной цистэктомии при раке мочевого пузыря. Вестник урологии. 2017;5(1):12-19. DOI: 10.21886/2308-6424-2017-5-1-12-19
8. Sternberg CN, Yagoda A, Scher HI, Watson RC, Geller N, Herr HW, Morse MJ, Sogani PC, Vaughan ED, Bander N, et al. Methotrexate, vinblastine, doxorubicin, and cisplatin for advanced transitional cell carcinoma of the urothelium. Efficacy and patterns of response and relapse. Cancer. 1989;64(12):2448-2458. DOI: 10.1002/1097-0142(19891215)64:12<2448::aid-cncr2820641209>3.0.co;2-7
9. Васильев О.Н., Перепечай В.А., Рыжкин А.В. Ранние и поздние послеоперационные осложнения после радикальной цистэктомии при раке мочевого пузыря. Вестник урологии. 2019;7(2):24-50. DOI: 10.21886/2308-6424-2019-7-2-24-50
10. Loehrer PJ Sr, Einhorn LH, Elson PJ, Crawford ED, Kuebler P, Tannock I, Raghavan D, Stuart-Harris R, Sarosdy MF, Lowe BA, et al. A randomized comparison of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with metastatic urothelial carcinoma: a cooperative group study. J Clin Oncol. 1992;10(7):1066-1073. DOI: 10.1200/JCO.1992.10.7.1066
11. Saxman SB, Propert KJ, Einhorn LH, Crawford ED, Tannock I, Raghavan D, Loehrer PJ Sr, Trump D. Long-term follow-up of a phase III intergroup study of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with metastatic urothelial carcinoma: a cooperative group study. J Clin Oncol. 1997;15(7):2564-2569. DOI: 10.1200/JCO.1997.15.7.2564
12. Bajorin DF, Dodd PM, Mazumdar M, Fazzari M, McCaffrey JA, Scher HI, Herr H, Higgins G, Boyle MG. Long-term survival in metastatic transitional-cell carcinoma and prognostic factors predicting outcome of therapy. J Clin Oncol. 1999;17(10):3173-3181. DOI: 10.1200/JcO.1999.17.10.3173
13. Перепечай А.В., Васильев О.Н., Спицын И.М., Коган M. И. предикторы морбидности радикальной цистэкто-мии и различных вариантов уродеривации: 20-летний опыт одного хирургического центра. Онкоурология. 2016;12(1):42-57. DOI: 10.17650/1726-9776-2016-12-1-42-57
14. Yafi Fa, Aprikian Ag, Chin JL, Fradet Y, Izawa J, Estey E, Fairey A, Rendon R, cagiannos I, Lacombe L, Lattouf JB, Bell D, Drachenberg D, Kassouf W. contemporary outcomes of 2287 patients with bladder cancer who were treated with radical cystectomy: a canadian multicentre experience. BJU Int. 2011;108(4):539-545. DOI: 10.1111/j.1464-410X.2010.09912.x
15. Svatek RS, Siefker-Radtke A, Dinney CP. Management of metastatic urothelial cancer: the role of surgery as an adjunct to chemotherapy. Can Urol Assoc J. 2009;3(6 Suppl 4):S228-231. DOI: 10.5489/cuaj.1203
16. Kamat AM, Hegarty pK, Gee JR, Clark PE, Svatek RS, Hegarty N, Shariat SF, Xylinas E, Schmitz-Drager BJ, Lotan Y, Jenkins LC, Droller M, van Rhijn BW, Karakiewicz PI; International consultation on Urologic Disease-European Association of Urology consultation on Bladder cancer 2012. IcUD-EAU International consultation on Bladder cancer 2012: Screening, diagnosis, and molecular markers. Eur Urol. 2013;63(1):4-15. DOI: 10.1016/j.eururo.2012.09.057
17. Alfred Witjes J, Lebret T, Comperat EM, Cowan NC, De Santis M, Bruins HM, Hernandez V, Espinós EL, Dunn J, Rouanne M, Neuzillet Y, Veskimae E, van der Heijden AG, Gakis G, Ribal MJ. Updated 2016 EAU Guidelines on Muscle-invasive and Metastatic Bladder cancer. Eur Urol. 2017;71(3):462-475. DOI: 10.1016/j.eururo.2016.06.020
18. Dodd PM, Mccaffrey JA, Herr H, Mazumdar M, Bacik J, Higgins G, Boyle MG, Scher HI, Bajorin DF. Outcome of postchemotherapy surgery after treatment with methotrexate, vinblastine, doxorubicin, and cisplatin in patients with unresectable or metastatic transitional cell carcinoma. J Clin Oncol. 1999;17(8):2546-2552. DOI: 10.1200/JcO.1999.17.8.2546
19. Skinner DG, Stein JP, Lieskovsky G, Skinner Ec, Boyd SD, Figueroa A, Jones P, cote R, Groshen S. 25-year experience in the management of invasive bladder cancer by radical cystectomy. Eur Urol. 1998;33 Suppl 4:25-26. DOI: 10.1159/000052260
20. Figueroa AJ, Stein JP, Dickinson M, Skinner Ec, Thangathurai D, Mikhail MS, Boyd SD, Lieskovsky G, Skinner DG. Radical cystectomy for elderly patients with bladder carcinoma: an updated experience with 404 patients. Cancer. 1998;83(1):141-147. DOI: 10.1002/(sici)1097-0142(19980701)83:1<141::aid-cncr19>3.0.co;2-x
21. Zebic N, Weinknecht S, Kroepfl D. Radical cystectomy in patients aged > or = 75 years: an updated review of patients treated with curative and palliative intent. BJU Int. 2005;95(9):1211-1214. DOI: 10.1111/j.1464-410X.2005.05507.x
22. Powles T, Eder JP, Fine GD, Braiteh FS, Loriot Y, Cruz C, Bellmunt J, Burris HA, Petrylak DP, Teng SL, Shen X, Boyd Z, Hegde PS, chen DS, Vogelzang NJ. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature. 2014;515(7528):558-562. DOI: 10.1038/nature13904
23. Dreicer R, Gustin DM, See WA, Williams RD. Paclitaxel in advanced urothelial carcinoma: its role in patients with renal insufficiency and as salvage therapy. J Urol. 1996;156(5):1606-1608. DOI: 10.1016/s0022-5347(01)65459-4
24. Tilki D, Svatek RS, Karakiewicz PI, Isbarn H, Reich O, Kassouf W, Fradet Y, Novara G, Fritsche HM, Bastian PJ, Izawa JI, Stief CG, Ficarra V, Lerner SP, Schoenberg M, Dinney CP, Skinner E, Lotan Y, Sagalowsky AI, Shariat SF. characteristics and outcomes of patients with pT4 urothelial carcinoma at radical cystectomy: a retrospective international study of 583 patients. J Urol. 2010;183(1):87-93. DOI: 10.1016/j.juro.2009.08.145
25. Herr HW, Faulkner JR, Grossman HB, Natale RB, de Vere White R, Sarosdy MF, crawford ED. Surgical factors influence bladder cancer outcomes: a cooperative group report. J Clin Oncol. 2004;22(14):2781-2789. DOI: 10.1200/JcO.2004.11.024
26. Black P, Dinney CP, Brown Ga, Kassouf W, Siefker-Radtke AO, Munsell MF, Grossman HB, Kamat AM. The role of radical cystectomy in patients with clinical T4b bladder cancer. Urol Oncol. 2011;29(2):157-161. DOI: 10.1016/j.urolonc.2009.12.015
27. Sweeney P, Millikan R, Donat M, Wood CG, Radtke AS, Pettaway CA, Grossman HB, Dinney CP, Swanson DA, Pisters LL. Is there a therapeutic role for post-chemotherapy retroperitoneal lymph node dissection in metastatic transitional cell carcinoma of the bladder? J Urol. 2003;169(6):2113-2117. DOI: 10.1097/01.ju.0000067601.29966.4a
28. Fossa SD, Sternberg C, Scher HI, Theodore CH, Mead B, Dearnaley D, Roberts JT, Skovlund E. Survival of patients with advanced urothelial cancer treated with cisplatin-based chemotherapy. Br J Cancer. 1996;74(10):1655-1659. DOI: 10.1038/bjc.1996.605
29. Rodel C, Grabenbauer GG, Kuhn R, Papadopoulos T, Dunst J, Meyer M, Schrott KM, Sauer R. combined-modality treatment and selective organ preservation in invasive bladder cancer: long-term results. J Clin Oncol. 2002;20(14):3061-3071. DOI: 10.1200/JcO.2002.11.027
30. Dunst J, Diestelhorst A, Kuhn R, Muller AC, Scholz HJ, Fornara P. Organ-sparing treatment in muscle-invasive bladder cancer. Strahlenther Onkol. 2005;181(10):632-637. DOI: 10.1007/s00066-005-1416-5
31. Arias F, Dominguez MA, Martinez E, Illarramendi JJ, Miquelez S, Pascual I, Marcos M. Chemoradiotherapy for muscle invading bladder carcinoma. Final report of a single institutional organ-sparing program. Int J Radiat Oncol Biol Phys. 2000;47(2):373-378. DOI: 10.1016/s0360-3016(00)00444-2
32. Chen WC, Liaw CC, Chuang CK, Chen MF, Chen CS, Lin PY, Chang PL, Chu SH, Wu CT, Hong JH. Concurrent cisplatin, 5-fluorouracil, leucovorin, and radiotherapy for invasive bladder cancer. Int J Radiat Oncol Biol Phys. 2003;56(3):726-733. DOI: 10.1016/s0360-3016(03)00124-x
33. Tekin A, Aki FT, Ozen H. Radical cystectomy versus alternative treatments for muscle-confined bladder cancer. Int Urol Nephrol. 2001;33(2):357-362. DOI: 10.1023/a:1015261628978
34. Wilson JR, Urwin GH, Stower MJ. The role of percutaneous nephrostomy in malignant ureteric obstruction. Ann R Coll Surg Engl. 2005;87(1):21-24. DOI: 10.1308/1478708051432
35. Lodde M, Palermo S, comploj E, Signorello D, Mian C, Lusuardi L, Longhi E, Zanon P, Mian M, Pycha A. Four years experience in bladder preserving management for muscle invasive bladder cancer. Eur Urol. 2005;47(6):773-778; discussion 778-779. DOI: 10.1016/j.eururo.2005.01.017
36. Mantadakis E, Panagiotidis C, Delakas D, Samonis G. Symptomatic relief of patients with advanced bladder carcinoma after regional intra-arterial chemotherapy. Anticancer Res. 2003;23(6D):5143-5147. pMID: 14981980.
37. Nagele U, Anastasiadis AG, Merseburger AS, Corvin S, Hennenlotter J, Adam M, Sievert KD, Stenzl A, Kuczyk Ma. The rationale for radical cystectomy as primary therapy for T4 bladder cancer. World J Urol. 2007;25(4):401-405. DOI: 10.1007/s00345-007-0172-9
Об авторах
О. Н. ВасильевРоссия
Олег Николаевич Васильев - кандидат медицинских наук; ассистент кафедры урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии), заведующий урологическим отделением Клиники.
344022, Ростов-на-Дону, пер. Нахичеванский, д. 29, тел.: +7 (863) 250-40-79
Конфликт интересов: нет
В. А. Перепечай
Россия
Вадим Анатольевич Перепечай - доктор медицинских наук, врач-уролог высшей категории, доцент кафедры урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии) ФГБОУ ВО РостГМУ МР; руководитель Центра урологии, заведующий урологическим отделением РКБ ФГБУЗ ЮОМЦ ФМБА России.
344022, Ростов-на-Дону, пер. Нахичеванский, д. 29; 344023, Ростов-на-Дону, ул. Пешкова, д. 34
Конфликт интересов: нет
М. И. Коган
Россия
Михаил Иосифович Коган - Заслуженный деятель науки РФ, доктор медицинских наук, профессор; заведующий кафедрой урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии).
344022, Ростов-на-Дону, пер. Нахичеванский, д. 29
Конфликт интересов: нет
А. В. Рыжкин
Россия
Андрей Вячеславович Рыжкин - аспирант кафедры урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии); врач-уролог Клиники.
344022, Ростов-на-Дону, пер. Нахичеванский, д. 29
Конфликт интересов: нет
Рецензия
Для цитирования:
Васильев О.Н., Перепечай В.А., Коган М.И., Рыжкин А.В. Паллиативная цистэктомия. Есть ли место в хирургии рака мочевого пузыря? Вестник урологии. 2020;8(3):18-29. https://doi.org/10.21886/2308-6424-2020-8-3-18-29
For citation:
Vasilyev O.N., Perepechay V.A., Kogan M.I., Ryzhkin A.V. Palliative cystectomy. Is there a place in bladder cancer surgery? Urology Herald. 2020;8(3):18-29. (In Russ.) https://doi.org/10.21886/2308-6424-2020-8-3-18-29













































