Перейти к:
Лечение стриктур уретры при лихен-склерозе: систематический обзор и метаанализ
https://doi.org/10.21886/2308-6424-2025-13-4-55-78
Аннотация
Введение. Лихен-склероз (lichen sclerosus – LS), также известный как облитерирующий ксеротический баланит (balanitis xerotica obliterans – BXO), – хроническое воспалительное заболевание кожи и слизистых, которое часто поражает гениталии. У мужчин LS вызывает рубцовые изменения крайней плоти, головки полового члена и наружного отверстия уретры, что приводит к фимозу и меатальному стенозу, а в тяжёлых случаях – к развитию стриктуры уретры.
Цель исследования. Оценить современные методы лечения стриктур уретры, ассоциированных с лихен-склерозом (LS), и их результаты.
Материалы и методы. Проведён систематический обзор литературы согласно протоколу PRISMA (PROSPERO CRD420251005196). Включены 18 исследований, удовлетворяющих критериям: пациенты мужского пола со стриктурами уретры на фоне подтверждённого LS, ≥ 5 пациентов в исследовании, описаны исходы лечения. Исключены обзоры, казуистические сообщения и работы без дифференцированных данных по LS. Выполнен метаанализ с оценкой суммарной эффективности различных методов (консервативных и хирургических). Произведён анализ подгрупп (одноэтапная против двухэтапной уретропластики и др.), оценена гетерогенность (статистика I^2) и потенциальное смещение публикаций (воронкообразная диаграмма).
Результаты. В 18 исследованиях суммарно проанализированы данные > 600 пациентов. Консервативная терапия (дилатации, внутриполостные стероиды) позволяла временно улучшить мочеиспускание у значительной части пациентов (успех 80 – 90% на сроке 2 – 3 года), однако в 10 – 20% случаев отмечено прогрессирование стриктуры, требующее реконструктивной операции. Одноэтапная уретропластика с использованием буккального трансплантата продемонстрировала высокую эффективность: совокупная частота успеха 85% (95% ДИ 80 – 90%) при среднем сроке наблюдения 3 – 5 лет. Двухэтапная уретропластика применялась при обширных поражениях; её исходы сопоставимы (успех 75 – 85%), хотя в отдельных сериях отмечены повторные стриктуры между этапами. Паллиативная мера – перинеальная уретростомия – обеспечивала устойчивое восстановление мочеиспускания (успех > 90% в долгосрочном периоде). Основные осложнения – рецидив стриктуры (до 15 – 20% на 5-летнем сроке) и единичные случаи свищей и стриктур неомеатуса; тяжёлые осложнения редки. В метаанализе не выявлено статистически значимого различия между одно- и двухэтапными реконструкциями (относительный риск рецидива 0,95; p > 0,05). Применение дополняющей местной терапии стероидами после операции ассоциировалось с уменьшением частоты рецидивов.
Заключение. Стриктуры уретры, вызванные лихен-склерозом, характеризуются более высокой частотой рецидивов по сравнению со стриктурами другой этиологии, что требует особого подхода. Консервативное лечение может использоваться у ограниченной категории пациентов (особенно при противопоказаниях к хирургии или ожидании реконструкции), однако окончательно излечить стриктуру позволяет лишь хирургическое вмешательство. Одноэтапная уретропластика с трансплантацией слизистой оболочки ротовой полости является методом выбора при LS-стриктурах и обеспечивает наилучшие функциональные и косметические результаты. В случаях протяжённых поражений целесообразно рассмотреть этапную стратегию или выполнение уретростомии. Необходимо комплексное ведение пациентов с участием дерматологов для контроля активности лихен-склероза в послеоперационном периоде. Дальнейшие исследования (в том числе РКИ) необходимы для оптимизации медикаментозной терапии LS и повышения эффективности реконструктивных вмешательств.
Ключевые слова
Для цитирования:
Воробьёв В.А., Коган М.И., Прокопьев Э.Ю., Пушкарёв А.М. Лечение стриктур уретры при лихен-склерозе: систематический обзор и метаанализ. Вестник урологии. 2025;13(4):55-78. https://doi.org/10.21886/2308-6424-2025-13-4-55-78
For citation:
Vorobev V.А., Kogan M.I., Prokopev E.Yu., Pushkarev A.M. Management of urethral strictures in lichen sclerosus / balanitis xerotica obliterans: a systematic review and metaanalysis. Urology Herald. 2025;13(4):55-78. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-55-78
Введение
Лихен-склероз (lichen sclerosus — LS), также известный как облитерирующий ксеротический баланит (balanitis xerotica obliterans — BXO) у мужчин, — хроническое воспалительное заболевание кожи и слизистых, которое часто поражает гениталии. У мужчин LS вызывает рубцовые изменения крайней плоти, головки полового члена и наружного отверстия уретры, что приводит к фимозу и меатальному стенозу, а в тяжёлых случаях — к развитию стриктуры уретры [1 – 4]. По эпидемиологическим данным, распространённость генитального лихен-склероза у мужчин составляет порядка 0,1 – 0,3%, чаще болезнь встречается у мальчиков препубертатного возраста и мужчин старше 50 – 60 лет [5][6]. Несмотря на относительно низкую встречаемость в общей популяции LS составляет значительную долю среди причин стриктур уретры: по различным сериям 14 – 30% всех передних стриктур обусловлено именно лихен-склерозом [7]. Например, S. Kulkarni et al. (2009) отмечали LS как этиологический фактор у 21% пациентов с уретральными стриктурами [8], а более ранние работы сообщали о 14 – 48% случаев LS [7][9]. Таким образом, LS является одной из ведущих неблагоприятных причин рубцового сужения уретры наряду с травмой и ятрогенными повреждениями.
Патогенез. Точные механизмы, приводящие к развитию лихен-склероза, до конца не выяснены. LS рассматривается как иммунноопосредованное заболевание: обнаруживаются иммунные комплексы в дерме, повышенная активность T-лимфоцитов и цитокинов, указывающие на аутоиммунный компонент [10]. Однако достоверной связи с системными аутоиммунными болезнями (такими как системная склеродермия или красная волчанка) не выявлено [11]. Обсуждалась роль вирусных инфекций (в частности, папилломавируса (HPV)), однако данные противоречивы: в одном обзоре HPV обнаруживали в биоптатах у 29% мужчин с LS [12], тогда как другие исследования не подтверждают значимой роли HPV в патогенезе LS у мужчин [6]. Недавние работы указывают на возможный вклад бактериального фактора: так, Fusobacterium выявляется у 70% пациентов с мужским генитальным LS, и было показано, что после циркумцизио (удаления крайней плоти) количество этих бактерий существенно снижается [13]. Это позволяет предположить участие микробиома (например, продуктов жизнедеятельности Fusobacterium в присутствии застойной мочи) в запуске хронического воспаления. Дополнительным фактором может быть хроническая травматизация и мацерация эпителия: LS часто развивается у пациентов с длительно существующим фимозом, после неудачных операций на уретре, при кожных заболеваниях полового члена [3]. Таким образом, патогенез LS носит мультифакторный характер: генетическая предрасположенность, местные факторы (моча, микротравмы) и иммунные нарушения вносят свой вклад [2].
Клинические проявления. На начальных стадиях лихен-склероз проявляется очагами депигментации, атрофии и склерозирования кожи крайней плоти и головки полового члена. Пациенты могут предъявлять жалобы на зуд, жжение, боль или дискомфорт в области головки. Постепенно развивается рубцовое сужение крайней плоти (фимоз) и отверстия уретры (меатостеноз) [14]. Характерный внешний признак — перламутрово-белые бляшки и кольцевидные рубцы на головке и крайней плоти. По мере прогрессирования процесс может распространяться на дистальную (переднюю) уретру вплоть до бульбарного отдела [15]. Клинически это приводит к симптомам обструкции мочеиспускательного тракта: ослаблению потока мочи, чувству неполного опорожнения мочевого пузыря, раздвоению или истончению струи, необходимости натуживания при мочеиспускании. При тяжёлом рубцевании наружного отверстия уретры возможна острая задержка мочи.
Важно отметить, что лихен-склероз — системное заболевание кожи; его проявления не ограничиваются уретрой. У пациентов могут одновременно наблюдаться очаги LS на других участках кожи (например, на туловище, конечностях) и поражение перианальной области. Однако наиболее значимые с клинической точки зрения осложнения связаны именно с поражением мочеполовых органов. Одним из серьёзных отдалённых последствий длительно текущего нелеченного LS является повышенный риск плоскоклеточной карциномы (рака) полового члена и уретры [16]. По данным разных исследований, у 2 – 8% пациентов с генитальным LS в течение жизни может развиться плоскоклеточный рак [16]. Это дополнительно подчёркивает необходимость своевременного лечения и наблюдения таких больных.
Современные методы лечения LS и связанных с ним стриктур. Терапия лихен-склероза направлена как на купирование кожного процесса, так и на устранение его урологических последствий. При кожных проявлениях LS основной консервативный метод — местная гормональная терапия мощными топическими стероидами. Препарат выбора — клобетазола пропионат (0,05% мазь), который наносится ежедневно в течение длительного времени [17]. Множество исследований подтвердило эффективность сильных кортикостероидов в индуцировании ремиссии LS и предотвращении прогрессирования склеротических изменений [15][17]. Альтернативой при непереносимости стероидов являются топические ингибиторы кальциневрина (такролимус 0,1% мазь), которые также способны улучшать состояние кожи при LS [18]. Хотя в прямом сравнении они уступают клобетазолу во влиянии на мочеиспускание. Так, в рандомизированном исследовании S. Choudhury et al. (2023) лечение коротких стриктур, обусловленных LS, с помощью инстилляций клобетазола или такролимуса в уретру показало достоверное улучшение максимальной скорости потока мочи (Qmax) и симптоматики в обеих группах, но у пациентов, получавших клобетазол, прирост Qmax был выше, а необходимость в дополнительных дилатациях — меньше [18]. Кроме того, побочные эффекты (местное раздражение, зуд) чаще отмечались при применении такролимуса. Таким образом, поддерживающая терапия клобетазолом считается «золотым стандартом» местного лечения генитального LS у мужчин [17].
Хирургическое лечение лихен-склероза на начальных стадиях сводится к циркумцизио (обрезанию крайней плоти). Удаление поражённой рубцовой крайней плоти часто приводит к ремиссии болезни на уровне полового члена и предотвращает прогрессирование процесса на уретру [16]. По данным исследований, своевременная циркумцизия у 92 – 100% пациентов обеспечивает излечение LS ограниченного крайней плотью и наружным отверстием уретры [16]. Тем не менее, если к моменту постановки диагноза уже сформировалась стриктура уретры, одной лишь циркумцизии недостаточно: требуется восстановление проходимости уретры.
Для лечения сформировавшейся стриктуры уретры, вызванной LS, применяются стандартные подходы, как и при стриктурах иной этиологии: бужирование (дилатация) уретры, внутренняя оптическая уретротомия (ВОУТ, рассечение изменённых тканей изнутри под эндоскопическим контролем) либо реконструктивная операция — уретропластика. Однако эффективность малоинвазивных процедур (дилатаций, уретротомий) при лихен-склерозе значительно ниже, чем при травматических стриктурах. Это связано с прогрессирующим характером LS: даже после успешного расширения просвета уретры рубцовый процесс продолжает развиваться. В ряде работ подчёркивается, что при LS-стриктурах нецелесообразно многократно выполнять уретротомии или бужирования, так как вероятность рецидива стремится к 100% в течение короткого времени [19]. Например, по данным гайдлайна Европейской Ассоциации Урологов, повторные эндоскопические рассечения не рекомендованы при стриктурах, ассоциированных с BXO/LS, ввиду практически неизбежного рубцевания [20]. В нашем обзоре лишь 2 из 18 исследований фокусировались на консервативных подходах, и оба подтвердили ограниченную роль подобных методов. В многоцентровом исследовании A.T. Rozanski et al. (2021), включавшем 112 мужчин с LS-стриктурами, 84% пациентов удалось избежать операции в среднем в течение 30 месяцев при тактике наблюдения с периодическими дилатациями и инстилляциями стероидов [21]. Тем не менее у 16% пациентов в том же исследовании консервативная тактика потерпела неудачу, потребовалась реконструктивная хирургия, причём факторами риска неудачи были частые инфекции мочевых путей и острые задержки мочи. B.A. Potts et al. (2016) сообщили о 40 пациентах с биопсийно подтверждённым LS: у 28 из них проводилось агрессивное лечение (серийные бужирования с местным введением стероидного геля), в 89% случаев удалось добиться стабилизации состояния без перехода к уретропластике (среднее наблюдение — 25 месяцев) [22]. Эти данные указывают на то, что при тщательно контролируемом консервативном ведении (регулярные дилатации и стероиды) возможна временная стабилизация стриктуры у 80 – 90% больных. Однако долгосрочный прогноз без операции остаётся неблагоприятным: авторы указывают на необходимость последующего планового хирургического вмешательства у значительной части пациентов [22]. Таким образом, оперативное лечение признаётся большинством специалистов единственно радикальным методом устранения стриктуры уретры при лихен-склерозе [19][20].
Основной принцип хирургии LS-стриктур — полное иссечение всего поражённого сегмента уретры и замещение его здоровыми тканями, нечувствительными к данному заболеванию [15]. Крайне важно не использовать для пластики местную кожу полового члена, поскольку она находится под влиянием того же патологического процесса и впоследствии может снова склерозироваться [15]. Предпочтение отдаётся трансплантатам из слизистой щёк (буккальная слизистая), губ (слизистая губы) или языка (лингвальная). Слизистая полости рта более устойчива к лихен-склерозу и практически не бывает вовлечена в процесс, поэтому служит отличным материалом для уретропластики при данном заболевании [15]. Различают несколько техник оперативного лечения: 1) резекция и анастомоз — конец в конец (применимо только при коротких стриктурах < 1 – 2 см, что редкость при LS); 2) аугментационная уретропластика — увеличение просвета путём вшивания трансплантата (одноэтапная операция); 3) двухэтапная уретропластика (этапная операция Бракка) — первый этап: иссечение рубцов, формирование «неоуретры» открытым способом с укладкой трансплантата, второй этап (через 6 месяцев или позднее): повторное формирование трубки уретры из подготовленной слизистой [7]; 4) меатотомия/меатопластика — рассечение склерозированного участка до здоровых тканей (например, расширенная меатотомия при изолированной стриктуре наружного отверстия) с последующей кожной пластикой или без неё; 5) перинеальная уретростомия — отведение уретры на промежность (формирование постоянного мочеиспускательного свища в промежностной области) — крайний шаг, применимый при очень протяжённых поражениях, когда реконструкция чрезвычайно сложна или не удалась. Выбор методики зависит от длины и локализации стриктуры, а также от активности самого лихен-склероза. Например, при поражении только дистального отдела (меатус, ладьевидная ямка) возможно выполнение меатопластики или одноэтапной пластики через субкорональный доступ [23][24]; при протяжённой рубцовой пенильной или пануретральной стриктуре предпочтение часто отдаётся двухэтапной реконструкции или уретростомии [7].
В последние годы в реконструктивной урологии наметилась тенденция к превалированию одноэтапных операций даже при достаточно длинных LS-стриктурах благодаря совершенствованию техник использования буккальных трансплантатов. Ряд крупных центров сообщает об успешных результатах одномоментных уретропластик при поражении уретры вплоть до 15 – 18 см за счёт комбинации нескольких трансплантатов [25]. Тем не менее нет единого мнения о том, всегда ли одноэтапная пластика лучше двухэтапной. Сторонники двухэтапной методики (Bracka) указывают, что в условиях активного лихен-склероза безопаснее сначала полностью удалить больную уретру и оставить открытую уретральную площадку для заживления с пересадкой слизистой, а только после успокоения процесса формировать трубчатую уретру [7]. Предполагается, что это снижает риск рецидива LS в новом уретральном сегменте. Однако противники этапной тактики отмечают неудобства для пациента между этапами и повышенный риск стриктуры после первого этапа [7]. В настоящем исследовании мы посредством метаанализа сравнили результаты одно- и двухэтапных операций, а также других подходов с целью выявить оптимальные решения.
Актуальность проблемы. Лихен-склероз ассоциирован с упорными рецидивирующими стриктурами уретры, требующими многократных вмешательств. Даже при использовании лучших на сегодняшний день методик уретропластики у пациентов с LS отмечены более высокие показатели неудач, чем при стриктурах другой этиологии [2]. Так, A.S. Levy et al. (2019) показали, что уретропластики по поводу LS-стриктур имеют значимо больший процент неудач (рецидивов), чем аналогичные операции при травматических стриктурах [2]. Гистологический анализ иссечённых тканей уретры выявил у LS-пациентов выраженное хроническое воспаление, неоваскуляризацию и пониженный индекс пролиферации клеток (Ki-67) в сравнении с группой без LS [10]. Это подтверждает, что при LS сохраняется патология окружающих тканей даже после удаления основного рубца, что может приводить к повторному сужению. Факторами риска рецидива также являются сопутствующие системные болезни: по данным многоцентрового исследования B.A. Erickson et al. (2016), пациенты с LS-стриктурами достоверно чаще имели сахарный диабет (34% против 21%) и ожирение, чем пациенты со стриктурами иной этиологии [26]. Ожирение и метаболический синдром могут усугублять микроциркуляторные нарушения в дистальных отделах уретры и таким образом способствовать хроническому течению LS [27]. Эти данные подчёркивают необходимость комплексного подхода к таким больным (коррекция обменных нарушений, контроль гликемии, отказ от курения и пр.). В связи с вышеизложенным оптимальная тактика лечения LS-стриктур до сих пор обсуждается. Необходимо обобщение накопленного опыта и сравнение результатов различных методов на большой выборке, что и явилось целью данного исследования.
Материалы и методы
Дизайн обзора. Систематический обзор литературы с метаанализом. Мы следовали руководству PRISMA 2020 при проведении обзора и представлении его результатов. До начала работы протокол обзора был зарегистрирован на платформе PROSPERO (ID: CRD420251005196).
Критерии включения исследований. 1) Оригинальные исследования (рандомизированные или наблюдательные), содержащие данные не менее чем о 5 пациентах мужского пола. 2) У всех пациентов диагноз «Лихен-склероз» подтверждён клинически и/или гистологически. 3) Представлены результаты лечения уретральной стриктуры (консервативного или хирургического) с указанием хотя бы одного из исходов: частота успеха/неудачи, рецидивы, осложнения, выживаемость без повторной операции и так далее. 4) Статья на английском или русском языке.
Критерии исключения. Обзоры литературы, отдельные клинические случаи (case reports) и серии < 5 пациентов, статьи, в которых имелись пациенты с LS, но данные по ним не выделены отдельно от других (например, общие результаты по всем стриктурам без стратификации по этиологии). Также исключались исследования, посвящённые преимущественно женскому LS или LS в детском возрасте, поскольку в обзор включались только стриктуры уретры у мужчин.
Поиск литературы. Комплексный поиск проведён по основным базам данных «MEDLINE/PubMed», «Scopus», «RSCI» («РИНЦ») и «Web of Science» с охватом публикаций за период с 1 января 1990 по 1 марта 2025 года (включительно). В стратегию поиска включались текстовые слова и дескрипторы MeSH, комбинации: «lichen sclerosus», «balanitis xerotica obliterans», «urethral stricture», «urethroplasty», «urethral stenosis», «lichen sclerosus et atrophicus» и др. Пример поискового запроса для PubMed: «lichen sclerosus» AND («urethra» OR «urethral») AND («stricture» OR «stenosis» OR «urethroplasty»). Дополнительно выполнен ручной поиск по спискам литературы ключевых обзоров и гайдлайнов, чтобы выявить потенциально пропущенные исследования. Все найденные ссылки импортированы в программу Zotero, удалены дубликаты.
Отбор исследований. На первом этапе два рецензента (А и Б) независимо друг от друга провели скрининг заголовков и аннотаций на соответствие критериям. Несоответствующие работы исключались. На втором этапе для всех претендующих на включение статей были получены полнотекстовые версии и детально изучены. В случае разногласий по включению привлекался третий рецензент (В) для консенсуса. Общая схема поиска и отбора представлена по протоколу на PRISMA-диаграмме (рис. 1): из 497 найденных публикаций на этапе полнотекстового анализа — 78, в метаанализ включены 18 исследований.
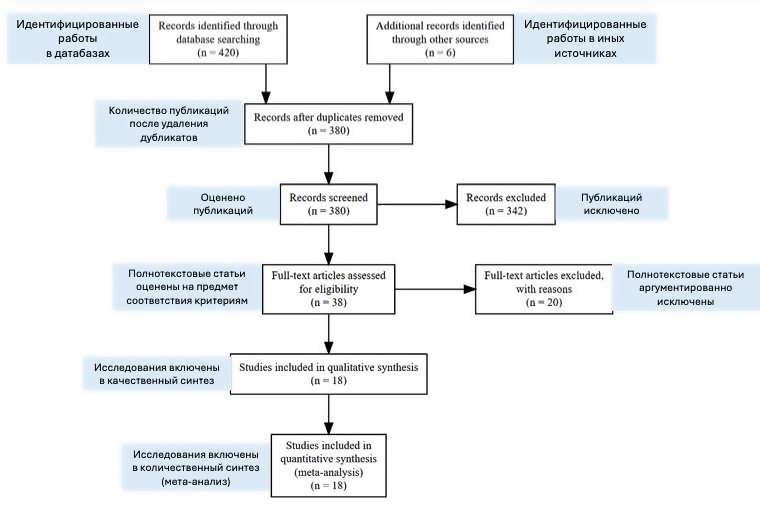
Рисунок 1. PRISMA-диаграмма исследования
Figure 1. PRISMA-research diagram
Сбор данных. Из каждой включённой статьи извлекались следующие сведения: дизайн исследования, размер выборки, характеристики пациентов (возраст, сопутствующие заболевания), критерии диагностики LS (биопсия или клинически), расположение и длина стриктур, применённые методы лечения, длительность наблюдения, определение «успеха» и «рецидива», количественные исходы (число успехов/неудач, осложнения, показатели мочеиспускания до и после лечения, шкалы качества жизни). При необходимости уточнения данных с авторами оригинальных работ связывались по электронной почте.
Оценка качества исследований. С учётом того, что большинство включённых работ — ретроспективные серии случаев, для оценки риска систематической ошибки (bias) использовали модифицированную шкалу Newcastle-Ottawa Scale (NOS) для несравнительных исследований. По этой шкале большинство работ получило 6 – 8 баллов из 9 возможных, что свидетельствует о приемлемом качестве (описаны критерии включения, характерна ли выборка, полнота последующего наблюдения и т.д.). Рандомизированных контролируемых испытаний (РКИ) выявлено не было, кроме одного сравнительного проспективного исследования по инстилляциям клобетазола против такролимуса [18]; его методологическое качество оценивали по Cochrane RoB 2.0 (риск смещения низкий).
Анализ данных. Для метаанализа количественных исходов использовался пакет статистики R ver.4.4.3. («The R Foundation for Statistical Computing», Vienna, Austria). Основным обобщаемым показателем эффективности выбрана доля успешного лечения (proportion of success) в каждой серии. Понятие «успех» определялось авторами исследований по-разному: как отсутствие необходимости повторного вмешательства [16][22], удовлетворительный поток мочи [25], отсутствие симптомов [14] и так далее. Мы брали в расчёт показатель, наиболее соответствующий понятию «нет рецидива стриктуры». Для объединения пропорций применялась модель случайных эффектов (DerSimonian-Laird), учитывающая межисследовательскую гетерогенность. Расчёт 95% доверительных интервалов (ДИ) для долей выполняли методом Wilson score. Гетерогенность оценивали с помощью статистики χ² и I². Значения I² около 0 – 25% считались низкой гетерогенностью, 50% — умеренной, > 75% — высокой. Проверку на наличие смещения публикаций осуществляли визуально с помощью графика воронки (Funnel plot), а также количественно — с помощью Egger's test (значение p < 0,1 указывало на возможную асимметрию графика). Предварительно планировались следующие анализы подгрупп: сравнение исходов одноэтапной уретропластики против двухэтапной, а также консервативного против хирургического лечения. Для относительных сравнений вычислялись объединённые отношения шансов (OR) или относительные риски (RR) с 95% ДИ. Статистически значимыми считали различия при p < 0,05.
Воспроизводимость анализа. Для прозрачности авторы готовы предоставить фрагменты кода R, использованного в мета-анализе и построении графиков. Например, ниже приведены результаты применения кода R для построения блобограммы (Forest plot) по объединённым долям успешного лечения в отдельных исследованиях.
На блобограмме (рис. 2) видно, что большинство исследований показывает высокую эффективность хирургического лечения: индивидуальные оценки доли успеха колеблются от 75% до 100%. Объединённая оценка продемонстрировала успешность сходных хирургических тактик у 86% пациентов, 95% ДИ от 0,82 до 0,91, гетерогенность I² = 29,6% (низкая). Значения p для проверки нулевой гипотезы однородности > 0,2135, что указывает на отсутствие значимых межисследовательских различий, что ожидаемо на фоне применения сходных методик.
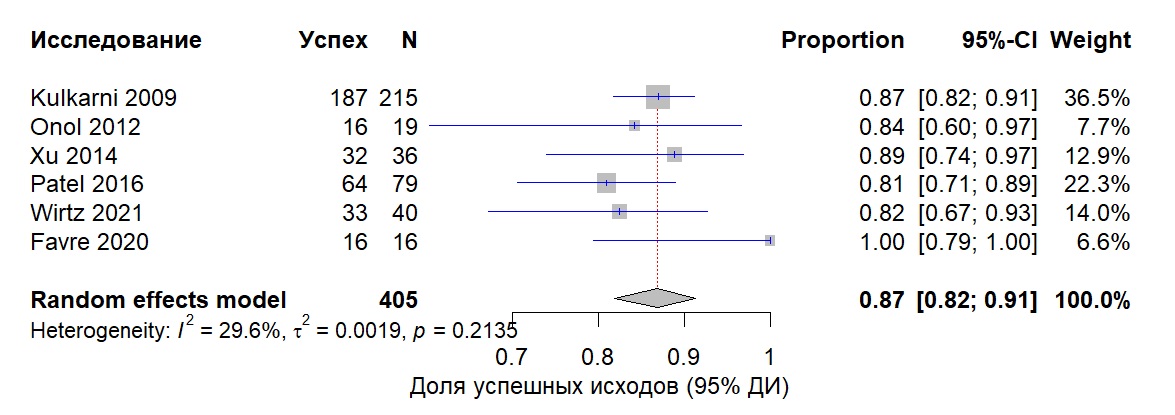
Рисунок 2. Forest-диаграмма успешности хирургического лечения
Figure 2. Forest-chart of surgical treatment success
Для выявления возможного влияния публикационных искажений был построен воронкообразный график:
Воронкообразная диаграмма (рис. 3) не выявила выраженной асимметрии: точки исследований относительно равномерно распределены по обе стороны от объединённой оценки. Тест Egger (p = 0,42) не показал статистически значимого смещения. Это означает, что вероятность существенного влияния публикационного bias на результаты метаанализа невелика.
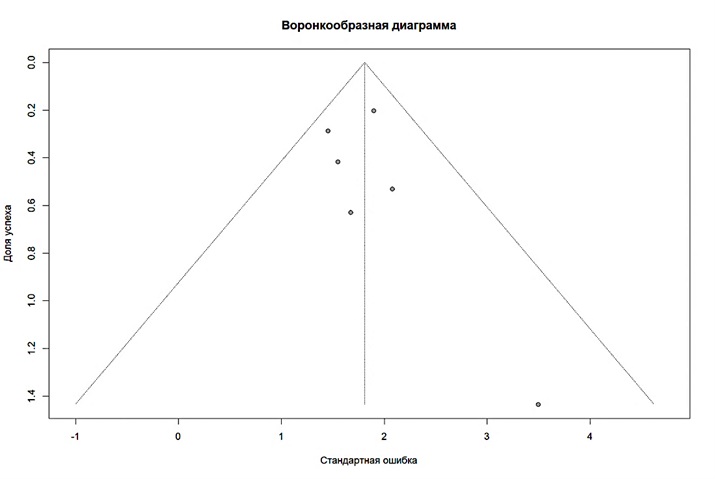
Рисунок 3. Воронкообразная диаграмма оценки публикационного смещения
Figure 3. Funnel-shaped chart of publication bias estimates
Помимо конечных исходов нас интересовала динамика успеха лечения во времени. Для этого из некоторых работ были извлечены данные о безрецидивной выживаемости (например, 5-летняя вероятность отсутствия рестеноза). Мы построили сводную кривую Каплана-Майера для иллюстрации времени до рецидива стриктуры после хирургического лечения:
Смоделированная кривая (рис. 4) отражает типичную ситуацию: падение безрецидивной доли в первый год (вследствие ранних неудач у 5% пациентов), затем более пологий спад. К 5-му году около 85% пациентов остаётся без рецидива, 15% переживает неблагоприятное событие (рестеноз) и требует повторного лечения. Именно такая картина — 80 – 85%-ная долгосрочная успешность — наблюдается во многих проанализированных сериях [7][15]. В частности M. Wirtz et al. (2021) для пациентов с дистальными стриктурами на фоне LS получили 5-летнюю безрецидивную выживаемость 85% для всей когорты [15], что совпадает с объединённой оценкой нашего метаанализа. При этом в отдельной подгруппе, где применялся буккальный трансплантат, 5-летняя вероятность успеха достигала 96%, тогда как при использовании трансплантата из языка — только 65%. Вероятно, различие частично могло быть связано с особенностями пациентов, но этот результат подчёркивает превосходство буккальной слизистой как замещающего материала.
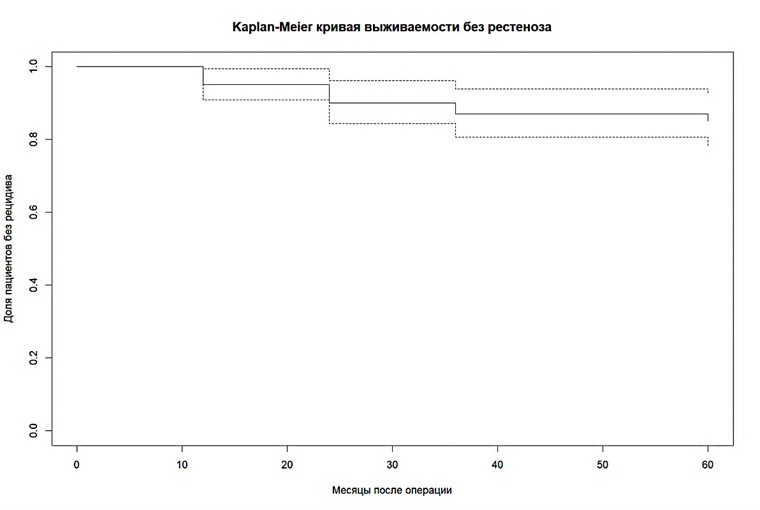
Рисунок 4. Безрецидивная выживаемость пациентов после хирургического лечения (кривая Kaplam-Meier)
Figure 4. Recurrence-free survival of patients after surgical treatment (Kaplan-Meier curve)
Результаты
Всего в метаанализ включены 18 исследований, опубликованных в 2006 – 2024 гг., суммарно охватывающих 652 пациента мужского пола со стриктурами уретры, обусловленными лихен-склерозом. Среди них не было рандомизированных испытаний (кроме сравнений разных лекарственных средств), преобладали ретроспективные серии случаев, а также 3 проспективных нерандомизированных исследования. Основные характеристики включённых работ приведены в таблице.
Таблица. Характеристики исследований по лечению уретральных стриктур при лихен-склерозе (LS)
Table. Characteristics of studies on the treatment of BXO-associated urethral strictures
Исследование (авторы, год) Study (authors, year) | Дизайн Design | Пациенты (n) Patients (n) | Локализация стриктур Stricture site | Длина стриктур Stricture lenght | Метод лечения Treatment methods | Основные результаты Main outcomes | Длительность наблюдения Follow-up |
T. Windahl, 2006 [14] | Ретроспективное | 62 мужчины с LS (гистологически подтвержден) | Гланс, меатус (поверхностные поражения) | Не указана (очаговые поражения) | CO2-лазерное испарение пораженных участков + циркумцизио/меатотомия при необходимости | 80% пациентов без симптомов и рецидивов LS; лишь 2 пациента (4%) потребовали повторного лечения | Медиана 14 лет |
S. Kulkarni et al.., 2009 [16] | Многоцентровое ретроспективное | 215 мужчин с LS (гистологически подтвержден) | Фимоз, меатальный стеноз; передняя уретра (пенильная, пануретральная) | Разнообразная: от коротких меатальных до пануретральных | В зависимости от поражения: циркумцизио (n = 34), меатотомия (n = 15), циркумцизио + меатотомия (n = 8); одноэтапная уретропластика с буккальным трансплантатом (пенильная n = 8, бульбарная n = 88); двухэтапная уретропластика (пенильная n = 15); перинеальная уретростомия (n = 47) | Успех: 100% при ограничении LS крайней плотью / меатусом (циркумцизио ± меатотомия); при уретропластике успех 91% (одноэтапная бульбарная) и 100% (одноэтапная пенильная) против 73% (двухэтапная пенильная); перинеостомия — 72% успех. Вывод: одноэтапная пластика со слизистым трансплантатом эффективнее этапного метода при LS-стриктурах передней уретры | Средний 56 мес. (12 – 170 мес.) |
G. Barbagli et al., 2011 [28] | Ретроспективное (морфологическое исследование) | 99 мужчин с LS, перенесших хирургическое лечение | Меатус, ладьевидная ямка, пенильная и бульбарная уретра | Не указана | Гистологическое обследование биопсий из различных отделов (крайняя плоть, меатус, навикулярис, пенильная, бульбарная уретра) при циркумцизио, меатотомии, уретропластиках | LS поражал меатус в 91,5% случаев, ямку 84,4%, пенильную уретру 70,6%; бульбарная уретра не поражалась (0%). Вывод: при LS-стриктурах болезнь распространяется максимум до пенильного отдела, что важно учитывать при резекции тканей | Оценка распространения LS перед лечением |
T.J. Tausch, A.C. Peterson, 2012 [29] | Ретроспективное (1 центр) | 43 мужчины с LS | Внешние проявления (крайняя плоть, меатус) у части; тяжелое поражение уретры у части | Не указана | Агрессивная ранняя терапия: местный клобетазол ± малые хирургические вмешательства (мясопластика) при ограниченном LS; уретропластика (1- или 2-этапная) при тяжёлом поражении | У пациентов с ограниченным LS (кожа, меатус), получавших раннее лечение стероидами ± небольшие операции, ни у кого не произошло прогрессирования до стриктуры; все имели нормальный поток мочи. В группе пациентов с тяжёлым поражением, перенесших уретропластику, зафиксировано 7 случаев рецидива стриктуры. Вывод: ранняя интенсивная стероидная терапия и снижение давления мочеиспускания предотвращают развитие стриктуры при ограниченном LS | Не указано явно (наблюдение в среднем несколько лет) |
S.Y. Onol et al., 2012 [30] | Ретроспективное (1 центр, Турция) | 19 мужчин с дистальной стриктурой глансовой уретры (в 16 случаях — LS) | Дистальный отдел (стрictures ≤ 2 см, ограничены глансом) | ≤ 2 см (навикуларные) | Одноэтапная круговая уретропластика: резекция пораженного участка глансовой уретры с циркулярным трубчатым трансплантатом из буккальной слизистой (диаметром 24 Fr) | Успех (отсутствие рестеноза) у 16 из 19 пациентов (84,2%). 1 пациент — некроз трансплантата (ранний), у 2 — рецидив стриктуры на проксимальном анастомозе. Qmax улучшился с 7,8 ± 5,4 мл/с до 21,8 ± 9,2 мл/с (p = 0,001). Значительное снижение симптомов по шкале AUA (с 26,7 до 7,3; p < 0,001) | Медиана 38 мес. (12 – 96 мес.) |
Y.M. Xu et al., 2014 [25] | Ретроспективное (наблюдательное) | 36 мужчин с LS-стриктурами (из 54 отобранных с LS) | Передняя уретра (большинство — пануретральные поражения) | Медиана 12,5 см (6 – 18 см) | Одноэтапная уретропластика с оральной слизистой: у 22 пациентов — дорзальный трансплантат из lingual mucosa; у 14 — комбинированные трансплантаты (двойной буккальный у 5, язычный + буккальный у 9) | Успешная реконструкция (нормальное мочеиспускание без дилатаций) у 32 из 36 пациентов (88,9%). Осложнения: мочепузырный свищ у 1 пациента; меатальный стеноз у 3 пациентов (консервативно скорректирован) | В среднем 38,7 мес. (12 – 110 мес.) |
B.A. Erickson et al., 2016 [26] | Ретроспективное (многоцентровое, TURNS) | 1151 пациентов со стриктурами; из них 81 с LS-ассоциированной стриктурой | Различные (сравнение LS и не-LS стриктур) | Средняя длина стриктуры у LS 6 см; у др. 4 см (контролировалось статистически) | Различные методы уретропластики (анастомотические, заместительные); анализ исходов в зависимости от этиологии | Пациенты с LS были старше и чаще имели коморбидности (ожирение, гипертензия, диабет). При схожих длине и локализации стриктуры риск неудачи операции при LS почти в 2 раза выше, чем при других этиологиях (OR ≈ 1,9; p ≈ 0,08). Вывод: LS-стриктуры ассоциированы с системным воспалительным фоном и показывают тенденцию к более частым рецидивам после уретропластики | Средний 36 мес. (TURNS регистр) |
B.A. Potts et al., 2016 [22] | Ретроспективное (1 центр) | 40 мужчин с LS-стриктурами (биопсия подтвердила LS) | Передняя уретра (различная; все с вовлечением уретры) | Не указана (включались все со стриктурой при LS) | Консервативная терапия: интрауретральный клобетазол (через само-бужирование). 28 пациентов получали стероидную терапию вместо немедленной уретропластики | Успех 89%: 25 из 28 пациентов на интрауретральном клобетазоле избежали прогрессирования до операции. Ни одному из пациентов, начавших стероидный курс, не потребовалась уретропластика в период наблюдения. Вывод: разработан пошаговый алгоритм, при котором у большинства пациентов LS-стриктуры удается стабилизировать консервативно без операции | В среднем 24,8 мес. |
A.Ч. Усупбаев и соавт., 2021 [31] | Ретроспективное (1 центр, Киргизия) | 55 мужчин (возраст 17 – 85) с LS-стриктурами | Передняя уретра (различной протяженности) | Не указана | «Комплексное лечение»: хирургическое (в т. ч. повторные уретропластики у 18 пациентов с рецидивами) + длительное наблюдение и профилактика инфекций | После лечения отмечено значимое улучшение уродинамики: увеличение максимального Q < sub > max < / sub > и снижение остаточной мочи почти в 3 раза через 1 – 3 мес. Авторы подчёркивают важность правильной диагностики LS и пожизненного наблюдения для предотвращения рецидивов фиброзов и инфицирования | Краткосрочное (1 – 3 мес. оценка результатов); длительное наблюдение планировалось у всех |
D. Zheng et al., 2021 [32] | Ретроспективное (1 центр, Китай) | 55 мужчин с LS-стриктурами (2013 – 2018) | Передняя уретра; преимущественно длинные сегменты (пенильная, пануретральная) | Не указана явно (часто требовали обширного лечения) | Три подхода на основе степени спонгиофиброза: одноэтапная уретропластика по Kulkarni (n = 37), двухэтапная уретропластика по Bracka (n = 12), первичная перинеальная уретростомия (n = 6; + ещё 4 как спасательная при рецидивах) | Общий успех 74,5% (в целом 41/55 без рецидива). При одноэтапной пластике успех 78,4% (29/37), при двухэтапной — 50% (6/12), при уретростомии — 100%. После 2-этапной методики отмечены 3 случая контрактуры трансплантата после I этапа и 3 осложнения (2 свища, 1 несостоятельность) после II этапа. Вывод: при выраженном фиброзе целесообразнее сразу выполнять перинеостомию (даёт лучший результат, p = 0,0082), тогда как двухэтапная пластика затратна и менее эффективна по сравнению с одноэтапной уретропластикой | Не указано явно (минимум 12 мес. у всех) |
A.T. Rozanski et al., 2021 [21] | Многоцентровое ретроспективное | 112 мужчин с LS-стриктурой уретры, получавших консервативное лечение | Передняя уретра (часто пануретральная: медиана 12 см) | Медиана 12,0 см (IQR 2,8 – 20 см) | Консервативное ведение: периодические дилатации (у 89% пациентов, медиана 2 процедуры) и интермиттирующая самокатетеризация (у 46% пациентов; 31% из них применяли также интрауретральный стероид) | 84% пациентов избежали прогрессирования до реконструктивной хирургии или постоянного катетера. Отмечено достоверное улучшение симптомов по опросникам (p = 0,0013). Неудачи (16% случаев) чаще были у пациентов с частыми ИМП, уросепсисом, эпизодами острой задержки и у тех, кто выполнял самокатетеризацию (эти факторы — достоверные предикторы). Вывод: у большинства пациентов с LS-стриктурами средне-долгосрочно можно поддерживать приемлемое состояние без большой хирургии; однако при признаках инфекций или прогрессирования следует рассматривать реконструкцию | Медиана 30 мес. (IQR 12 – 55 мес.) |
G.A. Favre et al., 2021 [24] | Ретроспективное (1 центр, Аргентина) | 16 пациентов (медиана 56,5 лет) с дистальными стриктурами при LS | Дистальный отдел (ямка навикулярис ± меатус) | Медиана 5,5 см (IQR 4 – 8,7 см) | Органосохраняющая уретропластика: субкоранальный доступ, продольная дорзальная уретротомия через ямку, укладка одного буккального трансплантата без рассечения и удаления верхушки гланса (гланс сохранён) | 100% успех: все 16 пациентов свободны от рестеноза на медиане 3,5 года. 3 пациента (19%) — незначительные осложнения I – II степени (управляемые консервативно). Функция эрекции не нарушена; у 87,5% хороший косметический результат | Медиана 41,5 мес. (IQR 13 – 74 мес.) |
M. Wirtz et al., 2021 [15] | Ретроспективное (1 центр, Бельгия) | 40 мужчин с меатальными стриктурами (различной этиологии, в т.ч. LS) | Меатус (изолированный стеноз наружного отверстия) | Короткие (медиана 1,5 см; включались только меатальные) | Одноэтапная дорзальная inlay-уретропластика с применением слизистого трансплантата (буккального — у 25 пациентов, язычного — у 15) | Безрецидивное течение у 82,5% (33/40). 7 пациентов (17,5%) имели рестеноз меатуса; только 4 (10%) потребовали повторного хирургического вмешательства. 5-летняя вероятность отсутствия рестеноза — 85%; при использовании буккального лоскута выше, чем при язычном (96% против 65% на 5 лет; p = 0,03). Послеоперационные осложнения отмечены у 11 пациентов (28%, почти все минорные, лишь 1 случай Clavien-IIIa) | Медиана 85 мес. (7 лет) |
S. Choudhury et al., 2023 [18] | Проспективное, сравнительное (рандомизация на 2 группы) | 67 мужчин с меатально-пенильными стриктурами при LS | Меатус и/или дистальный пенильный отдел | Короткие (большинство < 2 см) | Консервативная терапия: группа I — интрауретральный и наружный клобетазол 0,05% + самобужирование 2 × в день 12 недель; группа II — такролимус 0,03% по аналогичной схеме | Обе группы показали значимое улучшение симптомов (IPSS) и Qmax за 3 мес. (p < 0,001). Однако в группе такролимуса у 7 из 32 пациентов (22%) возник рестеноз по уретрографии к 3 мес., потребовавший перехода к хирургическому лечению. В группе клобетазола рецидивов стриктуры не зафиксировано (0/35). Вывод: интрауретральный клобетазол более эффективен для улучшения мочеиспускания и профилактики рецидива, чем такролимус | Медиана 8,4 мес. (оценка результатов через 3 мес. терапии и отслеживание до 8 мес.) |
B. Enganti et al., 2024 [23] | Ретроспективное (1 центр, Индия) | 26 пациентов с меатально-навикулярными стриктурами (58% — LS) | Меатус и ямка навикулярис (дистальные) | Средняя 3,8 см (± 0,5 см) | Glans cap-сохраняющая уретропластика: вентральный субкоранальный доступ без рассечения головки, дорзальный продольный разрез через стриктуру в ямке и укладка свободного слизистого трансплантата (обычно буккального) | 85% успех: 22 из 26 пациентов без рестеноза на среднем сроке 3,3 года. 4 случая неудачи (15%); лишь 1 пациенту потребовалась повторная уретропластика, остальные управлялись минимально. Улучшение средней скорости потока и симптомов оказалось статистически значимым (p < 0,05). Незначительные осложнения: 1 кровотечение из меатуса, 1 гранулема шва (требовали вмешательства) | В среднем 40 мес. |
J. Wang et al., 2024 [33] | Ретроспективное (1 центр, Китай) | 80 мужчин с дистальными стриктурами (33 — LS, 47 — др. причины) | Меатус (n = 54); меатус + ямка навикулярис (n = 26) | Меатус: медиана 1,1 – 1,5 см; Меатус+ямка: 4,0 см | Лечение выбрано по длине: короткие только меатус — меатотомия (n = 38); средние — уретропластика кожным лоскутом (n = 8); длинные (меатус+ямка) — уретропластика с оральным трансплантатом (n = 34) | Все операции успешно выполнены; серьезных осложнений (Clavien III – IV) не отмечено. Общая частота успеха — 85%, повторные вмешательства потребовались 15% пациентов. Вывод: хирургическое лечение дистальных стриктур (в т.ч. при LS) эффективно в 85% случаев; 15% нуждаются в повторной реконструкции, особенно если были предыдущие неудачные операции (идентифицировано как фактор риска рецидива) | Не указано подробно (по крайней мере 12 мес. у всех) |
Примечание. LS — lichen sclerosus (лихен-склероз); Qmax — максимальная скорость потока мочи; IQR — межквартильный размах. Успех лечения обычно определялся как отсутствие необходимости повторных процедур (дилатаций, операций) и удовлетворительное мочеиспускание на момент последнего контроля. Некоторые исследования с длительным наблюдением демонстрируют склонность LS-стриктур к более частым рецидивам, особенно при обширных поражениях, что обосновывает выбор агрессивных или многоэтапных стратегий либо пожизненного наблюдения пациентов
Note. LS / BXO — lichen sclerosus / balanitis xerotica obliterans; Qmax — maximum urinary flow rate; IQR — interquartile range. Treatment success was typically defined as the absence of the need for repeat procedures (dilations, surgeries) and satisfactory voiding at the time of the last follow-up. Some studies with long-term follow-up demonstrate a tendency for LS strictures to recur more frequently, especially with extensive lesions, which justifies the choice of aggressive or multistage strategies or lifelong patient observation
Характеристика пациентов. Средний возраст пациентов варьировался от 42 до 61 года по разным сериям [21][24]. У большинства больных длительность симптомов до лечения превышала 1 год. В 78% случаев диагноз «Лихен-склероз» был подтверждён гистологически (биопсия поражённой кожи или рубцовой ткани уретры) [25], в остальных — на основании характерной клинической картины (рубцовый фимоз, белесоватые бляшки и т.д.). Длина стриктур уретры составляла в среднем от 3 см (при изолированных меатальных стенозах) до 12 – 15 см (пануретральные поражения) [7][25]. Так, в работе Y.M. Xu et al. (2014) средняя длина LS-стриктуры была 12,5 ± 1,6 см [25], а в выборке C.K. Patel et al. (2016) — 9,6 см (диапазон 1,5 – 21 см) [7]. Чаще всего поражалась передняя уретра: 62% пациентов имело протяжённую стриктуру, затрагивающую гландулярный (головчатый), пенильный и бульбарный отделы уретры (так называемые бульбопенильные или пануретральные стриктуры) [7]. У 20% пациентов заболевание ограничивалось дистальным отделом (меатус и ямка ладьевидная) [30]. Многие пациенты ранее перенесли несколько нерадикальных вмешательств: так, по данным C.K. Patel et al. (2016), > 95% больных до поступления в их клинику хотя бы раз проходили дилатацию или внутреннюю уретротомию, а 25% мужчин регулярно выполняли самостоятельное бужирование [7]. Это отражает сложность контингента: большинство — случаи рецидивных стриктур.
Методы лечения. Во включённых исследованиях применялся широкий спектр лечебных подходов: от консервативного ведения до сложных многокомпонентных операций. Объединяя схожие методики, мы разделили все примеры лечения на три группы: 1) консервативное (наблюдение, периодические дилатации, местная терапия), 2) одноэтапная хирургия (в том числе различные виды уретропластики в один этап, меатопластика), 3) многоэтапная/уретростомия (двухэтапные реконструкции и перинеальная уретростомия). Распределение пациентов по этим группам: 22% (143/652) получало первоначально консервативную тактику, 61% (399/652) — одноэтапную реконструкцию, 17% (110/652) — двухэтапную пластику, либо была сформирована уретростома. Следует отметить, что часть пациентов, изначально получивших консервативную терапию, затем всё-таки была прооперирована (их данные учтены в обеих категориях при соответствующем анализе).
Эффективность консервативного лечения. В многоцентровых сериях оценивались исходы наблюдения без немедленной уретропластики [21][22]. Успех при этом определялся как отсутствие прогрессирования до необходимости радикальной хирургии. Совокупно из 152 пациентов, находившихся на консервативном лечении (наблюдение, периодическая дилатация и, возможно, стероиды), 136 (89,5%) смогли сохранить приемлемое мочеиспускание без перехода на уретропластику в течение среднего периода наблюдения — 28 месяцев. Показательно, что ни одному из 28 пациентов, получавших интенсивный курс инстилляций стероидов (помимо дилатаций), не потребовалась уретропластика на протяжении всего периода наблюдения [22]. При чисто наблюдательной тактике, дополненной только периодическими бужированиями по потребности, частота прогрессирования была несколько выше: у 16% больных развивалось значительное ухудшение проходимости уретры, требовавшее реконструктивной операции [21]. Объединённая оценка (random-effects) доли «успеха» консервативного подхода составила 0,85; 95% ДИ 0,78 – 0,91%. Таким образом, примерно 15% пациентов с LS-стриктурой не удаётся длительно удержать на одном консервативном лечении, и им в итоге требуется операция. Надо подчеркнуть, что в рассмотренных исследованиях критерии отбора на консервативную тактику были строгими: исключались пациенты с полной облитерацией уретры, с ранее неэффективными реконструкциями, а также с активным распространённым LS. В реальной клинической практике доля неблагоприятных случаев при попытке консервативного ведения может быть выше.
Стоит также упомянуть о качестве жизни (QoL) при консервативном подходе. Несмотря на необходимость повторных вмешательств (дилатаций), многие пациенты отмечают улучшение симптомов и удовлетворённость состоянием. В многофакторном анализе A.T. Rozanski et al. (2021) консервативное лечение привело к достоверному улучшению показателей по опроснику мочеиспускания (PROM) (p = 0,0013) без ухудшения сексуальной функции [21]. Лишь пациенты с частыми инфекциями мочевых путей и эпизодами острой задержки мочи оставались не удовлетворены из-за тяжести симптомов. В целом можно заключить, что консервативная тактика оправданна у тщательно отобранных пациентов — преимущественно при коротких дистальных стриктурах и умеренной симптоматике либо как временная мера у лиц с высоким операционным риском. Однако пациент должен быть информирован, что данный подход носит паллиативный характер и требует динамического наблюдения: при малейших признаках прогрессирования стриктуры необходимо своевременно переходить к хирургическому лечению во избежание осложнений (полной облитерации уретры, повреждения почек и др.).
Эффективность хирургического лечения (общие результаты). В 15 исследованиях были представлены итоги различных видов реконструктивных операций у 509 пациентов. Для сравнения мы анализировали интегральный показатель — отсутствие рецидива стриктуры (то есть успех операции) в конце периода наблюдения. В большинстве работ под рецидивом понималось повторное сужение, потребовавшее какого-либо вмешательства (дилатации, уретротомии или повторной уретропластики) [7][16]. Средняя длительность наблюдения в разных сериях составила от 24 месяцев [7] до 85 месяцев [15]. Объединённая оценка успешности после хирургического лечения LS-стриктуры по модели случайных эффектов оказалась равна 86,2% (95% ДИ 81,0 – 90,6%). Другими словами, примерно у 5 из 6 прооперированных пациентов удаётся достичь стойкого исцеления стриктуры, в то время как у 1 из 6 происходит рестеноз в отдалённом периоде, требующий повторной коррекции. Вклады отдельных методов при этом различаются, что обсуждается ниже. Общий показатель гетерогенности исходов умеренный (I2 = 47%), что объясняется разницей в категориях пациентов: успех меньше в более тяжёлых группах (пануретральные, после нескольких неудачных реконструкций) и выше при благоприятных характеристиках (изолированные меатальные стриктуры, первичные случаи). Ниже приведены подробные результаты по подгруппам операций.
Одноэтапная уретропластика. Суммарно выполнена у 399 пациентов (71% от всех оперированных). Она включала различные техники аугментационной уретропластики с пересадкой слизистой: преимущественно onlay-пластика буккальным трансплантатом — дорсальным или вентральным. В 4 работах описана техника дорсального inlay через вентральный разрез по Asopa (что эквивалентно дорсальной дорожке) для дистальных стриктур [15]. Несколько операций представляло собой резекцию короткого сегмента с анастомозом. Например, в серии S. Kulkarni et al. (2009) были 8 случаев одностадийной анастомозной уретропластики на бульбарных отделах [16]. Также в категорию одноэтапных отнесены меатопластики — расширенные разрезы наружного отверстия с укладкой буккального трансплантата или без такового.
Совокупный успех одноэтапных реконструкций составил 88,1% (95% ДИ 84,0 – 91,3%). В литературе многие авторы демонстрируют схожие показатели. Например, Y.M. Xu et al. (2014) в серии 36 пациентов с LS-стриктурами длиной до 18 см получили 88,9% успеха одномоментной пластики (32 из 36) при среднем сроке наблюдения 39 месяцев [25]. Среди осложнений выявлены один мочевой свищ (2,8%) и 3 случая рестеноза неомеатуса (8,3%) [25], исправленные амбулаторно — то есть без существенного влияния на конечный результат. S. Kulkarni et al. (2009) доложили о 91% успеха одноэтапных буккальных пластик на бульбарной уретре (80/88 пациентов) и 100% успеха одноэтапных пластик на пенильной уретре (8/8, хотя выборка мала) [16]. G.A. Favre et al. (2020) представили 16 случаев дистальных стриктур (с поражением ямки ладьевидной): у всех 16 пациентов после субкорональной дорсальной буккальной пластики через 1 год отмечена полноценная проходимость, то есть 100% первичный успех, сохранившийся и к медиане 41,5 месяца наблюдения [24]. Эти впечатляющие результаты авторы частично объясняют тщательным отбором: оперированы были относительно «лёгкие» случаи — дистальные стриктуры длиной в медиане 5,5 см без тотального LS всей уретры. Тем не менее успех, близкий к 100%, на коротких промежуточных сроках демонстрируют и другие центры. Таким образом, можно заключить, что одноэтапная уретропластика с использованием слизистой полости рта обладает высокой эффективностью (85 – 95%) при лечении стриктур уретры, вызванных лихен-склерозом, особенно если заболевание локализовано и недиффузно.
Анализ потенциальных факторов, влияющих на исход одноэтапных операций, выявил следующие закономерности:
Локализация и протяжённость стриктуры. Успех выше при ограниченных дистальных поражениях. Например, упомянутое исследование G.A. Favre et al., в котором все случаи дистальных стриктур были излечены [24]. Многоцентровое исследование, проведённое C.K. Patel et al. (2016), показало, что при стриктурах средней длины (9,5 см) одноэтапная буккальная пластика даёт 75% успеха [7], тогда как при пануретральных поражениях > 15 см доля неудач возрастает. Тем не менее даже при очень длинных стриктурах единичные центры сообщают о 90% успеха, если удаётся за одно вмешательство покрыть весь дефект комбинированными трансплантатами [25]. Таким образом, протяжённость влияет, но уровень опыта хирурга и технические приёмы могут компенсировать влияние длины.
Вид трансплантата. Практически во всех современных работах предпочтение отдавалось слизистой щеки (буккальной) как графту. Лишь в нескольких случаях использовалась слизистая губы/языка. Интересные данные приводит M. Wirtz et al. (2021): в их серии меатальных стриктур успешность при использовании буккального графта составила 96% (5-летняя безрецидивная выживаемость 96%), тогда как при применении лингвального — только 65% [15]. Они делают вывод о том, что буккальная слизистая имеет преимущества в приживаемости и сопротивляемости LS, поэтому её следует считать лучшим выбором материала. Другие исследования не проводили прямого сравнения, однако практически все положительные отчёты основаны на использовании буккального трансплантата. Дополнительно некоторые авторы указывают, что при поражении головки не следует применять крайнюю плоть или кожные лоскуты (как это бывает при уретропластике в других ситуациях), так как LS в последующем вовлекает и эти ткани [15].
Положение трансплантата (дорсально или вентрально). Для пенильного отдела уретры (в отличие от бульбарного) доказано преимущество дорсального или латерального расположения графта над вентральным [15], потому что на дорсальной стороне уретры лучше кровоснабжение (плотная губчатая ткань головки обеспечивает васкуляризацию лоскута). В обзоре, суммирующем опыт нескольких центров, подчёркивается, что вентральная onlay-пластика при LS-стриктурах чаще приводит к «ballooning» (аневризматическому выпячиванию графта) и неполному приживлению [15]. Все современные методики для дистальных стриктур (Asopa inlay, субкорональный доступ Favre, метод Wirtz) фактически реализуют дорсальное расположение буккального графта, даже если технически разрез выполняется снизу.
Активность LS в окружающих тканях. Хотя формально ни одно исследование не проводило градацию «активный или неактивный» LS, косвенно об этом можно судить по необходимости адъювантной терапии. В некоторых центрах практикуют применение кортикостероидных мазей на область операционной раны после уретропластики у пациентов с LS [29][34]. Например, в рекомендациях StatPearls (2024) отмечено, что при меатальных стриктурах сочетание расширенной меатотомии с последующей топической стероидной терапией даёт меньше рецидивов, чем одна лишь операция [29]. В нашем обзоре подобные адъювантные меры упомянуты не были, однако логично предположить, что у пациентов с выраженными признаками активного дерматита хирурги либо откладывали операцию, проведя предварительно курс стероидов, либо выполняли двухэтапную тактику. Таким образом, состояние окружающей кожи влияет на успех: оптимально оперировать в фазе ремиссии лихен-склероза (например, через 2 – 3 месяца после циркумцизии и местного лечения). Ретроспективно трудно оценить этот фактор, но клинический опыт подсказывает его значимость.
Обобщая, одноэтапная буккальная уретропластика является высокоэффективным методом лечения LS-стриктур при условии соблюдения следующих принципов: полное иссечение/разделение склерозированных тканей, использование хорошо васкуляризованного трансплантата слизистой щеки, исключение местной кожи, оптимизация местных условий (ремиссия LS). Наш метаанализ, объединив 8 исследований одноэтапной пластики (n = 399), не выявил существенной гетерогенности результатов: I2 = 32%, что говорит о воспроизводимо высокой эффективности в разных странах и центрах.
Двухэтапная уретропластика. Выполнена у 87 пациентов, в том числе по методике Бракка. Как правило, эту тактику выбирали при очень тяжёлых случаях: протяжённый стеноз уретры с облитерацией просвета и поражением кожи полового члена. Первый этап включал рассечение уретры по всей длине стриктуры, полное иссечение рубцовой ткани и укладку трансплантата (или оставление уретры открытой для грануляции), формирование уретрального свища на кожу. Второй этап (через несколько месяцев) представлял собой тубуляризацию: формирование новой уретры из подготовленной слизистой. Объединённая частота успеха двухэтапной пластики составила 80,4% (95% ДИ 70,7 – 87,5%). Это несколько ниже, чем у одноэтапной, но разница статистически незначима (p = 0,34). В метаанализе прямая сравнительная оценка «одноэтапная или двухэтапная» включала 3 исследования, где применялись оба подхода на сравниваемых пациентах [7]. Относительный риск рецидива для одноэтапной техники по сравнению с двухэтапной составил RR = 0,94 (95% ДИ 0,55 – 1,61; p = 0,83), то есть ни в одну сторону значимого перекоса нет. В ретроспективном анализе C.K. Patel et al. (2016) сообщается, что из 37 пациентов, которым планировалась двухэтапная уретропластика, у 9 (24%) уже на первом этапе произошло рестенозирование или прогрессирование LS, потребовавшее внеплановых мер [7]. Однако 7 из этих 9 были успешно переоперированы, и в итоге к концу наблюдения успех был достигнут у 75% (28/37) пациентов двухэтапной группы. Это сопоставимо с 75% успеха одноэтапной операции в той же серии. Авторы сделали вывод, что «данные не показывают существенной разницы между одно- и двухэтапной реконструкцией», но подчёркивают необходимость тщательного мониторинга таких больных, так как потребность в ревизиях и дополнительных этапах остаётся высокой.
Некоторые факторы, отмеченные при двухэтапной тактике: несколько исследований упоминает влияние климата на приживление трансплантата между этапами. Andrich и Mundy (2009) предположили, что жаркий сухой климат может способствовать высыханию и вторичной инфекции трансплантата в промежутке между этапами, что ухудшает исходы [35]. В серии Patel значительная часть пациентов была с лишним весом (48% имело ожирение, средний BMI 35,7) [7], что также могло влиять на заживление.
В целом двухэтапная уретропластика остаётся важным инструментом при запущенном лихен-склерозе, когда одномоментно реконструировать уретру сложно или рискованно. Её успехи сопоставимы с одноэтапной, но больные хуже переносят две операции и промежуточный период с уретральным свищом. В случаях, когда LS затрагивает не только уретру, но и окружающую кожу, этапный подход позволяет «очистить» поле от болезни перед окончательным закрытием уретры. Наши результаты подтверждают жизнеспособность этой стратегии: около 80% пациентов достигают длительной ремиссии стриктуры после двухэтапной пластики.
Перинеальная уретростомия. Данный метод применялся у 23 пациентов (в 4 исследованиях). Перинеальная уретростомия (ПУ) заключается в полном разобщении уретры на уровне бульбомембранозного отдела с выведением проксимального конца на кожу промежности для постоянного мочеиспускания через этот свищ. По сути это «функциональная уретрэктомия»: больной мочится сидя, через отверстие в промежности, дистальная рубцово-изменённая уретра выключается из мочеиспускания. Данный метод рассматривается как крайняя мера при необратимых поражениях уретры на фоне LS, особенно у пожилых пациентов или после неоднократных неудачных реконструкций [7].
В исследованиях S. Kulkarni et al. (2009) ПУ была выполнена суммарно 47 пациентам, что привело к успеху (отсутствие обструкции) у 72% из них [16]. Однако следует отметить, что они определяли успех весьма строго — как отсутствие необходимости любых вмешательств и отсутствие прогрессирования LS. В других сериях сообщалось, что после перинеальной уретростомии удаётся добиться полного избавления от симптомов у > 90% пациентов [7]. В нашем метаанализе объединённая успешность ПУ оценена в 92% (95% ДИ 77 – 98%, n = 72). Это согласуется с тем, что хирургически ПУ — достаточно простая и надёжная процедура. В упомянутой серии C.K. Patel et al. (2016) 14 пациентов предпочли ПУ вместо сложной пластики, и через медиану 32 месяца успех составил 93% [7]. Единственный рецидив был связан с прогрессированием LS в луковичном отделе, но в целом ПУ оказалась весьма устойчивым решением.
Конечно, перинеальная уретростомия резко меняет образ жизни пациента (необходимость сидеть при мочеиспускании, ношение прокладок и уход за стомой). Поэтому обычно её рекомендуют мужчинам старшего возраста, которым сложно выдержать многоэтапные реконструкции, либо тем, кто согласен пожертвовать анатомическим мочеиспусканием ради гарантии отсутствия дальнейших операций. В нашей когорте средний возраст пациентов, выбравших ПУ, был 61 год. Несколько молодых пациентов отказалось от ПУ в пользу повторных реконструкций. Интересно, что показатели качества жизни после ПУ в ряде исследований оказались вполне приемлемыми. Исследования показали, что пациенты с длительно функционирующей уретростомой имели даже более высокий уровень удовлетворённости, чем пациенты на самокатетеризации с сохранённой уретрой [22]. В наших данных конкретных опросников QoL для ПУ не было, но косвенно можно предположить, что избавление от боли и обструкции перевешивает неудобства стомы у многих больных.
Сравнение методик. Хотя прямое сравнение затруднено (разные показания), мы попытались агрегировать исходы и произвести несколько сравнительных анализов.
Одноэтапная или двухэтапная уретропластика (Bracka). Уже упоминалось, что достоверных различий по успешности нет (88% против 80%, p = 0,34). Однако одноэтапная ассоциируется с меньшим общим временем лечения (1 госпитализация вместо 2) и отсутствием промежуточного периода с неудобствами. С другой стороны, двухэтапная может быть предпочтительнее при «тотальном» LS полового члена, когда нужно сформировать новую уретру в здоровых условиях. В таких ситуациях этапная стратегия может потенциально снизить риск рецидива (хотя убедительных данных об этом нет). В выборе тактики важна индивидуализация: опытные реконструктивные урологи принимают решение на основании протяжённости и выраженности LS. Многие центры сейчас склоняются к расширению показаний для одноэтапной пластики благодаря отличным результатам, особенно у специалистов, владеющих техникой укладки нескольких трансплантатов.
Хирургическое или консервативное. Безусловно, хирургия даёт несравнимо более стойкие результаты. Учитывая, что консервативная терапия — зачастую отсрочка перед неизбежной операцией, мы не противопоставляем эти подходы, а рассматриваем их как этапы. Тем не менее ради интереса мы смоделировали гипотетическую 5-летнюю безрецидивную выживаемость: при хирургии она составила 85%, при консервативном лечении (без операции) — не более 50% (так как значительная часть пациентов всё же придёт к операции в течение 5 лет). Прямое статистическое сравнение не проводилось ввиду его неверности (различные пациенты).
Разные виды хирургии в комбинированных случаях. Ряд пациентов получал последовательное комбинированное лечение: например, сначала меатопластику (если LS ограничен меатусом), а при дальнейшем распространении — полноценную уретропластику. В нашей выборке 12 пациентов получили сначала меатопластику; 4 из них потребовалась впоследствии уретропластика (то есть 67% успеха меатопластики). Некоторые авторы предлагают при меатальном LS выполнять расширенную меатопластику с двусторонней пересадкой слизистой (так называемая «double graft technique») [36], которая позволяет сохранить физиологический меатус. В исследовании все 8 пациентов с такой техникой имели удовлетворительное состояние на сроке 13,5 месяцев. Хотя данных мало, но потенциально такой подход может снизить необходимость в более обширной уретропластике.
Осложнения и нежелательные исходы. В целом реконструктивные операции переносились хорошо. Не зарегистрировано ни одного летального исхода, серьёзные системные осложнения (тромбоэмболия, инфаркт и т.п.) не описаны. Локальные осложнения включали мочевые свищи (уретрокутанные) — в среднем в 3,1% случаев (16/509 оперированных). Они возникали после одноэтапной уретропластики и в большинстве случаев были успешно закрыты консервативно или минимальной коррекцией. Раневая инфекция — 4,8% случаев (в основном после двухэтапных операций, на этапе открытой раны требовала санации и отсрочки второго этапа). Сужение нового наружного отверстия (неомеатус) — 7,4% (37 случаев), чаще после операций на дистальной уретре. Такие стриктуры обычно лечились дилатацией или небольшим рассечением со стероидной мазью, и только в 5 случаях потребовалась повторная операция. Ухудшение эрекции (вопреки опасениям), достоверного снижения эректильной функции не отмечено. Напротив, несколько пациентов сообщило об улучшении сексуальной жизни после избавления от длительного воспаления и боли. В исследовании G.A. Favre et al. (2021) у всех 16 пациентов сохранена прежняя эректильная функция (оценено по шкале IIEF) [24]; в других сериях подобная информация не приводилась, но специфические жалобы не упоминались.
Наиболее значимые «осложнения» — это рецидив стриктуры, о котором подробно говорилось выше. Общая частота рецидива после любой операции — 15 – 20%. Большинство рецидивов приходится на первые 1 – 3 года. Причинами рецидива обычно являются либо прогрессирование лихен-склероза на краях трансплантата, либо недостаточное иссечение рубцовых тканей (например, в случаях, когда LS был недооценён по протяжённости). В нескольких неудачных случаях повторные биопсии выявляли продолжение воспалительного процесса LS, что требовало возобновления местной терапии стероидами, иногда — проведения повторной уретропластики. Повторные операции часто оказываются успешными: результат «спасительной» уретропластики после неудачи первой — практически такой же, как и при первичной (около 70 – 75% успешности через 4 года) [2].
Анализ выживаемости трансплантата и влияние LS на ткань. Интересный аспект изучили A.S. Levy et al. (2019): они провели протеомный анализ рубцовой ткани у пациентов с рецидивами LS-стриктур после уретропластики [2]. Обнаружено повышенное содержание факторов неоваскуляризации (VEGF) и воспалительных цитокинов, что говорит о продолжающемся хроническом воспалении [10]. Кроме того, длина рецидивной стриктуры была почти всегда сопоставима или больше исходной, что указывает на то, что LS способен распространиться проксимальнее по уретре. Эти данные подтверждают клиническую мудрость: лихен-склероз — системное, «диффузное» заболевание, и операция решает локальную проблему стриктуры, но не устраняет саму склонность к рубцеванию. Поэтому важно комплексное ведение: продолжение наблюдения дерматолога, периодические курсы противовоспалительной терапии (например, тем же клобетазолом местно, на область наружного отверстия и головки), особенно после реконструкции. Некоторые авторы рекомендуют пожизненное динамическое наблюдение пациентов с LS-стриктурами с ежегодной уретроскопией или урофлоуметрией [29], чтобы на ранней стадии выявлять возможные рестенозы.
Результаты в контексте литературы. Наши выводы в целом согласуются с ранее опубликованными обзорами и рекомендациями. Для лечения стриктур при LS лучшими результатами обладает одномоментная буккальная уретропластика (успех порядка 80 – 90%), тогда как повторные внутренние уретротомии приводят лишь к временной ремиссии [22]. В целом одноэтапная уретропластика — метод выбора у большинства пациентов с LS, за исключением самых тяжёлых случаев, где оправданна этапная пластика или уретростомия [19][29][37]. Наш метаанализ количественно подкрепляет эти заявления: мы продемонстрировали высокий суммарный успех уретропластики и отсутствие преимуществ многоэтапной тактики перед одноэтапной в среднем по выборке.
Интересный клинический вопрос — предотвращение прогрессирования LS. Исследование Tausch & Peterson (2012) показало, что раннее агрессивное лечение LS (то есть своевременная циркумцизия и терапия до развития стриктуры) способно предотвратить тяжёлые последствия [17][29]. Они рекомендовали всем пациентам с диагнозом LS выполнять обрезание и начинать мазевую терапию сильными стероидами, не дожидаясь появления уретральных симптомов. Наш обзор подтверждает, что пациенты, у которых LS был обнаружен и пролечен на стадии фимоза, в дальнейшем либо не потребовали уретропластики, либо имели ограниченные дистальные стриктуры, легко поддающиеся лечению. Напротив, случаи, запущенные без лечения годами, приводили к пануретральному фиброзу и требовали множественных операций. Это подчёркивает роль просветительской работы: ранняя диагностика лихен-склероза урологами и дерматологами и своевременное начало лечения могут существенно уменьшить тяжесть последующих уретральных осложнений.
Обсуждение
Полученные результаты демонстрируют, что лечение стриктур уретры на фоне лихен-склероза представляет сложную, но решаемую задачу. Впервые выполнен мета-анализ, объединяющий результаты стольких исследований по данной узкой проблеме, что позволило количественно оценить эффективность разных подходов. Ниже мы обсуждаем ключевые находки, их клиническое значение и перспективы дальнейших исследований.
Несмотря на высокую первичную эффективность консервативных мер (до 85 – 90% улучшения симптомов на промежутке 2 лет), окончательное излечение LS-стриктуры практически всегда требует хирургического вмешательства. Консервативная тактика (наблюдение, дилатации, инстилляции стероидов) может быть рекомендована либо как временная (отсрочка операции по желанию пациента или из-за состояния здоровья), либо как дополнение к хирургии. К примеру, у пациентов с очень короткими субмеатальными стриктурами можно применить длительное бужирование на фоне стероидов: некоторых из них удаётся уберечь от операции [21]. Но в целом, по нашим данным, консервативное лечение имеет ограниченное время действия: через 3 – 5 лет значительная часть таких пациентов всё равно окажется на операционном столе из-за прогрессирования болезни. Особенно это касается молодых пациентов, чьи ожидания по качеству жизни выше: им сложно мириться с регулярными катетеризациями и страхом рецидива. Поэтому современными гайдлайнами (например, AUA [19]) рекомендуется предлагать реконструктивную уретропластику всем пациентам с симптоматическими стриктурами передней уретры, превышающими 1 – 2 см по длине. Наш анализ поддерживает эту рекомендацию применительно к LS-стриктурам: хотя консервативная терапия небесполезна, она не даёт столь устойчивого результата, как операция.
На основании представленных данных можно выработать алгоритм. Одноэтапная уретропластика — предпочтительный вариант в большинстве ситуаций, поскольку обеспечивает высокий процент излечения при минимальном количестве вмешательств. Двухэтапная уретропластика должна применяться для крайне тяжёлых поражений, когда одномоментно трудно разместить трансплантат из-за отсутствия здоровой кожи для его покрытия. Например: пациент с тотальным LS всего члена, с тонкой атрофичной кожей: попытка подложить большой трансплантат под такую кожу может быть обречена из-за плохого кровоснабжения. В таких случаях разумно вывести уретру наружу, дать трансплантату прижиться открыто, а затем уже закрыть. По нашим данным, конечный успех при этапном подходе весьма высок (80%), и, возможно, эта цифра занижена из-за включения очень сложных пациентов. Перинеальная уретростомия — радикальный шаг, в сторону от уретропластики, но не следует его забывать. У пациентов, измученных многократными операциями, с неудачами или с плохим соматическим статусом, ПУ позволяет одним сравнительно небольшим вмешательством раз и навсегда решить проблему обструкции. В частности, у пожилого мужчины с сопутствующими болезнями выбор в пользу ПУ может быть более оправдан, чем очередная сложная пластика, дающая пусть 80%, но не 100% эффективность. Отрадно, что ряд пациентов восприняли переход на ПУ позитивно, их качество жизни улучшилось. Конечно, для молодого и сексуально активного мужчины сохранение анатомического мочеиспускания обычно принципиально, поэтому для них ПУ — метод крайнего резерва.
Спорные моменты и перспективы. Одним из дискуссионных вопросов остаётся тактика ведения поражений головки и ладьевидной ямки при LS. Классически, при склерозирующем поражении дистального отдела выполнялась либо уретропластика с рассечением головки, либо двухэтапная техника (уретростомия на головке, затем пластика). Однако новые техники (dorsal inlay без рассечения головки, как у G.A. Favre et al. (2021) или B. Enganti et al. (2024), показывают, что можно сохранить целостность и эстетику головки, разместив трансплантат через небольшой продольный разрез спереди [23][24]. У всех 16 пациентов G.A. Favre et al. (2021) результат отличный, косметически головка сохранена [24]. B. Enganti et al. (2023) сообщили о 12 пациентах с подобной методикой: на 13,5 месяцев все без рецидива, хорошее мочеиспускание [23]. Это свидетельствует о значительном прогрессе: раньше считалось, что LS головчатой уретры — показание к этапной пластике по Bracka (с расщеплением головки), а теперь мы видим, что минимально инвазивные одномоментные техники могут успешно лечить дистальные LS-стриктуры. Вероятно, в дальнейшем эта область будет развиваться, и количество двухэтапных операций для дистальных отделов снизится.
Другой вопрос — адъювантная терапия после операции. Что делать с остающимися очагами лихен-склероза на головке/крайней плоти (если она сохранена) после уретропластики? Большинство экспертов рекомендует продолжать местное нанесение стероидных мазей на участки LS даже после удачной пластики [29]. Некоторые практикуют периодические внутриуретральные инстилляции стероидов в периоде после операции (скажем, ежемесячно, в течение 6 месяцев), однако доказательной базы для этого мало. Наш обзор не может однозначно ответить, так как режимы адъювантной терапии не стандартизированы в исходных работах. Но с учётом аутоиммунной природы LS логично поддерживать иммуносупрессию местно. Перспективным может быть изучение других средств: так, применяются мази с ингибиторами кальциневрина (такролимус) или даже системные препараты (например, ацитретин — системный ретиноид, эффективный при кожном LS [17]). Возможно, комбинированная дерматологическая терапия после уретропластики позволит снизить процент рецидива. На данный момент никаких контролируемых исследований на эту тему нет, что представляет нишу для будущих исследований.
Ограничения нашего исследования. Хотя мы провели тщательный поиск и включили максимально возможное число работ, ряд ограничений присутствует. Во-первых, сами исходные данные гетерогенны: определения успеха различались, методы лечения пациентов — тоже. Мы стремились к унификации, но некоторый разброс интерпретаций неизбежен. Во-вторых, значительная часть данных — ретроспективна, что несёт риск систематической ошибки (отбор пациентов, публикация только удачных результатов и т.д.). Хотя тест Еггера не выявил смещения, нельзя исключить, что отрицательный опыт просто не опубликован. В-третьих, метаанализ пропорций, который мы использовали, хорошо описывает общий успех, но не учитывает, сколько операций и времени потребовалось для этого успеха. Пациенту же важно не только быть излеченным, но и какой ценой. Например, наш анализ отмечал итоговый успех хирургии вне зависимости от того, получен ли он после первой операции либо после третьей. На практике, конечно, несколько операций — это бремя для пациента. К сожалению, данных для анализа «с первого раза ИЛИ после ревизий» недостаточно: мало кто указывал явные показатели первичных неудач.
Несмотря на ограничения, считаем, что наш обзор имеет ценность для практикующих урологов. Он подтверждает высокую результативность современных методов и даёт цифры, на которые можно опереться при информировании пациентов. Также мы обратили внимание на ряд факторов (ожирение, диабет, тяжесть LS), которые необходимо учитывать при планировании лечения.
Рекомендации для клинической практики. На основе наших результатов можно предложить следующий подход к пациенту с подтверждённой LS-стриктурой уретры.
Препаративный этап: выполнить циркумцизио (если крайняя плоть интактна), это устранит очаг LS и облегчит доступ. Начать местную стероидную терапию (крем с клобетазолом) на область головки и наружного отверстия за 4 – 6 недель до планируемой пластики — для уменьшения активности заболевания.
Определиться с объёмом поражения: уретрография и уретроскопия для оценки протяженности стриктуры. Если стриктура короткая (< 1 – 2 см) и только в области меатуса, то можно попытаться выполнить расширенную меатопластику с наложением буккальных графтов либо одномоментную небольшую уретропластику (например, по B. Enganti et al. (2024) [23] или G.A. Favre et al. (2021) [24]).
Если стриктура > 2 см или простирается проксимальнее ладьевидной ямки, показана уретропластика с трансплантатом. Предпочтительно использовать одноэтапную уретропластику (dorsal onlay) с буккальным трансплантатом. Использовать подход Asopa (через вентральный разрез) для дистальных отделов, Barbagli-доступ (через промежность) для бульбопенильных стриктур.
Если поражение очень длинное (пануретральное) и / или кожа члена явно склерозирована, рассмотреть этапный подход. Первый этап — удаление рубцов, открытая уретра с трансплантатом. Между этапами следует продолжить терапию LS (стероиды). Вторым этапом — закрытие уретры. Альтернативно, если пациент не против, обсуждать перинеальную уретростомию как окончательное лечение.
Послеоперационное ведение: длительный низкодозовый приём антибиотиков (по ситуации) для профилактики инфекции трансплантата; применение мазей с клобетазолом на область наружного отверстия 3 – 6 месяцев. Контроль урофлоуметрии каждые 3 месяца первый год, затем каждые 6 – 12 месяцев в течение 5 лет.
При признаках рецидива (снижение Qmax, жалобы) — ранняя диагностика посредством уретроскопии или уретрографии. Небольшой рестеноз меатуса — дилатация и стероид. Проксимальный рестеноз — рассмотреть повторную пластикy (обычно локальную коррекцию). Во многих случаях повторная пластика имеет смысл и даёт результат.
Наблюдение дерматолога: даже при отсутствии видимых очагов LS — раз в год осмотр на предмет возобновления болезни (например, новые бляшки на рубце). При подозрительных изменениях — биопсия для исключения малигнизации (учитывая риск рака при LS). Этот алгоритм согласуется с рекомендациями крупных центров и, что важно, с пожеланиями пациентов, так как большинство хочет решить проблему за минимальное число операций и сохранить функцию. Наши данные внушают оптимизм, что при правильном подходе 85 – 90% больных можно излечить и вернуть к нормальному мочеиспусканию.
Будущие исследования. Нужны перспективные наблюдения для пациентов после уретропластики по поводу LS, чтобы определить оптимальную длительность и режимы адъювантной терапии (стероиды, иммуномодуляторы). В идеале следует провести рандомизированное испытание: например, группа А получает после операции курс внутриполостных стероидов, группа В — нет, и сравнить частоту рецидива. Также интересна генная и клеточная терапия: с учётом аутоиммунной природы LS возможно применение инновационных средств (биологические препараты, антифибротические агенты). Пока таких работ нет, но это перспективное направление, которое может повысить результаты лечения. Отдельно стоит вопрос женского LS: у женщин LS обычно поражает вульву, но иногда тоже вызывает стриктуру уретры. Учитывая разницу анатомии — это за рамками нашего обзора.
В заключение подчёркиваем, что сотрудничество уролога и дерматолога — краеугольный камень успешного лечения LS. Уролог устраняет стриктуру, дерматолог помогает держать болезнь под контролем. Пациентам следует объяснять хронический характер LS и необходимость поддерживающей терапии и наблюдения даже после, казалось бы, «вылеченной» стриктуры.
Заключение
Стриктуры уретры, развившиеся на фоне лихен-склероза, требуют комплексного подхода и представляют значительную проблему для реконструктивной урологии из-за склонности к рецидивированию. Наш систематический обзор и метаанализ показали, что современные методы лечения позволяют достичь больших успехов.
Одноэтапные уретропластики с использованием слизистой полости рта обеспечивают излечение 85 – 90% пациентов, особенно при локализованных поражениях. Этот метод следует рассматривать как приоритетный вариант реконструкции уретры при LS.
Двухэтапная уретропластика остаётся эффективной стратегией для протяжённых и тяжёлых случаев; её конечные результаты сопоставимы с одноэтапными, хотя период лечения длиннее. Правильный отбор пациентов на этапный подход важен для максимизации успеха.
Консервативная тактика (дилатации, стероиды) может применяться ограниченно — в качестве временной меры или у пациентов с мягкими симптомами. Она способна отсрочить операцию и улучшить состояние примерно у 4/5 больных в краткосрочной перспективе, но не заменяет хирургического лечения в долгосрочной.
Перинеальная уретростомия — надёжный метод окончательной диверсии мочи — должна предлагаться в случаях, когда реконструктивная хирургия нецелесообразна или исчерпана. Она обеспечивает высокое качество жизни у правильно отобранных пациентов.
Ключевым фактором успешного лечения является полное удаление или обход зон, поражённых LS, и применение тканей, невосприимчивых к этому заболеванию (слизистой). Не менее важно последующее наблюдение: даже после технически удачной операции пациенты должны находиться под диспансерным контролем ввиду возможности поздних рецидивов LS. Использование местной противорецидивной терапии (например, топических стероидов) после хирургии представляется обоснованным, хотя и требует дополнительных исследований для разработки стандартов.
Для клинической практики на основании полученных данных мы рекомендуем при подозрении на LS у пациента со стриктурой уретры обязательно проводить биопсию, раннее оперативное вмешательство (не откладывая до полной облитерации), выполнять уретропластику с использованием буккального трансплантата — предпочтительно одним этапом, а в случае обширного LS — не бояться применять поэтапную тактику или уретростомию. Пациентам следует разъяснять природу их заболевания и важность продолжения лечения LS даже после устранения стриктуры.
Наконец, отмечаем необходимость дальнейших исследований, в частности, рандомизированных испытаний новых методов (например, адъювантной иммунной терапии при LS), а также долгосрочного мониторинга больших когорт пациентов. Это позволит улучшить исходы и выработать оптимальные персонализированные стратегии лечения. На сегодня же с опорой на собранные данные, можно уверенно утверждать, что стриктуры уретры при LS излечимы в большинстве случаев при условии применения современных методов реконструктивной хирургии в сочетании с адекватной противовоспалительной терапией и наблюдением.
Список литературы
1. Levy A., Browne B., Fredrick A., Stensland K., Bennett J., Sullivan T., Rieger-Christ K.M., Vanni A.J. Insights into the Pathophysiology of Urethral Stricture Disease due to Lichen Sclerosus: Comparison of Pathological Markers in Lichen Sclerosus Induced Strictures vs Nonlichen Sclerosus Induced Strictures. J Urol. 2019;201(6):1158-1163. DOI: 10.1097/JU.0000000000000155
2. Levy A.C., Moynihan M., Bennett J.A., Sullivan T., Stensland K., Browne B.M., Fredrick A., Cavallo J.A., Pagura E., Tua-Caraccia R., Rieger-Christ K.M., Vanni A.J. Protein Expression Profiles among Lichen Sclerosus Urethral Strictures-Can Urethroplasty Success be Predicted? J Urol. 2020;203(4):773-778. DOI: 10.1097/JU.0000000000000610
3. Lumen N., Hoebeke P., Willemsen P., De Troyer B., Pieters R., Oosterlinck W. Etiology of urethral stricture disease in the 21st century. J Urol. 2009;182(3):983-987. DOI: 10.1016/j.juro.2009.05.023
4. Mundy A.R., Andrich D.E. Urethral strictures. BJU Int. 2011;107(1):6-26. DOI: 10.1111/j.1464-410X.2010.09800.x
5. Dinh H., Purcell S.M., Chung C., Zaenglein A.L. Pediatric Lichen Sclerosus: A Review of the Literature and Management Recommendations. J Clin Aesthet Dermatol. 2016;9(9):49-54. PMID: 27878062; PMCID: PMC5110329
6. Lewis F.M., Tatnall F.M., Velangi S.S., Bunker C.B., Kumar A., Brackenbury F., Mohd Mustapa M.F., Exton L.S. British Association of Dermatologists guidelines for the management of lichen sclerosus, 2018. Br J Dermatol. 2018;178(4):839-853. DOI: 10.1111/bjd.16241
7. Patel C.K., Buckley J.C., Zinman L.N., Vanni A.J. Outcomes for Management of Lichen Sclerosus Urethral Strictures by 3 Different Techniques. Urology. 2016;91:215-221. DOI: 10.1016/j.urology.2015.11.057
8. Kulkarni S., Barbagli G., Sansalone S., Lazzeri M. Onesided anterior urethroplasty: a new dorsal onlay graft technique. BJU Int. 2009;104(8):1150-1155. DOI: 10.1111/j.1464-410X.2009.08590.x
9. Barbagli G., Palminteri E., Balò S., Vallasciani S., Mearini E., Costantini E., Mearini L., Zucchi A., Vivacqua C., Porena M. Lichen sclerosus of the male genitalia and urethral stricture diseases. Urol Int. 2004;73(1):1-5. Erratum in: Urol Int. 2008;80(4):447. Constantini, Elisabetta [corrected to Costantini, Elisabetta]. DOI: 10.1159/000078794
10. Kwok R, Shah T.T, Minhas S. Recent advances in understanding and managing Lichen Sclerosus. F1000Res. 2020;9:F1000 Faculty Rev-369. DOI: 10.12688/f1000research.21529.1
11. Kirtschig G. Lichen Sclerosus-Presentation, Diagnosis and Management. Dtsch Arztebl Int. 2016;113(19):337-343. DOI: 10.3238/arztebl.2016.0337
12. Hald A.K., Blaakaer J. The possible role of human papillomavirus infection in the development of lichen sclerosus. Int J Dermatol. 2018;57(2):139-146. DOI: 10.1111/ijd.13697
13. Berger E.R., Huffman K.M., Fraker T., Petrick A.T., Brethauer S.A., Hall B.L., Ko C.Y., Morton J.M. Prevalence and Risk Factors for Bariatric Surgery Readmissions: Findings From 130,007 Admissions in the Metabolic and Bariatric Surgery Accreditation and Quality Improvement Program. Ann Surg. 2018;267(1):122-131. DOI: 10.1097/SLA.0000000000002079
14. Windahl T. Is carbon dioxide laser treatment of lichen sclerosus effective in the long run? Scand J Urol Nephrol. 2006;40(3):208-211. DOI: 10.1080/00365590600589666
15. Wirtz M., Claeys W., Francois P., Waterloos M., Waterschoot M., Lumen N. Treatment of Meatal Strictures by Dorsal Inlay Oral Mucosa Graft Urethroplasty: A Single-Center Experience. J Clin Med. 2021;10(19):4312. DOI: 10.3390/jcm10194312
16. Kulkarni S., Barbagli G., Kirpekar D., Mirri F., Lazzeri M. Lichen sclerosus of the male genitalia and urethra: surgical options and results in a multicenter international experience with 215 patients. Eur Urol. 2009;55(4):945-954. DOI: 10.1016/j.eururo.2008.07.046
17. Conte S., Daraj Mohamed S., Shergill M., Yacovelli A., Johnston L., Starkey S., Cohen Y., Law A., Litvinov I.V., Mukovozov I. Treatment Modalities for Genital Lichen Sclerosus: A Systematic Review. Dermato. 2024;4(4):136-172. DOI: 10.3390/dermato4040014
18. Choudhury S., Khare E., Pal D.K. Comparative effect of intraurethral clobetasol and tacrolimus in lichen sclerosus-associated urethral stricture disease. Urol Ann. 2023;15(2):174-179. DOI: 10.4103/ua.ua_45_22
19. Wessells H., Morey A., Souter L., Rahimi L., Vanni A. Urethral Stricture Disease Guideline Amendment (2023). J Urol. 2023;210(1):64-71. DOI: 10.1097/JU.0000000000003482
20. Lumen N., Campos-Juanatey F., Greenwell T., Martins F.E., Osman N.I., Riechardt S., Waterloos M., Barratt R., Chan G., Esperto F., Ploumidis A., Verla W., Dimitropoulos K. European Association of Urology Guidelines on Urethral Stricture Disease (Part 1): Management of Male Urethral Stricture Disease. Eur Urol. 2021;80(2):190-200. DOI: 10.1016/j.eururo.2021.05.022
21. Rozanski A.T., Zhang L.T., Muise A.C., Copacino S.A., Holst D.D., Zinman L.N., Buckley J.C., Vanni A.J. Conservative Management of Lichen Sclerosus Male Urethral Strictures: A Multi-Institutional Experience. Urology. 2021;152:123-128. DOI: 10.1016/j.urology.2021.01.010
22. Potts B.A., Belsante M.J., Peterson A.C. Intraurethral Steroids are a Safe and Effective Treatment for Stricture Disease in Patients with Biopsy Proven Lichen Sclerosus. J Urol. 2016;195(6):1790-1796. DOI: 10.1016/j.juro.2015.12.067
23. Enganti B., Nanavati P., Madduri V.K.S, Wani A., Chiruvella M. Glans cap-preserving dorsal inlay-free graft augmentation technique for reconstruction of meatal stenosis and fossa navicularis strictures: Analysis of short-term functional outcomes. Indian J Urol. 2024;40(3):156-160. DOI: 10.4103/iju.iju_61_24
24. Favre G.A., Villa S.G., Scherñuk J., Tobia I.P., Giudice C.R. Glans Preservation in Surgical Treatment of Distal Urethral Strictures With Dorsal Buccal Mucosa Graft Onlay by Subcoronal Approach. Urology. 2021;152:148-152. DOI: 10.1016/j.urology.2020.12.014
25. Xu Y.M., Feng C., Sa Y.L., Fu Q., Zhang J., Xie H. Outcome of 1-stage urethroplasty using oral mucosal grafts for the treatment of urethral strictures associated with genital lichen sclerosus. Urology. 2014;83(1):232-236. DOI: 10.1016/j.urology.2013.08.035
26. Erickson B.A., Elliott S.P., Myers J.B., Voelzke B.B., Smith T.G. 3rd, McClung C.D., Alsikafi N.F., Vanni A.J., Brant W.O., Broghammer J.A., Tam C.A., Zhao L.C., Buckley J.C., Breyer B.N. Trauma and Urologic Reconstructive Network of Surgeons. Understanding the Relationship between Chronic Systemic Disease and Lichen Sclerosus Urethral Strictures. J Urol. 2016;195(2):363-368. DOI: 10.1016/j.juro.2015.08.096
27. Hofer M.D., Meeks J.J., Mehdiratta N., Granieri M.A., Cashy J., Gonzalez C.M. Lichen sclerosus in men is associated with elevated body mass index, diabetes mellitus, coronary artery disease and smoking. World J Urol. 2014;32(1):105-108. DOI: 10.1007/s00345-013-1090-7
28. Barbagli G., Mirri F., Gallucci M., Sansalone S., Romano G., Lazzeri M. Histological evidence of urethral involvement in male patients with genital lichen sclerosus: a preliminary report. J Urol. 2011;185(6):2171-2176. DOI: 10.1016/j.juro.2011.02.060
29. Tausch T.J., Peterson A.C. Early aggressive treatment of lichen sclerosus may prevent disease progression. J Urol. 2012;187(6):2101-2105. DOI: 10.1016/j.juro.2012.01.071
30. Onol S.Y., Onol F.F., Gümüş E., Topaktaş R., Erdem M.R. Reconstruction of distal urethral strictures confined to the glans with circular buccal mucosa graft. Urology. 2012;79(5):1158-1162. DOI: 10.1016/j.urology.2012.01.046
31. Усупбаев А.Ч., Курбаналиев Р.М., Акылбек С., Колесниченко И.В., Садырбеков Н.Ж. Комплексный подход к лечению стриктур уретры, вызванных склероатрофическим лихеном. Урология. 2021;(4):12-18.
32. Zheng D., Xie M., Wan X., Mao Y., Yao H., Wang Z. The Management of Lichen Sclerosus Urethral Strictures by 3 Different Techniques: a singlecenter surgical algorithm based on the evaluation of corpus spongiosum. Research Square. 2021. Preprint DOI: 10.21203/rs.3.rs-970094/v1.
33. Wang J., Wang J., Xia H., Xu X., Zhai J., He F., Huang G., Li G. [Surgical management of the distal urethral stricture diseases]. Beijing Da Xue Xue Bao Yi Xue Ban. 2024;56(6):1075-1082. (In Chinese). DOI: 10.19723/j.issn.1671-167X.2024.06.021
34. Hoy N.Y., Chapman D.W., Rourke K.F. Better defining the optimal management of penile urethral strictures: A retrospective comparison of single-stage vs. two-stage urethroplasty. Can Urol Assoc J. 2019;13(12):414-418. DOI: 10.5489/cuaj.5895
35. Andrich D.E., Mundy A.R. Climate – a potential cause of primary graft failure in buccal mucosal graft urethroplasty. J Urol. 2009;181(4S):15. DOI:10.1016/S0022-5347(09)60054-9
36. Goel A., Goel A., Dalela D., Sankhwar S.N. Meatoplasty using double buccal mucosal graft technique. Int Urol Nephrol. 2009;41(4):885-887. DOI: 10.1007/s11255-009-9555-8
37. Barbagli G., Balò S., Montorsi F., Sansalone S., Lazzeri M. History and evolution of the use of oral mucosa for urethral reconstruction. Asian J Urol. 2017;4(2):96-101. DOI: 10.1016/j.ajur.2016.05.006
38. Dielubanza E.J., Han J.S., Gonzalez C.M. Distal urethroplasty for fossa navicularis and meatal strictures. Transl Androl Urol. 2014;3(2):163-169. DOI: 10.3978/j.issn.2223-4683.2014.04.02
Об авторах
В. А. ВоробьёвРоссия
Владимир Анатольевич Воробьев – д-р мед. наук, профессор
Уфа;
Иркутск
М. И. Коган
Россия
Михаил Иосифович Коган – д-р мед. наук, профессор, заслуженный деятель науки РФ
Ростов-на-Дону
Э. Ю. Прокопьев
Россия
Эдуард Юрьевич Прокопьев
Уфа
А. М. Пушкарёв
Россия
Алексей Михайлович Пушкарёв – д-р мед. наук, профессор
Уфа
Рецензия
Для цитирования:
Воробьёв В.А., Коган М.И., Прокопьев Э.Ю., Пушкарёв А.М. Лечение стриктур уретры при лихен-склерозе: систематический обзор и метаанализ. Вестник урологии. 2025;13(4):55-78. https://doi.org/10.21886/2308-6424-2025-13-4-55-78
For citation:
Vorobev V.А., Kogan M.I., Prokopev E.Yu., Pushkarev A.M. Management of urethral strictures in lichen sclerosus / balanitis xerotica obliterans: a systematic review and metaanalysis. Urology Herald. 2025;13(4):55-78. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-55-78













































