Перейти к:
Сравнительный анализ результатов применения робот-ассистированной и лапароскопической пиелопластики у детей
https://doi.org/10.21886/2308-6424-2025-13-4-39-46
Аннотация
Введение. Обструкция пиелоуретерального сегмента (ОПУС) — самая частая причина хирургических вмешательств на верхних мочевых путях у детей. Нами проведён сравнительный анализ результатов применения робот-ассистированной лапароскопической пиелопластики (РАП) с использованием системы da Vinci Xi и традиционной лапароскопической пиелопластики (ЛП).
Цель исследования. Изучить в сравнении результаты применения РАП и ЛП у детей.
Материалы и методы. В исследование включены 40 пациентов, которым выполнена пиелопластика. Мы разделили пациентов на две группы: в группе 1 — 20 пациентов, которым выполнена РАП, в группе 2 — 20 пациентов, которым выполнена ЛП. Все операции выполнены одним хирургом.
Результаты. В обеих группах случаев конверсий не было. В группе РАП среднее время оперативного вмешательства составило 144,2 ± 25,9 минуты; средняя продолжительность докинга — 21,7 ± 2,6 минуты; среднее консольное время хирурга — 87,8 ± 20,4 минуты. В группе ЛП средняя продолжительность операции составила 121,8 ± 39,9 минуты; среднее хирургическое время — 90,0 ± 20,0 минут. Среднее время пребывания в стационаре после РАП составляет 6,6 ± 1,4 дня, после ЛП — 7,5 ± 2,8 дня (p = 0,198). Через 6 месяцев после пиелопластики у пациентов группы 1 среднее значение ПЗР — 18,3 ± 11,3 мм, у пациентов группы 2 — 19,7 ± 6,1 мм (p = 0,632).
Заключение. Сравнительный анализ эффективности и безопасности использования РАП и ЛП при ОПУС у детей демонстрирует сопоставимые результаты по длительности хирургии и динамике регрессии дилатации чашечно-лоханочной системы в послеоперационном периоде. В качестве преимущества РАП по сравнению с ЛП следует считать сохранение физических кондиций оператора на всём протяжении формирования анастомоза, позволяющих формировать анастомоз максимально прецизионно, избегая компромисса между желаемым качеством наложения интракорпорального шва и реальным результатом на фоне неизбежной физической усталости оператора при использовании лапароскопического доступа.
Для цитирования:
Сизонов В.В., Макаров А.Г., Пакус С.М., Коган М.И., Кварацхелия Д.Г. Сравнительный анализ результатов применения робот-ассистированной и лапароскопической пиелопластики у детей. Вестник урологии. 2025;13(4):39-46. https://doi.org/10.21886/2308-6424-2025-13-4-39-46
For citation:
Sizonov V.V., Makarov A.G., Pakus S.M., Kogan M.I., Kvaratskhelia D.G. Robot-assisted and laparoscopic pyeloplasty in children: a comparative analysis of surgical outcomes. Urology Herald. 2025;13(4):39-46. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-39-46
Введение
Обструкция пиелоуретерального сегмента (ОПУС) — самая частая причина хирургических вмешательств на верхних мочевых путях у детей. С середины прошлого века стандартом хирургии гидронефроза являлась открытая расчленяющая пиелопластика. В 1996 году C.A. Peters et al. представили результаты первой серии педиатрических лапароскопических пиелопластик (ЛП) [1]. С этого момента малоинвазивная хирургия гидронефроза постепенно приобретала популярность и в настоящее время замещает открытую хирургию, несмотря на достаточно продолжительный период обучения навыкам формирования интракорпорального шва и непростую для хирурга эргономику вмешательства. Появление роботических систем открыло новый этап внедрения малоинвазивных технологий в хирургическом лечении гидронефроза у детей. Первые результаты использования робот-ассистированой пиелопластики (РАП) у детей представил R.S. Lee et al. в 2006 году [2]. Нами проведён сравнительный анализ эффективности и безопасности РАП и ЛП, выполненных в стенах нашей клиники.
Цель исследования: изучить в сравнении результаты применения РАП и ЛП у детей.
Материалы и методы
Дизайн исследования. Одноцентровое когортное сравнительное исследование с последовательным набором пациентов, разделённых на две группы согласно виду хирургического вмешательства и времени проведения операции.
Мы разделили пациентов на две группы: группа 1 — 20 пациентов, которым выполнена РАП (первые 20 пациентов), группа 2 — 20 пациентов, которым выполнена ЛП в 2023 году. Набор пациентов группу 1 осуществлён в 2025 году. Обе серии операций выполнены одним хирургом.
Предоперационная диагностика и показания к хирургии. Предоперационная диагностика гидронефротической трансформации почки включала ультразвуковое исследование (УЗИ) почек на фоне и без диуретической нагрузки, динамическую диуретическую нефросцинтиграфию, спиральную компьютерную томографию органов забрюшинного пространства с контрастированием, магниторезонансную томографию.
Показанием к операции в обеих группах являлись: гидронефротическая трансформация III – IV степени по классификации Society for Fetal Urology (SFU), снижение дифференциальной почечной функции на стороне поражения ниже 40% или её снижение в процессе динамического наблюдения на 10% и более, появление клинических проявлений обструкции в виде болей в животе, сопровождавшихся увеличением дилатации чашечно-лоханочной системы (по данным УЗИ).
Хирургическая техника. РАП была выполнена всем пациентам без редукционной резекции лоханки. Операцию производили в положении на противоположном по отношению к обструкции боку, доступ осуществляли, установив три троакара 8 мм в диаметре для введения оптики и роботических инструментов и одного троакара 5 мм в диаметре — для введения инструментов ассистентом (рис. 1).
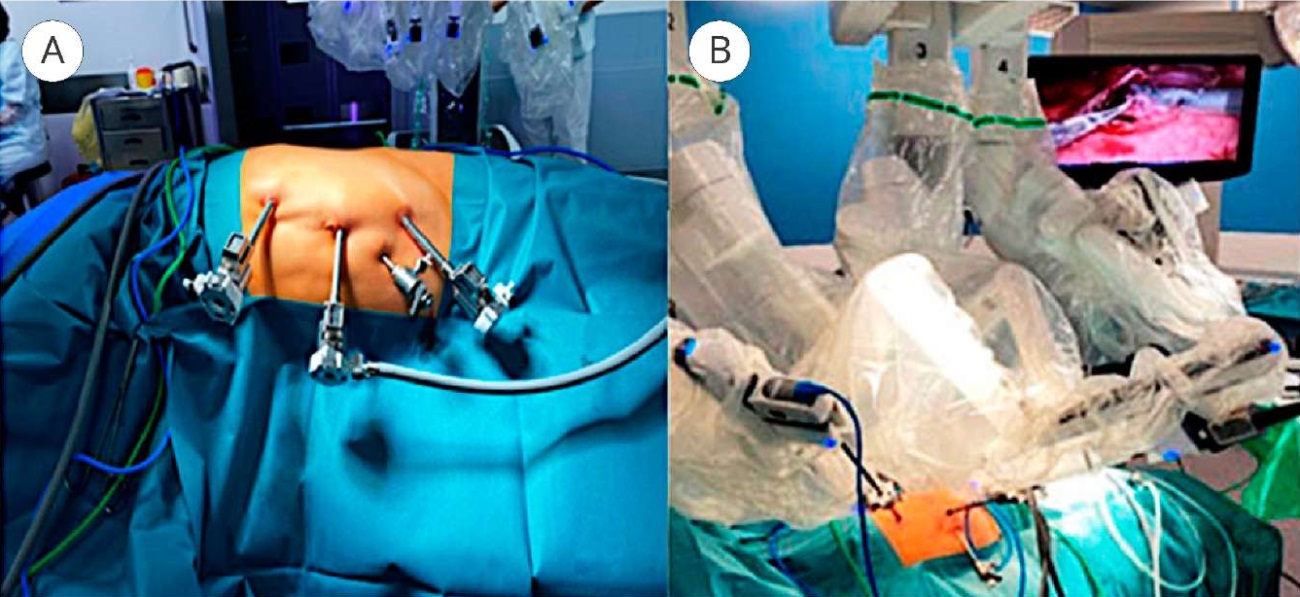
Рисунок 1. Расположение троакаров для пиелопластики (А), выполнена стыковка робота (В).
Доступ к почке осуществлялся по линии Toldt либо трансмезентериально. После выделения лоханки и пиелоуретерального сегмента последний резецировали, лоханку брали на держалку, мочеточник спатулировали (рис. 2).
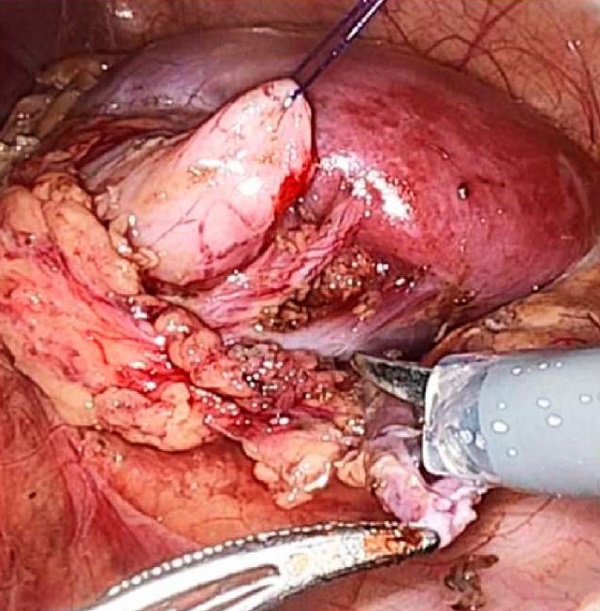
Рисунок 2. Лоханка выделена, взята на держалку, выполнена резекция пиелоуретерального сегмента, производится спатуляция мочеточника
Анастомоз во всех случаях формировали отдельными узловыми швами с помощью нити Monosyn® 5/0 (рис. 3).
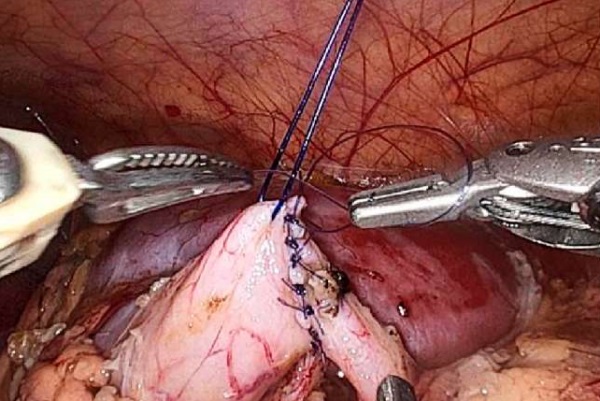
Рисунок 3. Формирование пиелоуретерального анастомоза
Лапароскопическая расчленяющая пиелопластика во всех случаях была выполнена без редукционной резекции лоханки. Операцию выполняли в положении на противоположном по отношению к обструкции боку, доступ осуществляли, установив один оптический троакар и два рабочих троакара от 3 до 5 мм в диаметре для введения оптики и лапароскопических инструментов (рис. 4). Анастомоз во всех случаях сформирован непрерывным швом с помощью нити Monosyn® 5/0 (рис. 5). Дренирование чашечно-лоханочной системы в группах производили путём установки пиелостомического дренажа.
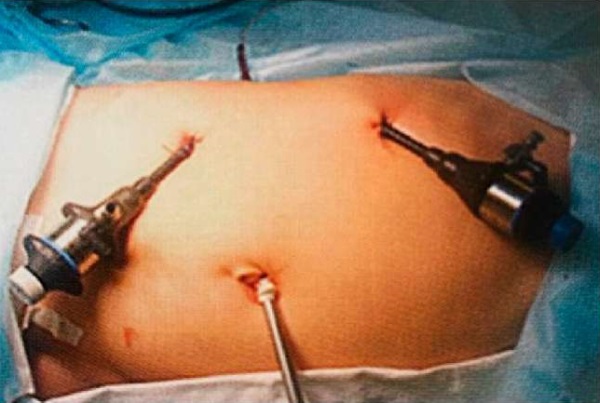
Рисунок 4. Расположение троакаров для ЛП
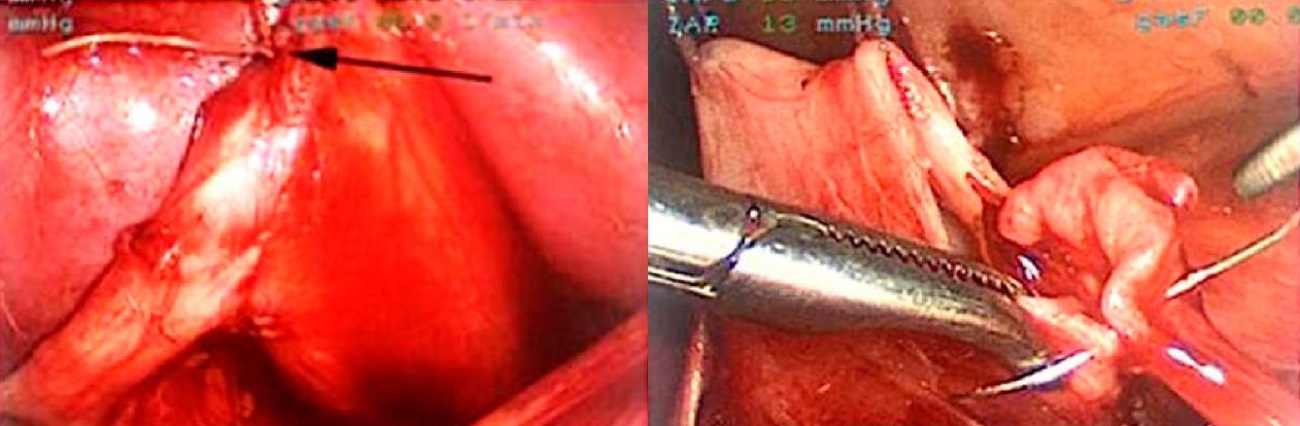
Рисунок 5. Формирование пиелоуретерального анастомоза
Контрольное УЗ-исследование выполняли через 6 месяцев после пиелопластики в положении пациента лежа на животе, на фоне волемического покоя и опорожнённого мочевого пузыря. УЗ-датчик устанавливали параллельно позвоночному столбу.
Статистический анализ. Обработка и анализ массива статистических данных выполнялись на персональном компьютере с помощью электронных таблиц “Microsoft Office Excel 2010” (Microsoft Corp., Redmond, WA, USA) и пакета прикладных программ “IBM SPSS Statistics v.22.0” (SPSS: An IBM Company, IBM SPSS Corp., Armonk, NY, USA). Для проверки нормальности распределения использовался метод Колмогорова – Смирнова – Lilliefors. Расчёты приведены в виде среднего значения (M) и стандартного отклонения (SD), в тексте представлено как M ± SD. Значимость различий между группами рассчитывали с использованием t-теста Student для определения различий средних значений для парных и непарных выборок. Различия считались значимыми при p < 0,05.
Результаты
Средний возраст пациентов в группе 1 — 7,15 ± 3,7 лет, средний рост — 129,2 ± 20,8 см, средняя масса тела — 29,2 ± 14,4 кг. Среди больных группы 1 — 14 (70%) мальчиков и 6 (30%) девочек. Гидронефроз справа диагностирован у 6 (30%) детей, слева — у 14 (70%). У 15 (75%) пациентов выявлен гидронефроз 3‑й степени по SFU [3], у 5 (25%) — 4‑й степени. Среднее значение передне-заднего размера (ПЗР) лоханки в группе 1 — 34,3 ± 15 мм. Внутренняя причина ОПУС среди детей группы 1 выявлена в 15 (75%) случаях, внешняя причина (нижнеполярный сосуд) — в 5 (25%).
В группе 2 средний возраст пациентов составил 5,6 ± 4,2 года, средний рост — 124,5 ± 35,2 см, средняя масса тела — 29,5 ± 21,1 кг. Среди больных группы 2 — 12 (60%) мальчиков и 8 (40%) девочек. Гидронефроз справа диагностирован у 10 (50%) детей, слева —у 10 (50%). У 14 (70%) детей группы 2 выявлен гидронефроз 3‑й степени по SFU, у 6 (30%) — 4‑й степени. Среднее значение ПЗР лоханки в группе 2 — 35,4 ± 11,7 мм. Внутренняя причина ОПУС выявлена у 10 (50%) пациентов, внешняя причина — у 10 (50%).
Не обнаружено достоверных различий по возрасту (p = 0,126), массе тела (p = 0,712), степени гидронефроза (p = 0,541) и значениям ПЗР лоханки (p = 0,784) между пациентами обоих групп.
В обеих сериях случаев конверсий не было. В группе РАП среднее время оперативного вмешательства составило 144,2 ± 25,9 минуты. Средняя продолжительность докинга — 21,7 ± 2,6 минуты. Среднее консольное время хирурга — 87,8 ± 20,4 минуты (рис. 6). В группе ЛП средняя продолжительность операции — 121,8 ± 39,9 минуты. Среднее хирургическое время — 90 ± 20 минут (рис. 7). Не обнаружено достоверных различий продолжительности хирургического времени (p = 0,803).
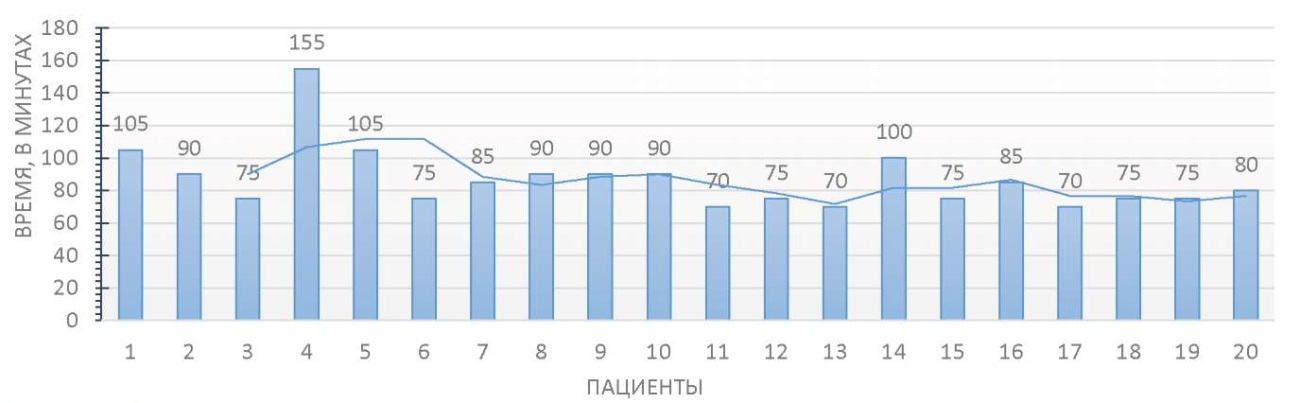
Рисунок 6. Динамика консольного времени у пациентов группы 1

Рисунок 7. Динамика хирургического времени у пациентов группы 2
Среднее время пребывания в стационаре после РАП составляет 6,6 ± 1,4 дня, в группе ЛП — 7,5 ± 2,8 дня (p = 0,198).
Через 6 месяцев после пиелопластики у пациентов группы 1 среднее значение ПЗР — 18,35 ± 11,3 мм, в группе 2 — 19,7 ± 6,1 мм (p = 0,632) (рис. 8). Таким образом, скорость и степень редукции лоханки не различались в группах 1 и 2.
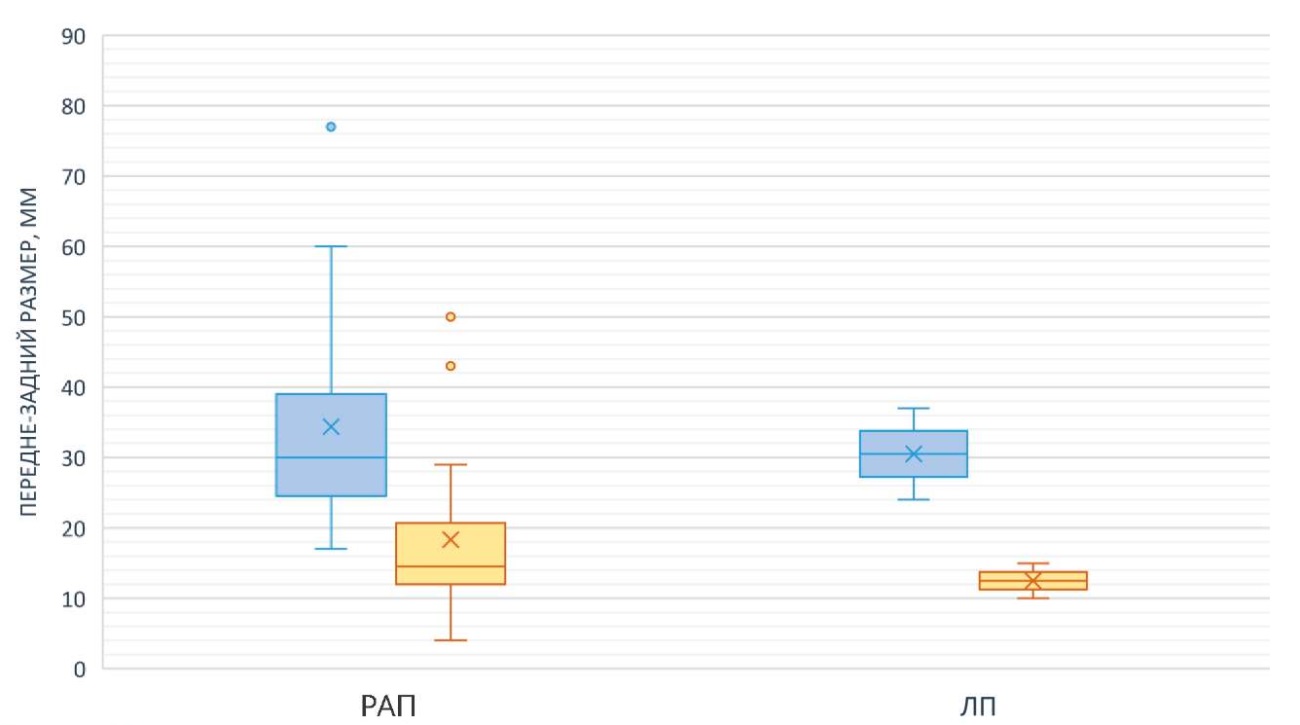
Рисунок 8. Динамика ПЗР в обеих группах до и после операции (6 месяцев)
Обсуждение
Первый сравнительный анализ эффективности применения РАП у детей по сравнению с открытым доступом был представлен R.S. Lee et al. в 2006 году [2]. Авторы отметили уменьшение количества использованных анальгетиков после операции, сокращение времени операции и пребывания в стационаре пациентов, которым выполняли РАП.
В дальнейшем исследования были посвящены сравнению двух малоинвазивных технологий пиелопластики у детей ЛП и РАП. Первый метаанализ L.H. Braga et al. (2009) продемонстрировал, что единственным преимуществом РАП оказалось сокращение времени операции в среднем на 10 минут, при этом остальные оцениваемые критерии были эквивалентны показателям, характерным для ЛП [4]. Серия дальнейших работ подтвердила выводы исследователей в части сокращения времени хирургии при использовании роботической платформы (M.S. Silay et al. (2019) [5], E. Bindi et al. (2024) [6]).
C. Andolfi et al. (2020) на основе изучения 19 оригинальных статей и 5 метаанализов сообщили о наличии дополнительных преимуществ РАП помимо сокращения времени хирургии [7]. Роботизированный подход к ОПУС позволил сократить продолжительность пребывания в больнице и снизить частоту осложнений по сравнению с лапароскопическим доступом. К аналогичным выводам пришли M. Sun et al. в 2023 году на основании проведённого ими метаанализа, включившего 26 исследований (6 074 пиелопластики) [8]. Авторами не выявлено статистически значимых различий между результатами РАП, ЛП и открытой пиелопластикой (ОП), однако отмечено, что при РАП отмечается меньшая продолжительность госпитализации, сокращается время операции, уменьшается частота развития гипертермии и потребность в анальгетиках. Первый отечественный анализ, посвящённый сравнению эффективности и безопасности выполнения РАП и ЛП у детей, представили в 2024 году Ю.А. Козлов и соавт. [9].
Представляет интерес анализ частоты использования роботических технологий в США, где установлено порядка 60% произведённых в мире роботических систем. B. Varda et al. (2018) проанализировали динамику использования различных доступов при пиелопластике у детей в период с 2003 по 2015 год [10]. Из 11 899 пиелопластик 75% выполнено с использованием открытого доступа, 10% — ЛП и 15% — РАП. Выявлено увеличение доли РАП от практически нулевых значений у пациентов первого года жизни до практически полного замещения роботическими вмешательствами (85%) у детей в возрасте от 13 до 18 лет. Таким образом, в условиях максимальной доступности роботических систем существенным ограничением применения РАП являются возраст и (как производное) вес пациентов. В 2021 году C. Esposito et al. путём анкетирования европейских экспертов пришли к выводу, что пороговым уровнем для выполнения робот-ассистированных вмешательств у детей с их точки зрения является вес ребёнка, 10 – 15 кг [11].
Однако в последнее время появляются публикации, ломающие сложившиеся стереотипы в части ограничений по использованию РАП у детей первого года жизни. P. Li et al. (2021) представили опыт выполнения РАП при тяжёлой форме ОПУС у младенцев в возрасте до 3 месяцев с тяжёлым течением гидронефроза, средний возраст младенцев составил 1,62 ± 0,54 месяца [12]. В нашей практике мы выполнили робот-ассистированную реимплантацию мочеточника у пациента 7 месяцев, с массой тела 7 кг. Учитывая опыт коллег, планируем постепенно расширять показания к использованию РАП у детей младше года.
Длительный период обретения мануальных навыков, необходимых для выполнения ЛП, и непростая эргономика при работе хирурга существенно тормозили и ограничивают и сейчас распространение ЛП. В сравнении с лапароскопическим доступом робот-ассистированные вмешательства требуют существенно меньшего периода обучения и не связаны с проблемами эргономики для хирурга.
G. Spampinato et al. (2021) сравнили кривую обучения выполнения РАП опытными хирургами и их начинающими коллегами [13]. Хирурги из обеих групп не имели предыдущего опыта роботизированной хирургии. Авторы обнаружили, что, несмотря на то, что менее опытные хирурги выполнили меньше процедур, чем более опытные коллеги, их кривая обучения демонстрировала более быстрый процесс обучения после 5 проведённых операций, за которым следовал постоянный темп улучшения мастерства, в то время как старшим коллегам потребовалось провести 7 вмешательств.
G. Cobellis et al. (2023) пришли к выводу, что роботизированная хирургия позволяет ограничить некоторые из технических трудностей, присущих лапароскопии [14]. Кроме того, кривая обучения наложению швов в роботизированной хирургии короче по сравнению с лапароскопической хирургией. Характеристики роботизированной системы позволяют перейти от открытой к роботизированной лапароскопической пиелопластике без предварительного опыта традиционной лапароскопии.
T. Planchamp et al. (2023) изучили кривую обучения навыкам в роботической хирургии и пришли к выводу, что РАП имеет более низкую кривую обучения, чем лапароскопическая пиелопластика [15]. Мы предполагаем, что значительное сокращение хирургического времени может быть достигнуто в первых 30 случаях, даже без предыдущего опыта лапароскопической пиелопластики.
Заключение
Сравнительный анализ эффективности и безопасности использования РАП и ЛП при ОПУС у детей демонстрирует сопоставимые результаты по длительности хирургии и динамике регрессии дилатации чашечно-лоханочной системы в послеоперационном периоде в обеих группах. В качестве преимущества РАП по сравнению с ЛП следует считать сохранение физических кондиций оператора на всём протяжении формирования анастомоза, позволяющих формировать анастомоз максимально прецизионно, избегая компромисса между желаемым качеством наложения интракорпорального шва и реальным результатом на фоне неизбежной физической усталости оператора при использовании лапароскопического доступа.
Список литературы
1. Peters C.A. Complications in pediatric urological laparoscopy: results of a survey. J Urol. 1996;155(3):1070-1073. PMID: 8583567
2. Lee R.S., Retik A.B., Borer J.G., Peters C.A. Pediatric robot assisted laparoscopic dismembered pyeloplasty: comparison with a cohort of open surgery. J Urol. 2006;175(2):683-687; discussion 687. DOI: 10.1016/S0022-5347(05)00183-7
3. Fernbach S.K., Maizels M., Conway J.J. Ultrasound grading of hydronephrosis: introduction to the system used by the Society for Fetal Urology. Pediatr Radiol. 1993;23(6):478-480. DOI: 10.1007/BF02012459
4. Braga L.H., Pace K., DeMaria J., Lorenzo A.J. Systematic review and meta-analysis of robotic-assisted versus conventional laparoscopic pyeloplasty for patients with ureteropelvic junction obstruction: effect on operative time, length of hospital stay, postoperative complications, and success rate. Eur Urol. 2009;56(5):848-857. DOI: 10.1016/j.eururo.2009.03.063
5. Silay M.S., Danacioglu O., Ozel K., Karaman M.I., Caskurlu T. Laparoscopy versus robotic-assisted pyeloplasty in children: preliminary results of a pilot prospective randomized controlled trial. World J Urol. 2020;38(8):1841-1848. DOI: 10.1007/s00345-019-02910-8
6. Bindi E., Cobellis G., 't Hoen L.A., Lammers R.J.M., O'Kelly F., Dönmez M.İ., Baydilli N., Haid B., Marco B.B., Atwa A., Madarriaga Y.Q., Masieri L., Sforza S. European Association of Urology Young Academic Urology working group Pediatric Urology. Has robot-assisted pyeloplasty reached outcome parity with laparoscopic pyeloplasty in children <15 kg? A Paediatric YAU international multi-center study. J Pediatr Urol. 2024;20(6):1154-1159. DOI: 10.1016/j.jpurol.2024.09.008
7. Andolfi C., Adamic B., Oommen J., Gundeti M.S. Robot-assisted laparoscopic pyeloplasty in infants and children: is it superior to conventional laparoscopy? World J Urol. 2020;38(8):1827-1833. DOI: 10.1007/s00345-019-02943-z
8. Sun M., Yu C., Zhao J., Liu M., Liu Y., Han R., Chen L., Wu S. The efficacy of robotic-assisted laparoscopic pyeloplasty for pediatric ureteropelvic junction obstruction: a systematic review and meta-analysis. Pediatr Surg Int. 2023;39(1):265. DOI: 10.1007/s00383-023-05541-8
9. Козлов Ю.А., Полоян С.С., Рожанский А.П., Сапухин Э.В., Страшинский А.С., Макарочкина М.В., Марчук А.А., Быргазов А.А., Романович Е.С., Наркевич А.Н. Сравнение робот-ассистированной и лапароскопической пиелопластики в лечении обструкции пиелоуретерального сегмента у детей. Педиатрия им. Г.Н. Сперанского. 2024;103(6):111-119.
10. Varda B.K., Wang Y., Chung B.I., Lee R.S., Kurtz M.P., Nelson C.P., Chang S.L. Has the robot caught up? National trends in utilization, perioperative outcomes, and cost for open, laparoscopic, and robotic pediatric pyeloplasty in the United States from 2003 to 2015. J Pediatr Urol. 2018;14(4):336.e1-336.e8. DOI: 10.1016/j.jpurol.2017.12.010
11. Esposito C., Blanc T., Lardy H., Masieri L., Fourcade L., Mendoza- Sagaon M., Nappo S., Lopez M., Pelizzo G., Steyaert H., Gamba P., Scuderi M.G., Escolino M., Castagnetti M., Chiarenza F., Ghoneimi A.E. Robotic Surgery in Pediatric Urology: A Critical Appraisal of the GECI and SIVI Consensus of European Experts. J Laparoendosc Adv Surg Tech A. 2022;32(10):1108-1113. DOI: 10.1089/lap.2021.0837
12. Li P., Zhou H., Cao H., Guo T., Zhu W., Zhao Y., Tao T., Zhou X., Ma L., Yang Y., Feng Z. Early Robotic-Assisted Laparoscopic Pyeloplasty for Infants Under 3 Months With Severe Ureteropelvic Junction Obstruction. Front Pediatr. 2021;9:590865. DOI: 10.3389/fped.2021.590865
13. Spampinato G., Binet A., Fourcade L., Mendoza Sagaon M., Villemagne T., Braik K., Grosos C., Lardy H., Ballouhey Q. Comparison of the Learning Curve for Robot-Assisted Laparoscopic Pyeloplasty Between Senior and Junior Surgeons. J Laparoendosc Adv Surg Tech A. 2021;31(4):478-483. DOI: 10.1089/lap.2020.0822
14. Cobellis G., Bindi E. Pyeloplasty in Children with Ureteropelvic Junction Obstruction and Associated Kidney Anomalies: Can a Robotic Approach Make Surgery Easier? Children (Basel). 2023;10(9):1448. DOI: 10.3390/children10091448
15. Planchamp T., Bento L., Mouttalib S., Belbahri I., Coustets B., Aissa D.A., Abbo O. Robotic pyeloplasty learning curve for a pediatric surgeon without previous laparoscopic pyeloplasty experience. J Robot Surg. 2023;17(6):2955-2962. DOI: 10.1007/s11701-023-01737-1
Об авторах
В. В. СизоновРоссия
Владимир Валентинович Сизонов – д-р мед. наук, профессор
Ростов-на-Дону
А. Г. Макаров
Россия
Алексей Геннадьевич Макаров – канд. мед. наук
Ростов-на-Дону
С. М. Пакус
Россия
Сергей Михайлович Пакус – канд. мед. наук
Ростов-на-Дону
М. И. Коган
Россия
Михаил Иосифович Коган – д-р мед. наук, профессор, заслуженный деятель науки РФ
Ростов-на-Дону
Д. Г. Кварацхелия
Россия
Давид Гиаевич Кварацхелия
Ростов-на-Дону
Рецензия
Для цитирования:
Сизонов В.В., Макаров А.Г., Пакус С.М., Коган М.И., Кварацхелия Д.Г. Сравнительный анализ результатов применения робот-ассистированной и лапароскопической пиелопластики у детей. Вестник урологии. 2025;13(4):39-46. https://doi.org/10.21886/2308-6424-2025-13-4-39-46
For citation:
Sizonov V.V., Makarov A.G., Pakus S.M., Kogan M.I., Kvaratskhelia D.G. Robot-assisted and laparoscopic pyeloplasty in children: a comparative analysis of surgical outcomes. Urology Herald. 2025;13(4):39-46. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-4-39-46













































