Перейти к:
Актуальные аспекты терапии пациентов с цистиновым нефролитиазом
https://doi.org/10.21886/2308-6424-2025-13-3-126-136
Аннотация
Введение. Цистинурия — редкое генетическое заболевание, при котором в моче многократно повышена концентрация цистина. Ввиду низкой растворимости цистина в моче пациенты с цистинурией на протяжении всей жизни имеют повышенный риск образования мочевых камней. Крайне высокая частота рецидивирования требует проведения профилактики. С учётом отсутствия у большинства практикующих урологов опыта ведения пациентов с цистиновым нефролитиазом ввиду крайне низкой распространённости заболевания актуальной задачей является разработка методических рекомендаций по проведению профилактики рецидива.
Цель исследования. Обобщить данные мировой литературы по ведению пациентов с цистиновым нефролитиазом и представить алгоритм проведения профилактики заболевания.
Материалы и методы. Произведён систематический обзор литературы по зарубежным и отечественным научным базам данных с использованием ключевых слов: “cystine”, “cystine stones”, “cystinuria”, «цистин», «цистиновый нефролитиаз», «цистинурия». Проработаны 247 источников литературы, из которых в обзор включены 45.
Результаты. Несмотря на неустранимую в настоящий момент генетическую причину цистинурии, профилактика камнеобразования существенно снижает частоту рецидивирования мочекаменной болезни у таких пациентов. Профилактика цистинового нефролитиаза представляет собой мультимодальное этапное лечение. Оно заключается в уменьшении концентрации цистина в моче за счёт применения диетических стратегий и повышении его растворимости в моче благодаря её ощелачиванию, а также в использовании цистин-связывающих препаратов. В данной статье приведён пошаговый алгоритм проведения профилактики цистинового нефролитиаза, основанный на клиническом течении заболевания и таких объективных показателях, как суточная экскреция цистина и pH мочи.
Заключение. Существующие алгоритмы проведения профилактики цистинового нефролитиаза с использованием немедикаментозных и медикаментозных подходов доступны для применения в клинической практике и позволяют снизить частоту рецидивирования этого заболевания.
Для цитирования:
Гелиг В.А., Леонова Е.И., Горелов Д.С., Семенякин И.В., Гаджиев Н.К. Актуальные аспекты терапии пациентов с цистиновым нефролитиазом. Вестник урологии. 2025;13(3):126-136. https://doi.org/10.21886/2308-6424-2025-13-3-126-136
For citation:
Gelig V.A., Leonova E.I., Gorelov D.S., Semenyakin I.V., Gadzhiev N.K. Cystine nephrolithiasis: contemporary approaches to patient management. Urology Herald. 2025;13(3):126-136. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-126-136
Введение
Цистинурия — редкое генетическое заболевание, при котором в моче существенно повышается концентрация цистина, что ввиду его плохой растворимости приводит к образованию конкрементов в мочевых путях. Несмотря на то, что в общей структуре мочекаменной болезни цистиновый нефролитиаз занимает менее 1%, у детей его доля достигает 6 – 8%. При этом у 25% пациентов первые камни появляются уже до достижения 10-летнего возраста, а пиковый возраст появления первых камней из цистина приходится на период с 11 до 20 лет [1].
Изначально конкременты состоят из чистого цистина. В дальнейшем у 25 – 40% пациентов образуются смешанные камни, содержащие оксалат кальция, карбонатапатит и струвит [2]. Чаще всего это наблюдается при проведении длительного ощелачивания мочи и у пациентов с инфекцией мочевыводящих путей.
Цистиновый нефролитиаз отличается крайне высокой частотой рецидивирования. Без проведения профилакткики у 45% пациентов новый камень образуется уже в течение трёх месяцев после операции. При проведении профилактики средняя частота рецидивов снижается до 25% в течение трёх лет. Пятилетний риск рецидивирования достигает 83%, что выше, чем для любого другого типа конкрементов [3].
Пациенты с цистинурией имеют более высокий риск развития хронической почечной недостаточности в сравнении с пациентами с кальций-оксалатными камнями. Низкая растворимость цистина в мочевом фильтрате приводит к его кристаллизации в почечных канальцах, обструкции протоков Беллини. Развивающиеся интерстициальное воспаление и фиброз со временем приводят к потери функции нефронов и гломерулосклерозу. В итоге от 28% до 50% пациентов с цистинурией имеет артериальную гипертонию.
Таким образом, пациенты с цистинурией на протяжении всей жизни нуждаются в проведении профилактики рецидива, включающей в себя медикаментозную терапию и немедикаментозные подходы.
Цель исследования: обобщить данные мировой литературы по проведению профилактики цистинового нефролитиаза и представление стратегии этапного ведения пациентов.
Алгоритм литературного поиска
Был произведён систематический обзор статей зарубежных и отечественных авторов за период с 1990 по 2024 год, а также датированных более ранним временем фундаментальных статей. Поиск публикаций осуществляли в базе данных Центральной научной медицинской библиотеки Российской Федерации (eLibrary) по ключевым словам: «цистин», «цистинурия», «цистиновый нефролитиаз», «д-пеницилламин», «тиопронин», «цитрат калия», «ph мочи», «мочекаменная болезнь». Поиск зарубежных публикаций осуществлялся в базе Национальной медицинской библиотеки США (Pubmed), Science Direct и Google Scholar по ключевым словам: ”cystine; cystinuria”, ”d-penicillamine”, ”potassium citrate”, ”tiopronin”, ”urolithiasis”. Всего были проработаны 327 источников литературы. Приоритет отдавался оригинальным исследованиям.
Этиология
Цистинурия является генетически обусловленным заболеванием с наследованием по аутосомно-рецессивному типу. Также возможно аутосомно-доминантное наследование с неполной пенетрантностью. Генетическими поломками являются мутации в генах SLC3A1 на хромосоме 2, SLC7A9 на хромосоме 19 или, реже, в обоих [4].
В результате этого в почечных канальцах и кишечнике нарушается реабсорбция четырёх аминокислот: цистина, орнитина, лизина и аргинина.
Клиническое значение имеет только нарушение почечной реабсорбции цистина из первичной мочи ввиду его низкой растворимости в моче. Повышение концентрации цистина приводит к его кристаллизации с формированием конкрементов. Нарушение почечной реабсорбции орнитина, лизина и аргинина клинически незначимо, так как благодаря их хорошей растворимости в моче это не приводит к камнеобразованию. Также не имеет клинического значения и нарушение кишечной реабсорбции этих аминокислот [5].
Выделяют несколько генотипических и фенотипических типов цистинурии. Генетическое тестирование позволяет подтвердить диагноз, а также оно полезно для консультирования членов семьи. Однако его результаты не влияют непосредственно на подбор терапии у конкретного пациента [6]. Скрининг на цистинурию следует проводить у пациентов с положительным семейным анамнезом или кровным родством родителей.
Патогенез
У здоровых людей суточная экскреция цистина менее 0,125 ммоль/сутки (30 мг/сутки). У больных цистинурией при биаллельном поражении суточная экскреция цистина превышает 1,6 ммоль/сутки (400 мг/сутки) и может достигать 2,5 – 6 ммоль/сутки (600 –1400 мг/сутки) [7].
Растворимость цистина напрямую зависит от pH мочи и увеличивается по мере его повышения (рис. 1). При рН ниже 6,0 она менее 1,0 ммоль/л (240 мг/л) и остаётся примерно такой при показателях pH мочи до 7,0. Экспоненциальный рост растворимости цистина наблюдается при превышении pH 7,0. При pH 7,5 растворимость цистина составляет уже 2 ммоль/л, при pH 7,8 она уже достигает 3 ммоль/л [8][9]. Однако такие высокие показатели pH достигаются только за счёт применения лекарственных препаратов и в реальных условиях их сложно длительно поддерживать.
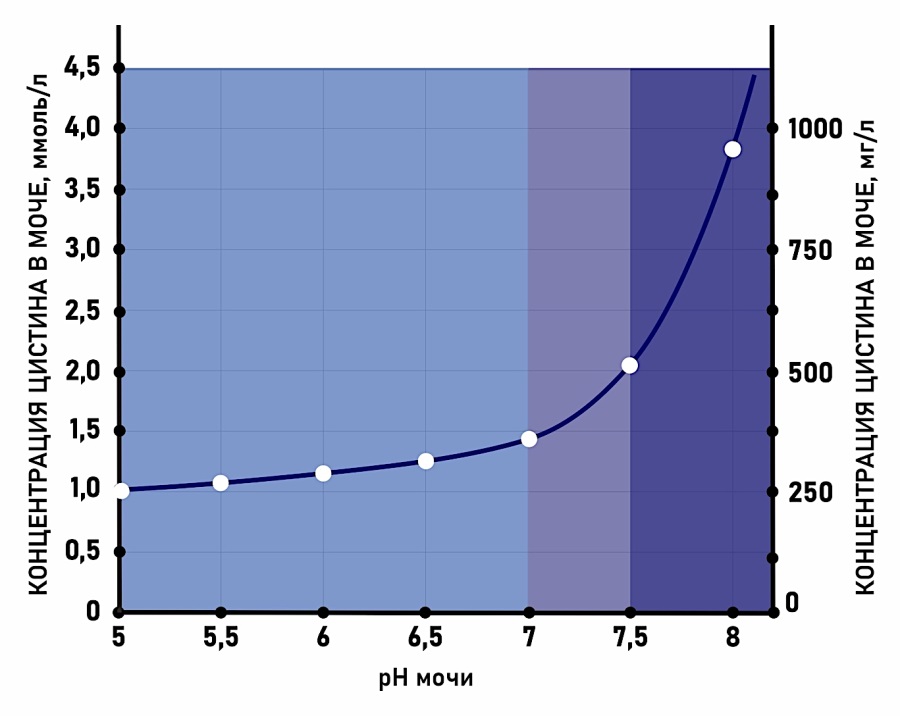
Рисунок 1. Растворимость цистина в моче в зависимости от pH [6]
Лечебная тактика
Хирургическое лечение цистиновых камней проводится по тем же принципам, что и других типов мочевых конкрементов. Цистиновые камни, несмотря на их относительно невысокую рентгенологическую плотность, по данным компьютерной томографии, устойчивы к фрагментации с помощью экстракорпоральной ударно-волновой литотрипсии. Следует учитывать нежелательность длительного стояния мочеточниковых стентов у таких пациентов ввиду их крайне быстрой инкрустации.
Всем пациентам с цистинурией показано пожизненное проведение профилактики. Её цель — достижение растворения в моче всего количества выделяющегося цистина. Снижение концентрации цистина достигается благодаря диете и увеличению суточного диуреза. Растворимость повышается за счёт ощелачивания мочи и применения цистин-связывающих препаратов.
На основе обобщения имеющихся литературных данных и клинического опыта нами предложена схема этапной профилактики цистинового нефролитиаза, базирующаяся на данных клинического течения заболевания и суточной экскреции цистина (рис. 2).
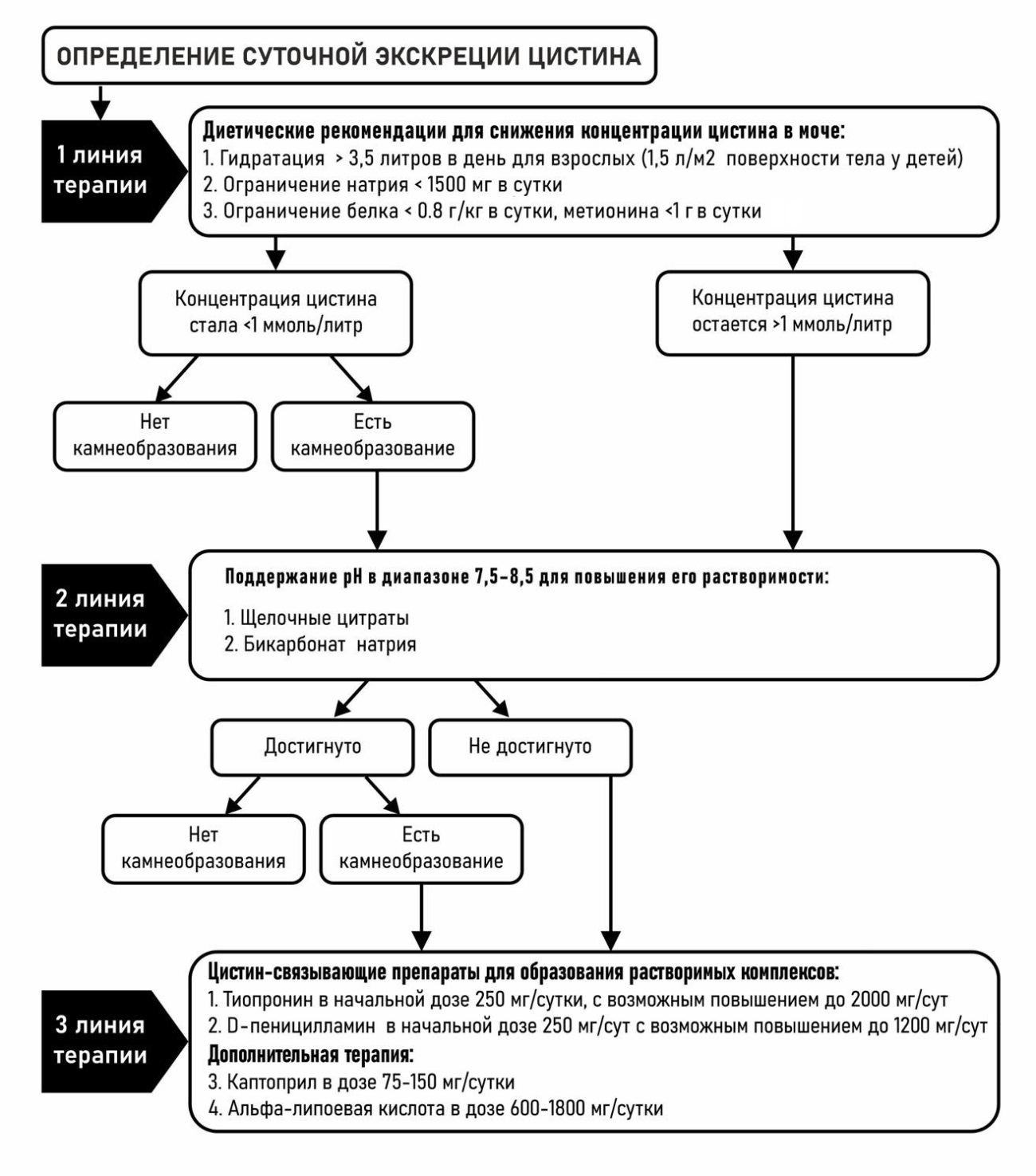
Рисунок 2. Алгоритм проведения профилактики цистинового нефролитиаза
Первым этапом определяется суточная экскреция цистина. Пациенту даются диетические рекомендации (обильное потребление жидкости, ограничение потребления натрия, белка и метионина) и повторно определяется экскреция цистина.
В случае недостижения снижения концентрации цистина в моче до целевого уровня менее 1 ммоль/л или при рецидивах камнеобразования начинается подщелачивающая терапия для постоянного поддержания pH мочи выше 7,5.
В случае невозможности постоянно поддерживать pH мочи в указанном диапазоне и при рецидивах заболевания начинается терапия цистин-связывающими препаратами. Препаратами первой линии являются тиопронин в дозе от 250 до 2000 мг/сутки и D-пеницилламин в дозе от 250 до 1200 мг/сутки. Дополнительно в качестве препаратов второй линии терапии могут применяться каптоприл в дозе 75 – 150 мг/сутки и альфа-липоевая кислота в дозе 600 – 1800 мг/сутки.
Определение суточной экскреции цистина
Концентрация цистина в моче определяется с помощью ионообменной хроматографии или капиллярного электрофореза. У взрослых пациентов стоит принимать во внимание показатели суточной экскреции, поскольку концентрация цистина в разовой моче не считается надёжным диагностическим тестом. Для этого анализа пациент производит сбор суточной мочи [10]. Только у маленьких детей в связи со сложностью сбора суточной мочи используется соотношение цистина и креатинина в разовой порции мочи.
В моче цистин присутствует в виде растворимой и нерастворимой форм, соотношение которых зависит от его концентрации, рН и катионно-анионного состава мочи [11][12]. Контролировать адекватность терапии цистин-связывающими препаратами может измерение концентрации фракций цистеина, однако это исследование доступно лишь в единичных лабораториях.
Диета при цистинурии
Задачей диеты является снижение концентрации цистина в моче. С учётом растворимости цистина в моче при pH мочи ниже 7 приемлемая концентрация цистина в моче не должна превышать 1 ммоль/л (250 мг/л). При этом некоторые эксперты считают оптимальной концентрацию менее 0,6 ммоль/л (150 мг/л) и даже менее 0,35 ммоль/л (90 мг/л) [7, 13].
Всем пациентам с цистинурией рекомендуется ограничение потребления белка животного происхождения, натрия, а также увеличение потребления жидкости. Ограничение белка необходимо для снижения поступления из пищи самого цистина и его предшественника метионина. Для достижения этой цели потребление белка взрослыми должно быть менее 0,7 – 1,0 грамма на килограмм идеального веса в сутки. Необходимо уменьшить потребление метионина, но оно не должно быть ниже физиологической потребности в 1200 – 1400 мг в сутки [14]. Снижение потребления метионина достигается за счёт отказа от продуктов с высоким содержанием метионина (табл.). Следует быть осторожным в отношении ограничения потребления белка детьми из-за потенциальных проблем с их физическим развитием.
Таблица. Продукты с высоким содержанием метионина
Продукты | Содержание, мг/100 г |
Печень | 600 |
Свинина, говядина, баранина, телятина | 400 – 550 |
Мясо птицы | 550 – 620 |
Конина | 1300 |
Твёрдый сыр (пармезан) | 930 |
Яйца | 390 |
Рыба | 600 |
Вяленая рыба | 2300 |
Раки, морепродукты | 1000 |
Нужно помнить и об опасности пищевых добавок с высоким содержанием цистина и метионина. Известны случаи быстрого прогрессирования камнеобразования вследствие употребления таких добавок [15].
Снижение потребления натрия является важной диетической рекомендацией, так как уменьшение суточной экскреции натрия сопряжено со снижением экскреции цистина [16]. Высокое потребление натрия увеличивает внутриклеточный уровень нейтральных аминокислот и нагрузку натрием, что замедляет апикальную реабсорбцию цистина [17]. Поступления натрия из продуктов питания необходимо ограничить до 2 г в день, что соответствует 6 граммам поваренной соли [18]. Объективный контроль уровня потребления натрия следует производить с помощью оценки его суточной экскреции. При соблюдении низкосолевой диеты в сутки выделяется менее 150 ммоль натрия.
Очевидным способом снижения концентрации веществ в моче является увеличение ее количества за счёт усиленного потребления жидкости. Пациентам с цистинурией необходимо выделять более 3 литров мочи в сутки. Допустимым объёмом гидратации для взрослых считается потребление 240 мл воды каждый час в дневное время и 480 мл — перед сном и по крайней мере один раз на ночь. Часто это требует от пациента подъёма среди ночи для опорожнения мочевого пузыря. У детей эти значения могут быть скорректированы таким образом, чтобы объём мочи за 24 часа превышал 2 литра / 1,73 м² [19].
Оценку питания следует проводить по заполняемым пациентами пищевым дневникам. Для контроля гидратации удобно использование мобильных приложений, например, Stone MD [20]. Несмотря на то, что эффективность диеты при цистинурии считается ограниченной, она является обязательным этапом лечения [21].
Ощелачивание мочи
Растворимость цистина коррелирует с pH мочи и начинает экспоненциально расти при pH выше 7,5, поэтому подщелачивание мочи является важным инструментом профилактики [22].
Оптимальным препаратом для подщелачивания мочи считается цитрат калия, поскольку он обеспечивает повышение pH мочи без увеличения экскреции натрия. Среднесуточная доза цитрата калия для взрослых пациентов составляет 60 – 80 мэкв/сут. и должна быть распределена на 3 – 4 приёма, включая большую дозу перед сном. Эффективная доза подбирается индивидуально для достижения терапевтических значений рН мочи в диапазоне 7,5 – 8,0 в каждой выделяемой порции мочи. Дети получают цитрат калия из расчёта 60 – 80 мэкв/1,73 м².
Поскольку 60 – 80 мэкв цитрата калия содержат 2,4 – 3,3 грамма калия, применение таких доз требует периодического контроля уровня калия в крови, особенно у пациентов с нарушением функции почек [3]. В таких случаях применяются комбинированные препараты с более низким содержанием калия, которые могут содержать в различных пропорциях цитрат, гидрокарбонат, калий, натрий и магний Поскольку цитрат калия в качестве лекарственного препарата не зарегистрирован, используются препараты, содержащие комбинацию лимонной кислоты, гидрокарбоната калия, цитрата натрия (Блемарен) или калия натрия гидроцитрат (Уралит У). Чистый бикарбонат натрия (пищевая сода) для подщелачивания мочи использовать не рекомендуется, так как натрий значительно повышает выведение цистина с мочой.
Ещё одним препаратом, способным существенно повышать pH мочи, является диуретик со слабо выраженным диуретическим эффектом — ацетазоламид. Он ингибирует фермент карбоангидразу в проксимальных извитых канальцах нефрона, что увеличивает экскрецию с мочой бикарбоната, приводя к повышению рН мочи. Ацетазоламид увеличивает экскрецию ионов натрия и калия, не оказывая влияния на экскрецию ионов хлора. Длительное его применение может вызвать метаболический ацидоз и гипоцитратурию, поэтому он может рассматриваться только как дополнительный инструмент повышения рН мочи [23].
При устойчивом показателе pH мочи выше 7,5 возможен литолиз цистиновых конкрементов, однако такой pH трудно поддерживать долгосрочно. Также следует учитывать, что при длительном поддержании высокого pH мочи возрастает риск образования кальций-фосфатных конкрементов. Поэтому необходимо строго контролировать суточную экскрецию кальция и натрия с помощью диеты и терапии тиазидными диуретиками.
Препараты для связывания цистина
Молекула цистина состоит из двух молекул цистеина, связанных вместе дисульфидной связью. Препараты на основе тиола имеют сульфгидрильные группы, которые могут разрывать эту дисульфидную связь. Образуются соединения с цистеином, которые гораздо лучше растворимы в моче, чем исходная молекула цистина.
Наиболее известными препаратами этой группы являются тиопронин и D-пеницилламин, которые существенно снижают уровень свободного цистина в моче [24][25].
D-пеницилламин, производное пенициллина, был первым тиоловым препаратом, который начали применять при цистинурии. Он был одобрен для медицинского применения в США в 1970 году, в настоящее время применяется при лечении болезни Вильсона-Коновалова, системной склеродермии, ревматоидного артрита, отравлениях медью, неорганическими соединениями ртути, свинцом.
Растворимость в моче цистеин-пеницилламинового комплекса в 50 раз выше, чем у цистина. Каждая таблетка D-пеницилламина (250 мг) снижает количество цистина в моче примерно на 75 – 100 мг. Типичная рекомендуемая доза составляет 1 – 4 г/день для взрослых и 20 – 30 мг/кг/день для детей в 3 – 4 приёма.
Терапия D-пеницилламином сопряжена с риском развития множества побочных эффектов, таких как: лихорадка, сыпь, потеря вкуса, артрит, лейкопения, апластическая анемия, почечная мембранная нефропатия с протеинурией, дефицит пиридоксина. Частота клинически значимых побочных эффектов составляет около 50%, что может ограничивать его долгосрочное применение. Поэтому терапия D-пеницилламином требует постоянного врачебного наблюдения, мониторинга функции почек, показателей крови и неврологического статуса [26]. В случае развития на фоне лечения лихорадки, нарастания протеинурии, появления гематурии, поражения лёгких, печени, выраженных гематологических или неврологических нарушений, миастении, гематурии, волчаночно-подобных реакций или других тяжёлых побочных реакций препарат отменяют и при необходимости назначают глюкокортикостероиды. В случае развития изолированной протеинурии менее 1 г/сутки, не нарастающей в динамике, терапию D-пеницилламином можно продолжать [27].
Тиопронин (тиола, α-меркаптопропионил-глицин) — это тиоловый препарат второго поколения, который действует аналогично D-пеницилламину, но считается примерно на 30% эффективнее. Имеется богатый опыт его использования, поскольку в США он был одобрен к применению в 1988 году. Стандартная доза тиопронина составляет 900 мг (300 мг три раза в день), но может быть увеличена до 1500 мг/день. Препарат необходимо принимать за 1 час до или через 2 часа после еды. Подобно D-пеницилламину, он может вызывать схожие побочные эффекты, включая сыпь, артралгию, экзантему, тромбоцитопению, протеинурию и нефротический синдром. Считается, что серьёзные побочные эффекты в сравнении с D-пеницилламином при приёме тиопронина встречаются реже. Долгосрочная терапия тиопронином оказалась возможной у 70% пациентов, а частота прекращения приема была вдвое реже, чем у D-пеницилламина [28]. Другие исследования, напротив, говорят о сравнимой частоте побочных эффектов у этих двух препаратов [29][30].
Способностью связывать цистин обладает также ингибитор ангиотензинпревращающего фермента каптоприл, использующийся для лечения артериальной гипертензии. Каптоприл метаболизируется в печени с образованием дисульфидного димера каптоприла и каптоприл-цистеиндисульфида. Соединения каптоприла и цистеина обладают хорошей растворимостью в моче. Рекомендуемая доза для взрослых составляет 150 мг/день, а для детей — 1,5 – 6 мг/кг/день в 3 приёма. Поскольку каптоприл обладает гипотензивным и антипротеинурическим эффектами, он может быть препаратом выбора для пациентов с цистинурией и гипертонией. Побочные эффекты включают гиперкалиемию, острое повреждение почек, кашель и гипотонию. Несмотря на безопасность и небольшое количество побочных эффектов, клиническая эффективность каптоприла у пациентов с цистинурией остаётся неясной.
В исследовании 1995 года 9 пациентов с гомозиготной цистинурией получали 150 мг каптоприла в день в качестве дополнения к стандартной терапии. Частота эпизодов камнеобразования снизилась с 1,9 до 1,03 за год, однако различие оказалось статистически недостоверным [31]. В ожидании результатов других, более строгих исследований каптоприл следует считать разумным вариантом лечения пациентов с цистинурией в случае неприменимости или недостаточного эффекта терапии D-пеницилламином и тиопронином [32].
Таким образом, широкое применение цистин-связывающих препаратов ограничено их побочными эффектами. Терапия ими целесообразна, когда гидратация и подщелачивание мочи не позволяют достичь необходимых уровней концентрации цистина при приемлемых показателях pH (менее 1 ммоль/л при pH ниже 7) [33]. По мнению K. Andreassen, терапию тиоловыми препаратами следует начинать при концентрации цистина выше 2 ммоль/л в дополнение к гидратационной терапии и ощелачиванию мочи [3]. Оптимальная дозировка препаратов варьируется от пациента к пациенту. Для тиопронина она составляет от 15 до 40 мг/кг/сут, для D-пеницилламина — от 20 до 30 мг/кг/сут в четыре приёма [34]. Более высокую дозу рекомендуется давать перед сном. Продолжительность лечения из-за потенциального долгосрочного токсичного воздействия этих препаратов определяется индивидуально.
Также стоит подчеркнуть, что ежедневное соблюдение рекомендаций по питанию, режиму потребления жидкости и ежедневному приему лекарственных препаратов требует от пациентов с цистинурией высокой приверженности к лечению. Её поддержанию способствуют информирование и поддержка пациентов в рамках образовательных программ, например, «Школах здоровья для пациентов с мочекаменной болезнью» [35].
Перспективные терапевтические возможности
Буцилламин — препарат третьего поколения на основе тиола, который в настоящее время доступен только в Японии и Южной Корее, где был одобрен только для лечения ревматоидного артрита. Имеющийся 30-летний опыт применения буцилламина в Азии продемонстрировал его низкий профиль токсичности. Как дитиоловое соединение, он теоретически должен быть эффективнее тиопронина и иметь лучшую переносимость, поскольку потребуется его меньшее количество, что уже было показано в одном небольшом исследовании [36]. В настоящий момент в Соединенных Штатах проводится 2-я фаза многоцентрового клинического исследования NCT02942420 применения буцилламина в лечении гиперцистинурии.
Также недавно были предложены новые препараты на основе L-цистиндиамида, которые выступают в качестве ингибиторов кристаллизации L-цистина, однако целесообразность их применения ещё не подтверждена [37][38].
Способностью увеличивать растворимость цистина в моче обладает альфа-липоевая кислота (тиоктовая кислота, 5-(1,2-дитиолан-3-ил)пентановая кислота). Она ингибировала образование цистиновых камней у мышей с нокаутом гена slc3a1 [39]. Эта тиолсодержащая безрецептурная пищевая добавка не меняет концентрацию цистина в моче. Механизм действия остаётся неизвестным, и её применение у людей требует дальнейшей оценки. Оптимальная доза при цистинурии пока не установлена. В 2023 году начато плацебо-контролируемое исследование NCT02910531 оценки эффективности и безопасности использования альфа-липоевой кислоты в дозе 1200 мг в сутки у пациентов с цистинурией с трёхлетним периодом наблюдения [40]. Поскольку применение альфа-липоевой кислоты в дозе от до 1800 мг в сутки у больных сахарным диабетом или невропатией оказалось безопасным, альфа-липоевую кислоту следует рассматривать в качестве полезного дополнительного препарата с хорошей переносимостью [41].
Ещё одним потенциальным направлением терапии является применение ингибиторов натрий-глюкозного котранспортера 2-го типа (SGLT-2), используемых сейчас при лечении сахарного диабета и сердечной недостаточности. Предполагается, что, взаимодействуя с цистином, глюкоза нарушает дисульфидную связь, превращая его в две растворимые в моче молекулы цистеина. Ингибиторы SGLT-2 повышают концентрацию глюкозы в моче за счёт подавления её реабсорбции. Согласно данным исследования Калифорнийского университета, в котором оценивали влияние ингибитора SGLT-2 дапаглифлозина на течение цистинового нефролитиаза у 10 пациентов, терапия помогла снизить частоту эпизодов камнеобразования. В настоящее время проводится клиническое исследование 2-й фазы для проверки эффективности дапаглифлозина, ингибитора натрий-глюкозного котранспортера 2 проксимальных канальцев (SGLT-2), у пациентов с цистинурией [42].
Потенциальную пользу может принести приём препарата толваптана — единственного перорального антагониста рецепторов вазопрессина V-2. Связываясь с этими рецепторами в собирательных канальцах нефрона, толваптан способствует выводу свободной воды, увеличивая диурез без потери электролитов [43]. Препарат был одобрен FDA для лечения прогрессирующего аутосомно-доминантного поликистозного заболевания почек и гипонатриемии, связанной с синдромом неадекватной секреции антидиуретического гормона. В настоящее время проводится пилотное клиническое исследование, оценивающее влияние препарата толваптан на содержание цистина в моче пациентов с гомозиготной цистинурией [44].
Перспективной областью для разработки новых методов лечения цистинурии является таргетная генная терапия [45]. Цистинурия, по-видимому, является идеальным кандидатом для генной терапии, учитывая её известную генетическую основу, приводящую к экспрессии дефектного переносчика цистина клетками проксимальных канальцев и вероятность того, что даже частичное уменьшение потери цистина в канальцах окажет большое влияние на клинические течение заболевания.
Заключение
Целью всех перечисленных методов лечения цистинурии является достижение условий, при которых содержащееся в моче количество цистина будет находиться в растворенном состоянии: для пациентов с pH мочи ниже 7 концентрация цистина должна быть менее 250 мг/л. Первой обязательной линией терапии являются диетические рекомендации в виде снижения потребления белка животного происхождения и натрия, а также усиленная гидратация.
При невозможности снизить концентрацию цистина до данных значений при физиологических показателях pH мочи следует использовать дополнительную ощелачивающую терапию для поддержания pH мочи выше 7,5. Если данные целевые показатели не могут быть достигнуты или долгосрочно поддерживаться, или данные меры оказываются недостаточными для контроля над образованием конкрементов, следующим шагом в лечении активных формирователей цистиновых камней становится терапия цистин-связывающими препаратами на основе тиола, возможно, с применение дополнительных препаратов (ацетазоламид, каптоприл, альфа-липоевая кислота).
Несмотря на невысокую встречаемость цистинового нефролитиаза, из-за крайне высокой частоты рецидивирования и сложностей проведения метафилактики, актуальной задачей остаётся поиск новых терапевтических возможностей этого заболевания.
Список литературы
1. Biyani CS, Cartledge JJ. Cystinuria—diagnosis and management. EAU-EBU Update Ser. 2006;4(5):175-183. DOI: 10.1016/j.eeus.2006.06.001
2. Reinstatler L, Stern K, Batter H, Scotland KB, Ardekani GS, Rivera M, Chew BH, Eisner B, Krambeck AE, Monga M, Pais VM Jr. Conversion from Cystine to Noncystine Stones: Incidence and Associated Factors. J Urol. 2018;200(6):1285-1289. Erratum in: J Urol. 2019;201(3):629. DOI: 10.1016/j.juro.2018.07.047
3. Andreassen KH, Pedersen KV, Osther SS, Jung HU, Lildal SK, Osther PJ. How should patients with cystine stone disease be evaluated and treated in the twenty-first century? Urolithiasis. 2016;44(1):65-76. DOI: 10.1007/s00240-015-0841-x
4. Eisner BH, Goldfarb DS, Baum MA, Langman CB, Curhan GC, Preminger GM, Lieske JC, Pareek G, Thomas K, Zisman AL, Papagiannopoulos D, Sur RL. Evaluation and Medical Management of Patients with Cystine Nephrolithiasis: A Consensus Statement. J Endourol. 2020;34(11):1103-1110. DOI: 10.1089/end.2019.0703
5. Shen L, Cong X, Zhang X, Wang N, Zhou P, Xu Y, Zhu Q, Gu X. Clinical and genetic characterization of Chinese pediatric cystine stone patients. J Pediatr Urol. 2017;13(6):629.e1-629.e5. DOI: 10.1016/j.jpurol.2017.05.021
6. Servais A, Thomas K, Dello Strologo L, Sayer JA, Bekri S, Bertholet-Thomas A, Bultitude M, Capolongo G, Cerkauskiene R, Daudon M, Doizi S, Gillion V, Gràcia-Garcia S, Halbritter J, Heidet L, van den Heijkant M, Lemoine S, Knebelmann B, Emma F, Levtchenko E; Metabolic Nephropathy Workgroup of the European Reference Network for Rare Kidney Diseases (ERKNet) and eUROGEN. Cystinuria: clinical practice recommendation. Kidney Int. 2021;99(1):48-58. DOI: 10.1016/j.kint.2020.06.035
7. Bouzidi H, Daudon M. Cystinurie : du diagnostic à la surveillance thérapeutique [Cystinuria: from diagnosis to follow-up]. Ann Biol Clin (Paris). 2007;65(5):473-481. (In French). PMID: 17913667
8. DENT CE, Friedman M, Green H, Watson LC. Treatment of cystinuria. Br Med J. 1965;1(5432):403-408. PMID: 14237920
9. Tiselius HG. New horizons in the management of patients with cystinuria. Curr Opin Urol. 2010;20(2):169-173. DOI: 10.1097/MOU.0b013e328333b674
10. Akakura K, Egoshi K, Ueda T, Nozumi K, Kotake T, Masai M, Ito H. The long-term outcome of cystinuria in Japan. Urol Int. 1998;61(2):86-89. DOI: 10.1159/000030294
11. Горбачевский П.Р., Парамонова Н.С., Юрага Т.М., Гресь Н.А. Нормальные значения экскреции аминокислот цистина, лизина и аргинина у здоровых детей и у пациентов с дисметаболической нефропатией. Нефрология. 2017;21(3):81-86. DOI: 10.24884/1561-6274-2017-3-81-86
12. Pak CY, Fuller CJ. Assessment of cystine solubility in urine and of heterogeneous nucleation. J Urol. 1983;129(5):1066-1070. DOI: 10.1016/s0022-5347(17)52543-4
13. van Hoeve K, Vermeersch P, Regal L, Levtchenko E. Necessity of fractionated urine collection for monitoring patients with cystinuria. Clin Chem. 2011;57(5):780-781. DOI: 10.1373/clinchem.2010.161547
14. Rodman JS, Blackburn P, Williams JJ, Brown A, Pospischil MA, Peterson CM. The effect of dietary protein on cystine excretion in patients with cystinuria. Clin Nephrol. 1984;22(6):273-278. PMID: 6441658
15. Gillion V, Saussez TP, Van Nieuwenhove S, Jadoul M. Extremely rapid stone formation in cystinuria: look out for dietary supplements! Clin Kidney J. 2021;14(6):1694-1696. DOI: 10.1093/ckj/sfab013
16. Jendle-Bengten C, Tiselius HG. Long-term follow-up of stone formers treated with a low dose of sodium potassium citrate. Scand J Urol Nephrol. 2000;34(1):36-41. DOI: 10.1080/003655900750016869
17. Nagamori S, Wiriyasermkul P, Guarch ME, Okuyama H, Nakagomi S, Tadagaki K, Nishinaka Y, Bodoy S, Takafuji K, Okuda S, Kurokawa J, Ohgaki R, Nunes V, Palacín M, Kanai Y. Novel cystine transporter in renal proximal tubule identified as a missing partner of cystinuria-related plasma membrane protein rBAT/SLC3A1. Proc Natl Acad Sci U S A. 2016;113(3):775-780. DOI: 10.1073/pnas.1519959113
18. Chillarón J, Font-Llitjós M, Fort J, Zorzano A, Goldfarb DS, Nunes V, Palacín M. Pathophysiology and treatment of cystinuria. Nat Rev Nephrol. 2010;6(7):424-434. DOI: 10.1038/nrneph.2010.69
19. Claes DJ, Jackson E. Cystinuria: mechanisms and management. Pediatr Nephrol. 2012;27(11):2031-2038. DOI: 10.1007/s00467-011-2092-6
20. Гаджиев Н.К., Бровкин С.С., Григорьев В.Е., Дмитриев В.В., Малхасян В.А., Шкарупа Д.Д., Писарев А.В., Мазуренко Д.А., Обидняк В.М., Попов С.В., Тагиров Н.С., Король В.Д., Петров С.Б. Метафилактика мочекаменной болезни в смартфоне, или mHealth по-русски. Педиатр. 2016;(7):84-91. DOI: 10.17816/PED7384-91
21. Siener R, Bitterlich N, Birwé H, Hesse A. The Impact of Diet on Urinary Risk Factors for Cystine Stone Formation. Nutrients. 2021;13(2):528. DOI: 10.3390/nu13020528
22. Гаджиев Н.К., Гелиг В.А., Кутина А.В., Горгоцкий И.A., Kapпищeнкo А.И., Горелов Д.С., Семенякин И.В., Закуцкий А.Н., Кулешов О.В., Шкарупа Д.Д. Кислотно-основное состояние (pH) мочи: механизм регуляции и его роль в метафилактике мочекаменной болезни. Вестник урологии. 2022;10(4):120-140. DOI: 10.21886/2308-6424-2022-10-4-120-140
23. Sterrett SP, Penniston KL, Wolf JS Jr, Nakada SY. Acetazolamide is an effective adjunct for urinary alkalization in patients with uric acid and cystine stone formation recalcitrant to potassium citrate. Urology. 2008;72(2):278-281. DOI: 10.1016/j.urology.2008.04.003
24. Dolin DJ, Asplin JR, Flagel L, Grasso M, Goldfarb DS. Effect of cystine-binding thiol drugs on urinary cystine capacity in patients with cystinuria. J Endourol. 2005;19(3):429-432. DOI: 10.1089/end.2005.19.429
25. DeBerardinis RJ, Coughlin CR 2nd, Kaplan P. Penicillamine therapy for pediatric cystinuria: experience from a cohort of American children. J Urol. 2008;180(6):2620-2623. DOI: 10.1016/j.juro.2008.08.057
26. Kumar V, Singh AP, Wheeler N, Galindo CL, Kim JJ. Safety profile of D-penicillamine: a comprehensive pharmacovigilance analysis by FDA adverse event reporting system. Expert Opin Drug Saf. 2021;20(11):1443-1450. DOI: 10.1080/14740338.2021.1956460
27. Joly D, Rieu P, Méjean A, Gagnadoux MF, Daudon M, Jungers P. Treatment of cystinuria. Pediatr Nephrol. 1999;13(9):945-950. DOI: 10.1007/s004670050736
28. Rezaee ME, Rule AD, Pais VM Jr. What are the main challenges to the pharmacological management of cystinuria? Expert Opin Pharmacother. 2020;21(2):131-133. DOI: 10.1080/14656566.2019.1691522
29. Prot-Bertoye C, Lebbah S, Daudon M, Tostivint I, Bataille P, Bridoux F, Brignon P, Choquenet C, Cochat P, Combe C, Conort P, Decramer S, Doré B, Dussol B, Essig M, Gaunez N, Joly D, Le Toquin-Bernard S, Méjean A, Meria P, Morin D, N’Guyen HV, Noël C, Normand M, Pietak M, Ronco P, Saussine C, Tsimaratos M, Friedlander G, Traxer O, Knebelmann B, Courbebaisse M; French Cystinuria Group. CKD and Its Risk Factors among Patients with Cystinuria. Clin J Am Soc Nephrol. 2015;10(5):842-851. DOI: 10.2215/CJN.06680714
30. Prot-Bertoye C, Lebbah S, Daudon M, Tostivint I, Jais JP, Lillo-Le Louët A, Pontoizeau C, Cochat P, Bataille P, Bridoux F, Brignon P, Choquenet C, Combe C, Conort P, Decramer S, Doré B, Dussol B, Essig M, Frimat M, Gaunez N, Joly D, Le Toquin-Bernard S, Méjean A, Meria P, Morin D, N’Guyen HV, Normand M, Pietak M, Ronco P, Saussine C, Tsimaratos M, Friedlander G, Traxer O, Knebelmann B, Courbebaisse M; French Cystinuria Group. Adverse events associated with currently used medical treatments for cystinuria and treatment goals: results from a series of 442 patients in France. BJU Int. 2019;124(5):849-861. DOI: 10.1111/bju.14721
31. Cohen TD, Streem SB, Hall P. Clinical effect of captopril on the formation and growth of cystine calculi. J Urol. 1995;154(1):164-166. PMID: 7776415
32. Biyani CS, Palit V, Daga S. The Use of Captopril-Angiotensin Converting Enzyme (ACE) Inhibitor for Cystinuria During COVID-19 Pandemic. Urology. 2020;141:182-183. DOI: 10.1016/j.urology.2020.04.057
33. Fattah H, Hambaroush Y, Goldfarb DS. Cystine nephrolithiasis. Transl Androl Urol. 2014;3(3):228-233. DOI: 10.3978/j.issn.2223-4683.2014.07.04
34. Dello Strologo L, Laurenzi C, Legato A, Pastore A. Cystinuria in children and young adults: success of monitoring free-cystine urine levels. Pediatr Nephrol. 2007;22(11):1869-1873. DOI: 10.1007/s00467-007-0575-2
35. Гаджиев Н.К., Горелов Д.С., Акопян Г.Н., Гелиг В.А., Иванов А.О., Петров С.Б., Крюкова Н.Ю., Рева С.А., Пономарева Ю.А., Аль-Шукри А.С., Мищенко А.А., Когай М.А., Васильев В.Н., Чернышева Д.Ю., Обидняк В.М., Макарьин В.А., Писарев А.В., Закуцкий А.Н., Кузьмин И.В., Амдий Р.Э., Корнеев И.А., Аль-Шукри С.Х. «Школы пациентов» с мочекаменной болезнью и заболеваниями предстательной железы. Вестник урологии. 2020;8(1):110-120. DOI: 10.21886/2308-6424-2020-8-1-110-120
36. Daga S, Palit V, Forster JA, Biyani CS, Joyce AD, Dimitrova AB. An Update on Evaluation and Management in Cystinuria. Urology. 2021;149:70-75. DOI: 10.1016/j.urology.2020.12.025
37. Hu L, Yang Y, Aloysius H, Albanyan H, Yang M, Liang JJ, Yu A, Shtukenberg A, Poloni LN, Kholodovych V, Tischfield JA, Goldfarb DS, Ward MD, Sahota A. l-Cystine Diamides as l-Cystine Crystallization Inhibitors for Cystinuria. J Med Chem. 2016;59(15):7293-7298. DOI: 10.1021/acs.jmedchem.6b00647
38. Yang Y, Albanyan H, Lee S, Aloysius H, Liang JJ, Kholodovych V, Sahota A, Hu L. Design, synthesis, and evaluation of l-cystine diamides as l-cystine crystallization inhibitors for cystinuria. Bioorg Med Chem Lett. 2018;28(8):1303-1308. DOI: 10.1016/j.bmcl.2018.03.024
39. Zee T, Bose N, Zee J, Beck JN, Yang S, Parihar J, Yang M, Damodar S, Hall D, O’Leary MN, Ramanathan A, Gerona RR, Killilea DW, Chi T, Tischfield J, Sahota A, Kahn A, Stoller ML, Kapahi P. α-Lipoic acid treatment prevents cystine urolithiasis in a mouse model of cystinuria. Nat Med. 2017;23(3):288-290. DOI: 10.1038/nm.4280
40. Chi T. Lipoic Acid Supplement for Cystine Stone (ALA). Accessed on 8 January 2023. URL:https://clinicaltrials.gov/ct2/show/NCT02910531
41. Cil O, Perwad F. α-Lipoic Acid (ALA) Improves Cystine Solubility in Cystinuria: Report of 2 Cases. Pediatrics. 2020;145(5):e20192951. DOI: 10.1542/peds.2019-2951
42. Stoller M.L. Long Term Clinical Efficacy of Sodium-Glucose Cotransporter-2 (SGLT-2) Inhibitor in Cystinurics. Accessed on 8 January 2023. URL:https://clinicaltrials.gov/ct2/show/NCT05058859e
43. Bai Y, Tang Y, Wang J, Wang X, Wang Z, Cao D, Han P, Wang J. Tolvaptan treatment of cystine urolithiasis in a mouse model of cystinuria. World J Urol. 2021;39(1):263-269. DOI: 10.1007/s00345-020-03166-3
44. Nelson CP, Kurtz MP, Venna A, Cilento BG Jr, Baum MA. Pharmacological Dilutional Therapy Using the Vasopressin Antagonist Tolvaptan for Young Patients With Cystinuria: A Pilot Investigation. Urology. 2020;144:65-70. DOI: 10.1016/j.urology.2020.07.002
45. Peek JL, Wilson MH. Gene therapy for kidney disease: targeting cystinuria. Curr Opin Nephrol Hypertens. 2022;31(2):175-179. DOI: 10.1097/MNH.0000000000000768
Об авторах
В. А. ГелигРоссия
Виталий Аркадьевич Гелиг
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Е. И. Леонова
Россия
Елена Ивановна Леонова — канд. биол. наук.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Д. С. Горелов
Россия
Дмитрий Сергеевич Горелов
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. В. Семенякин
Россия
Игорь Владимирович Семенякин — д-р мед. наук.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Н. К. Гаджиев
Россия
Нариман Казиханович Гаджиев — д-р мед. наук.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Гелиг В.А., Леонова Е.И., Горелов Д.С., Семенякин И.В., Гаджиев Н.К. Актуальные аспекты терапии пациентов с цистиновым нефролитиазом. Вестник урологии. 2025;13(3):126-136. https://doi.org/10.21886/2308-6424-2025-13-3-126-136
For citation:
Gelig V.A., Leonova E.I., Gorelov D.S., Semenyakin I.V., Gadzhiev N.K. Cystine nephrolithiasis: contemporary approaches to patient management. Urology Herald. 2025;13(3):126-136. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-126-136













































