Перейти к:
Молекулярно-генетические подтипы немышечно-инвазивного рака мочевого пузыря и их влияние на прогноз заболевания
https://doi.org/10.21886/2308-6424-2025-13-3-71-81
Аннотация
Введение. Рак мочевого пузыря входит в число часто встречающихся онкологических заболеваний с высокими показателями рецидивирования и прогрессии, включая его поверхностные формы — немышечно-инвазивный рак мочевого пузыря (НМИРМП). В последние годы особый интерес вызывает изучение молекулярно-генетических особенностей опухолей, которые наряду со степенью злокачественности и стадией заболевания оказывают значительное влияние на прогноз заболевания.
Цель исследования. Изучить влияние молекулярно-генетических подтипов немышечно-инвазивного рака мочевого пузыря на прогноз заболевания и целесообразность их оценки в рутинной клинической практике.
Материалы и методы. Нами проведено ретроспективное исследование, включившее 162 пациента с первичным НМИРМП, подвергшихся лечению в период с 2011 по 2021 год. Во всех случаях выполнено иммуногистохимическое исследование (ИГХ-исследование) послеоперационного материала с антителами к GATA3, CK5/6 и FOXA1 и осуществлено наблюдение пациентов с оценкой рисков рецидива и прогрессии в зависимости от молекулярно-генетических подтипов НМИРМП. Медиана наблюдения составила 36 месяцев.
Результаты. По результатам ИГХ опухоли были разделены на 4 подтипа: люминальный (96 (59,3%)), люминально-подобный (51 (31,5%)), промежуточный (5 (3,1%)) и базально-плоскоклеточно-подобный (10 (6,2%)). При дальнейшем наблюдении процент рецидивов и прогрессий в группах значимо различался: люминальные опухоли были связаны с низкой вероятностью к рецидивированию и прогрессии (33,3% и 2,1%), люминально-подобные опухоли рецидивировали в 54,9% и имели низкую вероятность прогрессирования — 5,9%, а промежуточные и базально-плоскоклеточно-подобные опухоли были ассоциированы с высоким риском рецидивирования (100% и 90,0% соответственно) и прогрессии (25,0% и 50,0% соответственно) (p < 0,05).
Заключение. Базально-плоскоклеточно-подобные опухоли обладают худшим прогнозом в отношении рецидивов и прогрессий заболевания и требуют более агрессивного лечения, тогда как люминальные опухоли являются наиболее благоприятными в отношении прогноза.
Ключевые слова
Для цитирования:
Саргсян Ш.М., Котов С.В., Зарецкий А.Р., Бадлаева А.С., Гуспанов Р.И., Пульбере С.А., Литвин Д.В. Молекулярно-генетические подтипы немышечно-инвазивного рака мочевого пузыря и их влияние на прогноз заболевания. Вестник урологии. 2025;13(3):71-81. https://doi.org/10.21886/2308-6424-2025-13-3-71-81
For citation:
Sargsian Sh.M., Kotov S.V., Zaretskiy A.R., Badlaeva A.S., Guspanov R.I., Pulbere S.A., Litvin D.V. Molecular genetic subtypes of non-muscle-invasive bladder cancer: their impact on disease prognosis. Urology Herald. 2025;13(3):71-81. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-71-81
Введение
Рак мочевого пузыря (РМП) входит в первую десятку по встречаемости (9,5 и 2,4 случая на 100 000 мужчин и женщин соответственно, варьируясь в разных регионах мира в зависимости от факторов риска, качества и доступности медицинского сопровождения). Смертность от данного заболевания достигает 3,3 и 0,86 случая на 100 000 мужчин и женщин соответственно [1]. При первичной диагностике бо́льшая доля (75%) выявленного РМП является поверхностным — немышечно-инвазивным раком мочевого пузыря (НМИРМП) [1][2]. Известно, что результаты лечения НМИРМП значительно превосходят аналогичные при лечении мышечно-инвазивных форм (МИРМП) по летальности и количеству осложнений, однако частые рецидивы ухудшают качество жизни пациентов и требуют больших ресурсов системы здравоохранения [1][3][4]. В настоящее время многие учёные продолжают процесс совершенствования методов диагностики и лечения НМИРМП для предотвращения прогрессии заболевания и улучшения результатов лечения. С накоплением знаний и анализом методов лечения стало очевидным, что для значительного прогресса в борьбе с НМИРМП необходим учёт молекулярно-генетических особенностей как мышечно-инвазивных, так и немышечно-инвазивных форм РМП [5]. В данном исследовании мы провели анализ молекулярно-генетических форм НМИРМП и изучили их влияние на прогноз заболевания.
Цель исследования: оценить влияние молекулярно-генетических подтипов немышечно-инвазивного рака мочевого пузыря на прогноз заболевания и целесообразность их внедрения в рутинную клиническую практику.
Материалы и методы
В исследование включены 162 пациента (122 (75,3%) мужчин и 40 (24,7%) женщин) с впервые выявленным НМИРМП, которым с 2011 по 2021 год в университетской клинике урологии была выполнена трансуретральная резекция (ТУР) мочевого пузыря.
Критериями включения являлись наличие первичного НМИРМП, согласие на участие в исследовании и наблюдение > 2 лет с проведением контрольных обследований. Критериями исключения являлись наличие сопутствующей карциномы in situ, отказ от участия в исследовании, невозможность контакта с пациентом, отсутствие контроля отдалённых результатов, отсутствие данных о проведённых цистоскопиях, МРТ или УЗИ мочевого пузыря.
При en-bloc ТУР применяли как лазерную энергию, так и энергию биполярного электротока, тогда как при стандартной ТУР применяли лишь биполярный электроток. В послеоперационном периоде, согласно клиническим рекомендациям, в 71% случаев после ТУР была проведена адъювантная внутрипузырная химиотерапия (ВПХТ). В случаях, когда проведение ВПХТ представлялось невозможным или пациенты отказывались от неё, через уретральный катетер подключали систему непрерывного орошения мочевого пузыря (СНОМП) на 24 часа.
Послеоперационное наблюдение представляло собой выполнение цистоскопий (при невозможности проведения цистоскопии или отказе пациентов от неё — МРТ мочевого пузыря или УЗИ мочевого пузыря) раз в 3 месяца на протяжении первого года после оперативного вмешательства, раз в 6 месяцев — на протяжении второго года после оперативного вмешательства и раз в год — начиная с третьего года после операционного вмешательства при отсутствии рецидивирования и / или прогрессии. При подозрении на рецидивирование и / или прогрессию заболевания производили ТУР с последующей гистологической оценкой полученного препарата.
После стандартного патогистологического исследования послеоперационного материала для определения молекулярно-генетических подтипов было проведено иммуногистохимическое исследование (ИГХ-исследование).
Иммуногистохимическое исследование. Биоптаты опухолевой ткани мочевого пузыря фиксировали в 10%-м нейтральном (забуференном) формалине в течение 24 часов. Далее материал обрабатывали по стандартной методике и заливали в парафин. Срезы с парафиновых блоков толщиной 5 мкм наносили на стёкла с адгезивным покрытием PCI (Citotest Labware Co., Ltd, Haimen, Jiangsu, China). Препараты окрашивали антителами к маркерным белкам CK5/6 и GATA3, а также к белку FOXA1 при помощи иммуностейнера BenchMark XT ("Ventana Medical Systems, Inc.", Tucson, AZ, USA / Roche, Basel, Switzerland) с использованием стандартных протоколов (температура инкубации 37 градусов, время инкубации 20 минут), панели детекции DAB Universal ultraView (Ventana Medical Systems, Inc., Tucson, AZ, USA / Roche, Basel, Switzerland) и первичных моноклональных антител, указанных в таблице 1. На начальном этапе исследования проводили отработку титров для антител к GATA3 и FOXA1. Оптимальные титры, использованные в дальнейшем при анализе опухолевых образцов, приведены в таблице 1.
Таблица 1. Антитела, использованные при ИГХ
Table 1. Antibodies used in IHC
Мишень антитела Antibody target | Клон Clone | Хост Host | Разведение Breeding | Производитель Manufacturer |
Cytokeratin 5/6 человека Cytokeratin 5/6 human | D5/16B4 | мышь mouse | ready-to-use | "Roche Diagnostics AG", Rotkreuz, Switzerland |
GATA3 человека GATA3 human | L50-823 | мышь mouse | 1/100 | "Cell Marque Corp.", Rocklin, CA, USA |
FOXA1 человека FOXA1 human | EPR1084 | кролик rabbit | 1/300 | "Abcam plc", Cambridge, UK |
Люминальный молекулярный подтип характеризовался позитивным ядерным окрашиванием с GATA3, негативной реакцией с СК5/6 и реакцией с FOXA1 равной 8 баллам. Люминально-подобный молекулярный подтип демонстрировал одновременно позитивное ядерное окрашивание с GATA3 и позитивное цитоплазматическое окрашивание с СК5/6 или негативное ядерное окрашивание с GATA3 и негативное цитоплазматическое окрашивание с СК5/6 и реакцию с FOXA1, равную 5 – 8 баллам. Промежуточный молекулярный подтип — одновременно позитивное ядерное окрашивание с GATA3 и позитивное цитоплазматическое окрашивание с СК5/6 или негативное ядерное окрашивание с GATA3 и негативное цитоплазматическое окрашивание с СК5/6 и реакцию с FOXA1, равную 0 – 4 баллам. Базально-плоскоклеточно-подобный молекулярный подтип имел позитивное цитоплазматическое окрашивание с СК5/6 и негативную реакцию с GATA3 и с FOXA1.
Статистический анализ. Статистический анализ и обработку полученных данных осуществляли с помощью электронных таблиц Microsoft Office Excel (Microsoft Corp., Redmond, WA, USA) для Mac ver.16.76 и пакета прикладных программ IBM SPSS Statistics ver. 26.0 (SPSS: An IBM Company, IBM SPSS Corp., Armonk, NY, USA), StatTech ver. 4.8.0 (ООО «Статтех», Россия). Нормальность распределения определяли с помощью теста Колмогорова-Смирнова-Lilliefors. Количественные данные описывались с помощью медианы (Me, нижнего и верхнего квартилей [ IQR — Q1; Q3] — в тексте представлено как Ме [IQR]. Категориальные данные описывались с указанием абсолютных значений (n) и процентных долей (%). При отсутствии нормального распределения данных использовали методы непараметрической статистики (U критерий Mann-Whitney). Для нахождения различий между качественными показателями использовали метод Pearsons’ χ2 с поправкой Yates на непрерывность. Статистически значимыми считали различия при р <0,05 (95% уровень значимости).
Для изучения длительности безрецидивной выживаемости, выживаемости без прогрессии больных НМИРМП после ТУР мочевого пузыря был применён анализ по Kaplan-Meier. Для выявления значимости клинических параметров и результатов лечения в рецидивировании и прогрессии заболевания проведён однофакторный и многофакторный анализ.
Для разработки прогностической модели рецидива НМИРМП на основе молекулярно-генетических факторов проводили анализ влияния факторов на выживаемость (возникновение рецидива с учётом времени) по Kaplan-Meier с оценкой функции выживаемости и расчётом лог-рангового теста. Далее проводили моделирование зависимости вероятности наступления рецидива от статистически значимо влияющих факторов риска. Использовали две математические модели: модель логистической регрессии (логит-модель) и модель регрессии Cox, учитывающей время наступление рецидива. Наилучший прогностический результат показала модель логистической регрессии. Модель строили пошаговым методом включения переменных на основе изменения критерия правдоподобия модели.
Поскольку значения всех факторов (независимые переменные) в модели логистической регрессии были сгруппированы, производили кодировку параметров полученной модели логистической регрессии и рассчитывали коэффициенты для каждой из них. Таким образом, было получено уравнение для вероятности наступления рецидива.
На основе полученного уравнения построена прогностическая модель и написана программа: модель прогнозирования риска рецидивирования на основе молекулярно-генетических факторов. Программа содержит код на языке синтаксиса IBM SPSS Statistics для расчётов полученной модели, исходную выборку для обучения и калькулятор скоринга пациентов в MS Excel на основе построенной модели. Тип ЭВМ: ПК Язык: Синтаксис IBM SPSS Statistics 26.0, MS Excel ОС: Windows 7\8\10\11.
Результаты
Медиана возраста пациентов составила 67,00 [ 59,00; 72,00] лет. Интраоперационные показатели и подробные результаты лечения представлены в таблице 2.
Таблица 2. Интраоперационные показатели и результаты лечения в раннем послеоперационном периоде
Table 2. Intraoperative parameters and treatment results in the early postoperative period
Показатели | Indicators | Значения | Values | |
Me [ IQR] | ||
Время операции, мин | Operation time, min | 35,00 [ 30,00; 50,00] | |
Количество опухолей, n | Number of tumors, n | 1,00 [ 1,00; 2,00] | |
Размеры опухолей, мм | Tumor sizes, mm | 20,00 [ 16,00; 30,00] | |
n (%) | ||
Вид операции | Type of operation | сТУР | cTURBT | 135 (83,33) |
еТУР | eTURBT | 27 (16,67) | |
Применяемая энергия | Applied energy | Биполярный электроток | Bipolar electric current | 148 (91,36) |
Лазерная энергия | Laser energy | 14 (8,64) | |
Лечение в раннем п/о Treatment in the early post-op period | СНОМП | CBIS | 47 (29,0) |
ВПХТ | intravesical chemotherapy | 115 (71,0) | |
Осложнения по Clavien | Clavien grade | Нет | No | 154 (95,1) |
Clavien 1 | 2 (1,2) | |
Clavien 2 | 1 (0,6) | |
Clavien 3 | 5 (3,1) | |
Примечание. сТУР — стандартная трансуретральная резекция; еТУР — en-bloc трансуретральная резекция; п/о — послеоперационный период; СНОМП — система непрерывного орошения мочевого пузыря; ВПХТ — внутрипузырная химиотерапия
Note. sTUR — standard transurethral resection; eTUR — en bloc transurethral resection; CBIS — continuous bladder irrigation system; IVCT — intravesical chemotherapy
По результатам патологоанатомического исследования у 94 (58%) выявлена стадия Ta, у 68 (42%) — Т1. Низкая степень злокачественности определена у 122 (75,3%) пациентов, высокая — у 40 (24,7%). Мышечный слой был представлен в 147 (90,7%) препаратах.
По результатам лечения пациенты разделены на 4 группы риска по прогностической модели европейской организации исследования и лечения рака / European Organization for Research and Treatment of Cancer (EORTC) 2006 года. Среди 162 пациентов 87 (53,7%) имели низкий риск рецидива и прогрессии заболевания, 43 (26,5%) пациента — средний риск, 25 (15,4%) — высокий риск, а 7 (4,3%) — очень высокий риск.
По результатам ИГХ-исследования пациенты разделены на 4 группы: пациенты с люминальными опухолями — 96 (59,3%), пациенты с люминально-подобными опухолями — 51 (31,5%), пациенты с промежуточными опухолями — 5 (3,1%) и пациенты с базально-плоскоклеточно-подобными опухолями — 10 (6,2%).
Медиана сроков послеоперационного наблюдения составила 60 месяцев. Рецидив заболевания в течение 3 лет выявлен у 74 (45,7%) пациентов, а прогрессия — у 11 (6,8%) пациентов.
На количество рецидивов статистически значимого влияния не оказывали такие факторы, как пол пациентов, время операции, наличие послеоперационных осложнений по Clavien, размер опухолей, проведение ВПХТ или налаживание СНОМП, наличие мышечного слоя в послеоперационном препарате (p > 0,05).
На количество прогрессий статистически значимого влияния не оказывали такие факторы, как пол пациентов, их средний возраст, время операции, наличие послеоперационных осложнений по Clavien, вид оперативного вмешательства, применяемая энергия при оперативном вмешательстве, количество опухолей, размер опухолей, проведение ВПХТ или налаживание СНОМП, наличие мышечного слоя в послеоперационном препарате, Т-стадия заболевания, степень злокачественности опухолей и группа риска по прогностической модели EORTC-2006 (p > 0,05).
В таблице 3 продемонстрированы факторы, статистически значимо влияющие на развитие рецидива заболевания. Кривая безрецидивной выживаемости продемонстрирована на рисунке 1.
Таблица 3. Факторы, имеющие значимое влияние на рецидив заболевания (p < 0,05)
Table 3. Predictors significantly associated with disease recurrence (p < 0.05)
Фактор | Factor | Без рецидива No relapse | С рецидивом With relapse | Р | |
Me [ IQR] | ||||
Возраст, лет | Age, years | 66 [ 56,75; 70,00] | 68,5 [ 63,25; 73,75] | 0,007* | |
Количество опухолей | Number of tumors | 1 [ 1; 2] | 1 [ 1; 3] | 0,02* | |
n (%) | ||||
Вид операции Type of operation | сТУР | cTURBT | 68 (51,1) | 65 (48,9) | 0,029** |
еТУР | eTURBT | 20 (74,1) | 7 (25,9) | ||
Примененная энергия Applied energy | Биполярный электроток | Bipolar electric current | 75 (50,7) | 73 (49,3) | 0,003*** |
Лазерная энергия | Laser energy | 13 (92,9) | 1 (7,1) | ||
Т-стадия T-stage | Ta | 60 (63,8) | 34 (36,2) | 0,004** |
T1 | 28 (41,2) | 40 (58,8) | ||
Степень злокачественности Degree of malignancy | LG | 74 (60,7) | 48 (39,3) | 0,005** |
HG | 14 (35) | 26 (65) | ||
Прогноз по модели EORTC- 2006 Forecast according to the EORTC 2006 | Низкий риск | Low risk | 58 (66,7) | 29 (33,3) | 0,006** |
Средний риск | Medium risk | 19 (44,2) | 24 (55,2) | ||
Высокий риск | High risk | 8 (32) | 17 (68) | ||
Очень высокий риск | Very high risk | 3 (42,9) | 4 (57,1) | ||
Молекулярно-генетический подтип Molecular genetic subtype | Люминальный | Luminal | 64 (66,7) | 32 (33,3) | < 0,001** |
Люминально-подобный | Luminal-like | 23 (45,1) | 28 (54,9) | ||
Промежуточный | Intermediate | 0 (0,0) | 5 (100) | ||
Базально-плоскоклеточно-подобный Basal-squamous-like | 1 (10) | 9 (90) | ||
Примечания: 1) сТУР — стандартная трансуретральная резекция; еТУР — en-bloc трансуретральная резекция; LG — низкий риск; HG — высокий риск; EORTC — Европейская организация исследования и лечения рака. 2) * — Mann-Whitney U test; ** — Pearson Chi-Square; *** — Fisher's exact criterion
Notes: 1) UR — standard transurethral resection; eTUR — en bloc transurethral resection; LG — low grade; HG — high grade; EORTC — European Organization for Research and Treatment of Cancer. 2) * — Mann-Whitney U test; ** — Pearson Chi-Square; *** — Fisher's exact criterion
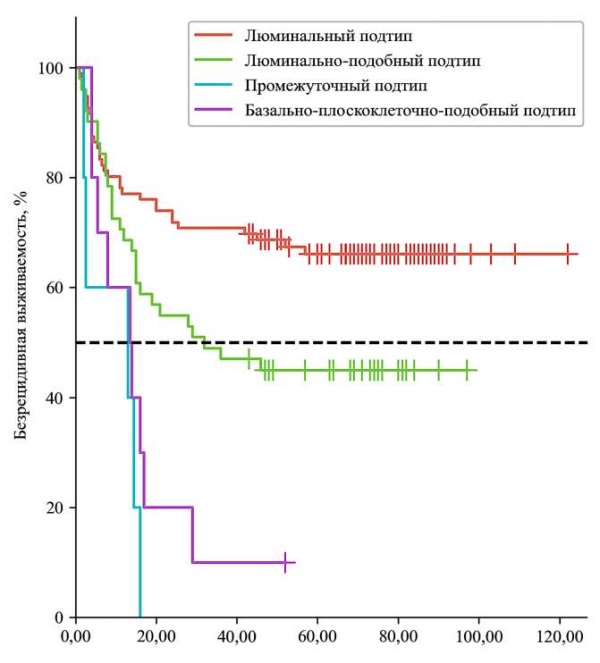
Рисунок 1. Кривая безрецидивной выживаемости в зависимости от молекулярного подтипа
Figure 1. Relapse-free survival curve according to molecular subtype
Средний возраст пациентов без рецидива был ниже. Также снижали вероятность рецидива en-bloc ТУР и выполнение оперативного вмешательства с помощью лазерной энергии. Среднее количество опухолей было одинаковым у пациентов с рецидивом и без, однако разброс данных был выше у пациентов с рецидивом. Стадия заболевания и степень злокачественности опухоли также являлись предиктором рецидива (в группе пациентов с рецидивом преобладали пациенты со стадией Т1 и с высокой степенью злокачественности).
Прогностическая модель EORTC-2006, как и молекулярно-генетический подтипы РМП имели значимую прогностическую ценность. В группе пациентов с рецидивом больше пациентов со средним, высоким и очень высоким риском рецидивирования, а также пациентов с опухолями промежуточного, базально-плоскоклеточно-подобного и люминально-подобного типов. Таким образом, одну из ключевых ролей в прогнозировании рецидива заболевания играет молекулярно-генетический подтип РМП.
Молекулярно-генетические подтипы НМИРМП также играют ведущую роль в прогнозировании прогрессии (p < 0,001), как указано на рисунке 2: у пациентов с промежуточным и базально-плоскоклеточно-подобным подтипами заметно ниже выживаемость без прогрессии.
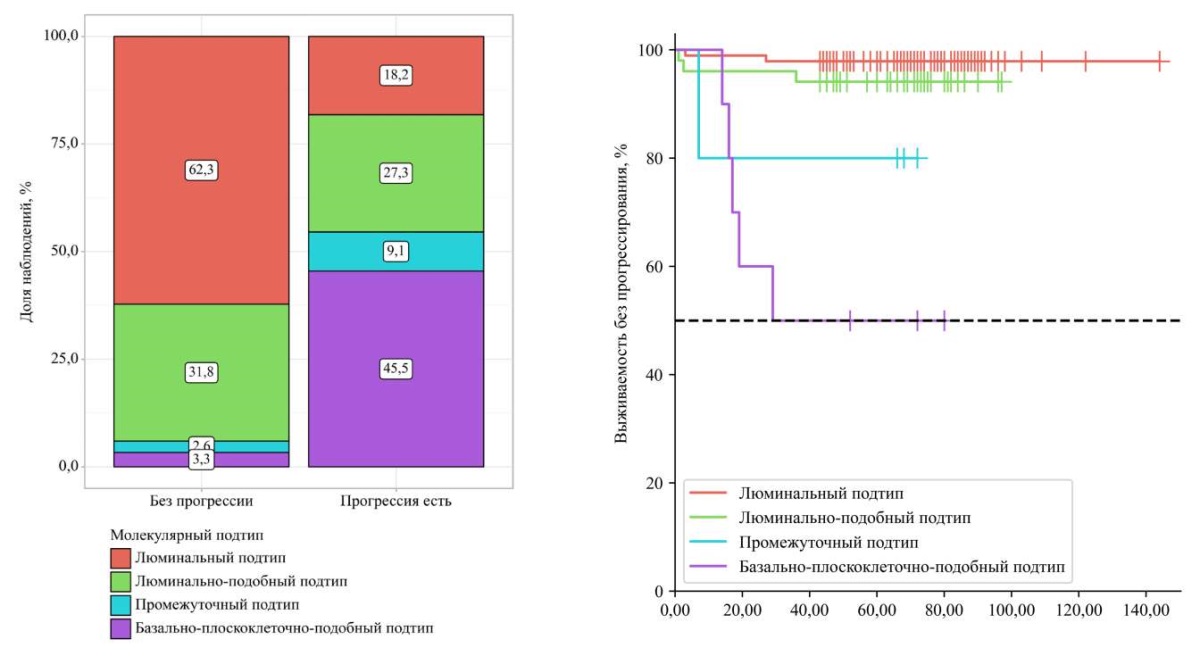
Рисунок 2. Распределение по молекулярному подтипу в группе пациентов с прогрессией заболевания и без прогрессии (p < 0,001) и кривая выживаемости без прогрессирования в зависимости от молекулярного подтипа
Figure 2. Distribution of molecular subtypes in patients with and without disease progression (p < 0.001) and progression-free survival curves stratified by molecular subtype
По результатам многофакторного анализа также подтверждено значение молекулярно-генетических факторов на течение заболевания. В таблице 4 показаны значимые факторы, влияющие на рецидивирование и прогрессирование заболевания.
Таблица 4. Многофакторный анализ факторов, имеющих значимое влияние на рецидив и прогрессию заболевания (p < 0,05)
Table 4. Multivariable Cox regression analysis of predictors for tumor recurrence and disease progression (p < 0.05)
Факторы, влияющие на рецидив и прогрессию Factors Affecting Progression | Нескорректированный Unadjusted | Скорректированный Adjusted | ||
HR; 95% ДИ HR; 95% CI | p | HR; 95% ДИ HR; 95% CI | p | |
Факторы риска рецидива | Risk factor for relapse | ||||
Возраст Age | 1,030; 1,007 – 1,053 | 0,010* | 1,035; 1,009 – 1,061 | 0,008* |
Группа среднего риска по EORTC-2006 EORTC 2006 intermediate risk group | 2,181; 1,249 – 3,806 | 0,006* | 2,650; 1,452 – 4,837 | 0,001* |
Группа высокого риска по EORTC-2006 EORTC 2006 high risk group | 2,521; 1,357 – 4,686 | 0,003* | 2,537; 1,331 – 4,833 | 0,005* |
Группа очень высокого риска по модели EORTC-2006 EORTC 2006 very high risk group | 2,126; 0,743 – 6,078 | 0,159 | 1,977; 0,683 – 5,720 | 0,209 |
Люминально-подобный подтип Luminal-like subtype | 2,045; 1,210 – 3,457 | 0,008* | 2,034; 1,188 – 3,480 | 0,010* |
Промежуточный подтип Intermediate subtype | 6,993; 2,651 – 18,448 | < 0,001* | 7,536; 2,772 – 20,488 | < 0,001* |
Базально-плоскоклеточно-подобный подтип Basal-squamous-like subtype | 4,507; 2,106 – 9,649 | < 0,001* | 3,533; 1,627 – 7,668 | 0,001* |
Люминальный подтип Luminal subtype | 0,460; 0,273 – 0,775 | 0,003* | 0,460; 0,273 – 0,775 | 0,003* |
Лазерная энергия при операции Laser energy used | 0,084; 0,011 – 0,656 | 0,018* | 0,024; 0,001 – 0,465 | 0,014* |
Фактор риска прогрессии | Risk factor for progression | ||||
Люминальный подтип Luminal subtype | 0,306; 0,066 – 1,409 | 0,128 | 0,306; 0,066 – 1,409 | 0,128 |
Люминально-подобный подтип Luminal-like subtype | 0,898; 0,241 – 3,350 | 0,872 | 0,898; 0,241 – 3,350 | 0,872 |
Промежуточный подтип Intermediate subtype | 3,591; 0,369 – 34,918 | 0,271 | 3,591; 0,369 – 34,918 | 0,271 |
Базально-плоскоклеточно-подобный подтип Basal-squamousl-like subtype | 14,364; 3,607 – 57,226 | < 0,001 | 14,364; 3,607 – 57,226 | < 0,001 |
Примечание. EORTC — Европейская организация исследования и лечения рака
Note. EORTC — European Organization for Research and Treatment of Cancer
Для разработки прогностической модели использовали факторы, которые после анализа обладали достаточной прогностической ценностью. В итоговое уравнение логистической регрессии вошли такие факторы, как молекулярный подтип, возраст, морфологическая стадия, количество опухолей. Уравнение оказалось статистически значимым со всеми коэффициентами логистической регрессии на уровне p < 0,05.
При люминально-подобном молекулярном типе риск рецидива в среднем в 2,9 раза выше, чем при люминальном. При промежуточном или базально-плоскоклеточном типе риск выше в 37,2 раза по сравнению с люминальным типом. Пациенты в возрасте старше 67 лет имеют соотношение шансов рецидива по сравнению с группой до 67 лет включительно в 2,1 раза выше. При количестве опухолей от 2 и более шанс рецидива увеличивается в 2,5 раза. При морфологической стадии T1 соотношение шансов рецидива составляет 2,8 по сравнению с теми, у кого стадия Ta.
Уравнение для вероятности наступления рецидива можно записать формулой:
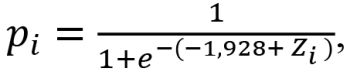
где,
Zi=1,074*X1_2+3,617*X1_3+0,756*X2_2+0,906*X3_3+1,037*X4_2;
Xi_j – значения исходных независимых переменных.
Данное уравнение регрессии при пороге отсечения вероятности 0,5 предсказывает 77,3% наступивших рецидивов (чувствительность модели) и 60,8% ненаступивших рецидивов (специфичность модели), при этом общая прогностическая способность модели удовлетворительная и составляет около 70,0%.
После построения логистической регрессии для анализа качества её классификации и общей прогностической силы был проведён ROC-анализ и проанализирована площадь под ROC-кривой. Также для сравнения брали прогноз по EORTC-2006 (рис. 3).
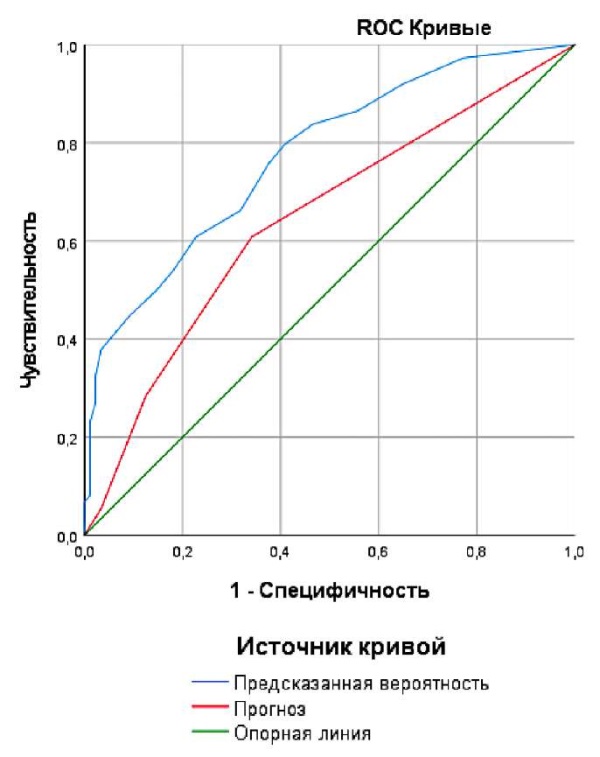
Рисунок 3. ROC-кривая многофакторной модели прогноза рецидива по сравнению с прогнозом по EORTC-2006.
Figure 3. ROC curve analysis of the multivariable recurrence prediction model compared with EORTC-2006 risk stratification
Площадь под кривой AUC для полученной модели составила 0,774 c 95% ДИ от 0,702 до 0,845, что соответствует хорошему качеству построенной прогностической модели. Для прогноза по EORTC-2026 площадь под кривой AUC равна 0,643 с 95% ДИ от 0,557 до 0,728.
Обсуждение
Лечение НМИРМП представляет собой длительный процесс, включающий оперативное вмешательство и последующее лечение и наблюдение, зависящий от качества медицинской помощи и результатов патологоанатомического исследования послеоперационного материала [1][6][7].
По нашим данным, пол пациентов, время операции, наличие послеоперационных осложнений по Clavien, размер опухолей, проведение ВПХТ или налаживание СНОМП, наличие мышечного слоя в послеоперационном препарате не имели значимого влияния на развитие рецидивов и прогрессирование заболевания (p > 0,05). По нашему мнению, нивелирование данных факторов связано с усовершенствованием протоколов лечения.
С течением времени и накоплением знаний стало очевидно, что одним из значимых факторов, влияющих на течение заболевания, являются молекулярно-генетические особенности НМИРМП [1][5]. В нашем исследовании с целью масштабирования и внедрения в широкую клиническую практику молекулярно-генетического типирования НМИРМП выполнено ИГХ-исследование для определения его подтипов. Как видно из работы французских коллег, данный метод является достаточно точным и позволяет классифицировать РМП без необходимости выполнения дорогостоящих генетических исследований [5][8].
Необходимо отметить, что ранее были проведены работы, посвящённые изучению молекулярно-генетических особенностей, НМИРМП и разработана классификация. Так, G. Sjödahl et al. (2012) после изучения экспрессии белков на поверхности опухолевых клеток и изучения их генотипа и мутаций разделили все опухоли на 7 кластеров и 5 подтипов: уробазальный А (кластеры MS1a и MS1b), геномно-нестабильный (кластеры MS2a1и MS2a2), уробазальный В (кластер MS2b2.1), плоскоклеточно-подобный (кластер MS2b2.2) и инфильтративный (кластер MS2b1) [9].
Ещё одной комплексной работой по изучению молекулярно-генетических особенностей НМИРМП является исследование S.V. Lindskrog et al. (2021). Авторы провели генетический, протеомный, транскриптомный анализы, анализ мутаций, микроокружения опухоли, экспрессируемых на поверхности клеток белков. Авторы выделили 3 класса по результатам комплексного изучения опухолевых образцов: 1, 2а, 2b и 3 классы [10].
Результаты, полученные нами и коллегами, оказались тождественными (табл. 5).
Таблица 5. Соответствие результатов различных исследований
Table 5. Concordance between the results of different studies
Молекулярно-генетический подтип Molecular genetic subtype | Результаты | Results G. Sjödahl et al. [9] | Результаты | Results S.V. Lindskrog et al. [10] |
Люминальный | Luminal | Уробазальный А | Urobasal A | 1 класс | 1 class |
Люминально-подобный | Luminal-like | Геномно-нестабильный | Genomically unstable | 2a класс | 2a class |
Инфильтративный | Infiltrated | ||
Промежуточный | Intermediate | Уробазальный В | Urobasal B | 2b класс | 2b class |
Базально-плоскоклеточно-подобный | Basal-squamous-like | Плоскоклеточно-подобный | Squamous-like | 3 класс | 3 class |
В отношении молекулярно-генетических подтипов и их влияния на лечение и прогноз заболевания также достигнут консенсус по молекулярно-генетическим подтипам МИРМП, который является одним из самых фундаментальных трудов современности в изучении РМП. Согласно консенсусу, существует 6 подтипов МИРМП (люминальный папиллярный, люминальный неспецифический, люминальный нестабильный, стромальный, базальный / плоскоклеточный и нейроэндокриноподобный), обладающих различными генетическими и мутационными особенностями, различным профилем экспрессии антигенов, микроокружением опухолей, прогнозом заболевания и ответом на лечение [5][11].
Таким образом, молекулярно-генетические подтипы НМИРМП обладают значительным влиянием на прогноз заболевания, являясь предиктором как рецидива заболевания, так и прогрессии. Разработанная нами прогностическая модель и программа ЭВМ для расчёта риска рецидива на основе молекулярно-генетических подтипов НМИРМП превосходит по чувствительности и специфичности прогностическую модель EORTC 2006 года. Наши результаты не противоречат мировым данным и соответствуют выводам коллег, изучающих данную проблематику: большая часть НМИРМП является люминальной или имеет признаки люминальных опухолей и обладает лучшим прогнозом, тогда как небольшая часть является базально-плоскоклеточно-подобной с неблагоприятным прогнозом. Небольшая часть опухолей, названных нами промежуточными, по результатам ИГХ-исследования не могла быть отнесена к остальным подтипам. Мы полагаем, что дальнейшее исследование генетического материала и профиля мутаций сможет распределить промежуточный и люминально-подобный подтипы в другие категории или подтвердить их непринадлежность к остальным подтипам.
Заключение
ИГХ-исследование образцов ткани после ТУР мочевого пузыря у пациентов с НМИРМП и его классификация по молекулярно-генетическим подтипам может существенно улучшить прогнозирование рисков рецидивирования и прогрессии заболевания. Учёт молекулярно-генетических подтипов для планирования дальнейшей тактики лечения и мониторинга является необходимым для улучшения прогноза и перехода к персонифицированной медицине.
Необходимы дальнейшие исследования, организация консенсуса аналогичного консенсусу по МИРМП, для широкого внедрения в клиническую практику молекулярно-генетической классификации НМИРМП.
Список литературы
1. EAU Guidelines. Neuro-urology. Edn. presented at the EAU Annual Congress Paris 2024. (accessed on 07.03.2025) uroweb.org/guidelines/neuro-urology
2. Compérat E, Larré S, Roupret M, Neuzillet Y, Pignot G, Quintens H, Houéde N, Roy C, Durand X, Varinot J, Vordos D, Rouanne M, Bakhri MA, Bertrand P, Jeglinschi SC, Cussenot O, Soulié M, Pfister C. Clinicopathological characteristics of urothelial bladder cancer in patients less than 40 years old. Virchows Arch. 2015;466(5):589-594. DOI: 10.1007/s00428-015-1739-2
3. Котов С.В., Гуспанов Р.И., Пульбере С.А., Хачатрян А.Л., Саргсян Ш.М., Краев Ю.П., Самойлов Д.А. Сравнение en-bloc резекции стенки мочевого пузыря с опухолью со стандартной трансуретральной резекцией мочевого пузыря при лечении немышечно-инвазивного рака мочевого пузыря. Онкоурология. 2024;20(2):101-109. DOI: 10.17650/1726-9776-2024-20-2-101-109
4. Котов С.В., Хачатрян А.Л., Котова Д.П., Журавлева А.К., Саргсян Ш.М. Сравнительный анализ послеоперационных хирургических осложнений и летальности после радикальной цистэктомии. Кардиоваскулярная терапия и профилактика. 2021;20(S1):43-44. eLIBRARY ID: 45556776; EDN: JRHJZI
5. Котов С.В., Хачатрян А.Л., Саргсян Ш.М. Молекулярно-генетические подтипы рака мочевого пузыря. Вестник урологии. 2023;11(3):108-117. DOI: 10.21886/2308-6424-2023-11-3-108-117
6. Котов С.В., Гуспанов Р.И., Хачатрян А.Л., Пульбере С.А., Саргсян Ш.М., Журавлева А.К. Применение en-bloc резекции стенки мочевого пузыря с опухолью при лечении немышечно-инвазивного рака мочевого пузыря. Онкоурология. 2022;18(4):120-128. DOI: 10.17650/1726-9776-2022-18-4-120-128
7. Martin-Doyle W, Leow JJ, Orsola A, Chang SL, Bellmunt J. Improving selection criteria for early cystectomy in high-grade t1 bladder cancer: a meta-analysis of 15,215 patients. J Clin Oncol. 2015;33(6):643-650. DOI: 10.1200/JCO.2014.57.6967
8. Bontoux C, Rialland T, Cussenot O, Compérat E. A four-antibody immunohistochemical panel can distinguish clinico-pathological clusters of urothelial carcinoma and reveals high concordance between primary tumor and lymph node metastases. Virchows Arch. 2021;478(4):637-645. DOI: 10.1007/s00428-020-02951-0
9. Sjödahl G, Lauss M, Lövgren K, Chebil G, Gudjonsson S, Veerla S, Patschan O, Aine M, Fernö M, Ringnér M, Månsson W, Liedberg F, Lindgren D, Höglund M. A molecular taxonomy for urothelial carcinoma. Clin Cancer Res. 2012;18(12):3377-3386. DOI: 10.1158/1078-0432.CCR-12-0077-T
10. Lindskrog SV, Prip F, Lamy P, Taber A, Groeneveld CS, Birkenkamp-Demtröder K, Jensen JB, Strandgaard T, Nordentoft I, Christensen E, Sokac M, Birkbak NJ, Maretty L, Hermann GG, Petersen AC, Weyerer V, Grimm MO, Horstmann M, Sjödahl G, Höglund M, Steiniche T, Mogensen K, de Reyniès A, Nawroth R, Jordan B, Lin X, Dragicevic D, Ward DG, Goel A, Hurst CD, Raman JD, Warrick JI, Segersten U, Sikic D, van Kessel KEM, Maurer T, Meeks JJ, DeGraff DJ, Bryan RT, Knowles MA, Simic T, Hartmann A, Zwarthoff EC, Malmström PU, Malats N, Real FX, Dyrskjøt L. An integrated multi-omics analysis identifies prognostic molecular subtypes of non-muscle-invasive bladder cancer. Nat Commun. 2021;12(1):2301. DOI: 10.1038/s41467-021-22465-w.
11. Kamoun A, de Reyniès A, Allory Y, Sjödahl G, Robertson AG, Seiler R, Hoadley KA, Groeneveld CS, Al-Ahmadie H, Choi W, Castro MAA, Fontugne J, Eriksson P, Mo Q, Kardos J, Zlotta A, Hartmann A, Dinney CP, Bellmunt J, Powles T, Malats N, Chan KS, Kim WY, McConkey DJ, Black PC, Dyrskjøt L, Höglund M, Lerner SP, Real FX, Radvanyi F; Bladder Cancer Molecular Taxonomy Group. A Consensus Molecular Classification of Muscle-invasive Bladder Cancer. Eur Urol. 2020;77(4):420-433. DOI: 10.1016/j.eururo.2019.09.006
Об авторах
Ш. М. СаргсянРоссия
Шаген Мхитарович Саргсян
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
С. В. Котов
Россия
Сергей Владиславович Котов — д-р мед. наук, профессор.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Р. Зарецкий
Россия
Андрей Ростиславович Зарецкий
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. С. Бадлаева
Россия
Алина Станиславовна Бадлаева — канд. мед. наук.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Р. И. Гуспанов
Россия
Ренат Иватуллаевич Гуспанов — канд. мед. наук.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
С. А. Пульбере
Россия
Сергей Александрович Пульбере — д-р мед. наук.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Д. В. Литвин
Россия
Литвин Даниил Вячеславович
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Саргсян Ш.М., Котов С.В., Зарецкий А.Р., Бадлаева А.С., Гуспанов Р.И., Пульбере С.А., Литвин Д.В. Молекулярно-генетические подтипы немышечно-инвазивного рака мочевого пузыря и их влияние на прогноз заболевания. Вестник урологии. 2025;13(3):71-81. https://doi.org/10.21886/2308-6424-2025-13-3-71-81
For citation:
Sargsian Sh.M., Kotov S.V., Zaretskiy A.R., Badlaeva A.S., Guspanov R.I., Pulbere S.A., Litvin D.V. Molecular genetic subtypes of non-muscle-invasive bladder cancer: their impact on disease prognosis. Urology Herald. 2025;13(3):71-81. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-71-81













































