Перейти к:
Критерии дифференциальной диагностики мужского иммунного бесплодия
https://doi.org/10.21886/2308-6424-2025-13-3-30-38
Аннотация
Введение. Аутоиммунные реакции против сперматозоидов — одна из причин мужского бесплодия. В присутствии антиспермальных антител (АСАТ) может быть снижена подвижность сперматозоидов, нарушены капацитация и акросомная реакция, повышена фрагментация ДНК сперматозоидов. При этом актуальные нормативные документы ВОЗ не приводят критерии диагноза «иммунное мужское бесплодие» и предлагают формировать региональные критерии референтных диапазонов на основе определения 5% – 95%-ных центилей у фертильных мужчин.
Цель исследования. Установить референтные диапазоны доли АСАТ-IgG-позитивных сперматозоидов фертильных мужчин-россиян для повышения клинико-экономической эффективности оказания помощи бесплодным парам.
Материалы и методы. Исследование обсервационное, наблюдательное, многоцентровое, поперечное, ретроспективное. АСАТ на сперматозоидах определяли рекомендованным ВОЗ методом смешанной реакции агглютинации MAR-IgG (“FertiPro”, Beernem, Belgium). Сформирована выборка фертильных мужчин (n = 358), соответствующих следующим критериям: 1) диагностирована беременность у жены (ХГЧ > 100 мМЕ/мл и / или визуализация плодного яйца при УЗИ), наступившая в естественном цикле за период < 12 месяцев после отмены контрацепции + 3 месяца от даты выполнения анализа в специализированной андрологической лаборатории; 2) отсутствие какого-либо специфического лечения не менее чем за 3 месяца до даты беременности. Выделяли группы, в которых объём, концентрация, подвижность, морфология сперматозоидов соответствуют референтным диапазонам по критериям ВОЗ-2021 (группа 1; n = 255) и российским региональным критериям (В.А. Божедомов и соавт., 2023) (группа 2; n = 337).
Результаты. В выборке фертильных мужчин (n = 358) данные MAR-IgG-теста от 0 до 100%: медиана = 0%; 5% – 95%-ные центили — 0% – 40%; MAR-IgG > 40% в 4,5% случаев (16 из 358). В группе 1 все случаи MAR-IgG > 10% — статистически выпадающие (англ. «non-outlier range»), 95%-ный центиль — 36%. По российским критериям выпадающими являются MAR-IgG-теста > 12%, 95%-ный центиль — 40%. Различия между группами 1 и 2 по перекрещиванию рядов и частотам случаев статистически незначимы (p > 0,05).
Заключение. У мужчин-россиян не более 12% прогрессивно-подвижных сперматозоидов должны быть IgG-позитивными. При 13 – 40% IgG-позитивных прогрессивно-подвижных сперматозоидов иммунный фактор бесплодия вероятен. Беременность статистически маловероятна при > 40% IgG-позитивных подвижных сперматозоидов даже при нормозооспермии, что можно считать признаком высокого риска иммунного бесплодия.
Ключевые слова
Для цитирования:
Божедомов В.А., Липатова Н.А., Камарина Р.А., Божедомова А.В., Корнеев И.А., Камалов А.А. Критерии дифференциальной диагностики мужского иммунного бесплодия. Вестник урологии. 2025;13(3):30-38. https://doi.org/10.21886/2308-6424-2025-13-3-30-38
For citation:
Bozhedomov V.A., Lipatova N.A., Kamarina R.A., Bozhedomova A.V., Korneev I.A., Kamalov A.A. Male immune infertility: criteria for differential diagnosis. Urology Herald. 2025;13(3):30-38. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-30-38
Введение
Антиспермальные антитела (АСАТ) были впервые зарегистрированы у бесплодных мужчин ещё в 1954 году [1]. АСАТ — это антитела, которые распознают антигены на поверхности сперматозоида и связываются с ними [2 – 4]. Аутоиммунные реакции против сперматозоидов, когда сперматозоиды покрыты АСАТ — одна из причин мужского бесплодия по классификации ВОЗ1. При этом могут быть снижены подвижность, происходить агглютинация, нарушены капацитация и акросомная реакция, повышена фрагментация ДНК [3][5 – 7]. Однако актуальное «Руководство ВОЗ по исследованию спермы» не определяет критерии постановки диагноза «Иммунное бесплодие» и предлагает формировать региональные критерии референтных диапазонов на основе определения 5% и 95%-ных центилей у фертильных мужчин2. Неопределённость в критериях диагноза «Мужское иммунное бесплодие» привела к тому, что многие центры по лечению бесплодия и андрологические лаборатории отказались от тестирования АСАТ [8], а профессиональные общества не рекомендуют тестирование АСАТ на первом этапе оценки фертильности мужчин3,4 [9][10].
Цель исследования: установить референтные диапазоны процента АСАТ-IgG-позитивных прогрессивно-подвижных сперматозоидов фертильных мужчин-россиян для повышения клинико-экономической эффективности оказания помощи бесплодным парам.
Материалы и методы
Исследование обсервационное наблюдательное многоцентровое поперечное ретроспективное. АСАТ на сперматозоидах определяли рекомендованным ВОЗ методом смешанной реакции агглютинации — тест «MAR-IgG» («FertiPro», Beernem, Belgium) 2.
По результатам клинико-лабораторного обследования сформирована выборка фертильных мужчин (n = 358), соответствующих следующим критериям:
- диагностированная беременность (ХГЧ > 100 мМЕ/мл и / или визуализация плодного яйца при УЗИ) у жены (постоянной партнёрши) в естественном цикле в период менее 12 месяцев после отмены контрацепции;
- исследование эякулята выполнено в специализированных андрологических лабораториях по протоколам ВОЗ;
- между датой выполненного исследования и расчётной датой наступления беременности прошло не более 3 месяцев (анализ мог быть выполнен до даты беременности или после установления факта беременности);
- отсутствие какого-либо специфического лечения не менее чем за 3 месяца до даты беременности;
- исход беременности (роды, медицинские аборты, выкидыши, замершие беременности) не учитывался.
Чтобы минимизировать влияние других показателей базового исследования эякулята выделены группы, в которых объём, концентрация, подвижность, морфология сперматозоидов соответствовали референтным диапазонам по критериям ВОЗ (2021) — группа 1 (n = 255) или российским референтным критериям «нормозооспермии» [11] —группа 2 (n = 337).
Статистический анализ. Статистический анализ проводили с помощью пакета Statistica v12.1 (StatSoft Inc., Tulsa, OK, USA). Нормальность распределения проверяли с помощью теста Колмогорова-Смирнова-Lilliefors. Центральные тенденции по группам представляли в виде медианы, 25% – 75% и 5% – 95% процентилей, диапазона «невыпадающих значений» («non-outlier range»). «Выпадающими» являлись значения, которые находятся далеко от центра распределения и не являются характерными для него (возможно, являются результатами ошибок наблюдения или выбросами). В нашем случае «выпадающими» являлись значения, рассчитанные в соответствии с алгоритмом, настроенном в статистическом пакете Statistica по умолчанию: «контуры» — значения больше, чем интерквартильный размах с коэффициентом × 1,5; «пределы» — с коэффициентом × 2. Использование 5% – 95% процентилей и диапазона «невыпадающих значений» обусловлено необходимостью не только охарактеризовать средние тенденции распределения значений, но и определить референтные границы для оцениваемого параметра. Значимость различий между группами проверяли с помощью Pearson’s χ-квадрат (χ). Различия считали значимыми при p < 0,05.
Результаты
В выборке фертильных мужчин (n = 358) результаты MAR-IgG-теста были в диапазоне от 0% (нет связывания латексных шариков с подвижными сперматозоидами) до 100% (все подвижные сперматозоиды покрыты латексными шариками), при этом число АСАТ-позитивных мужчин экспоненциально уменьшалось пропорционально увеличению доли сперматозоидов, покрытых АСАТ (рис. 1).
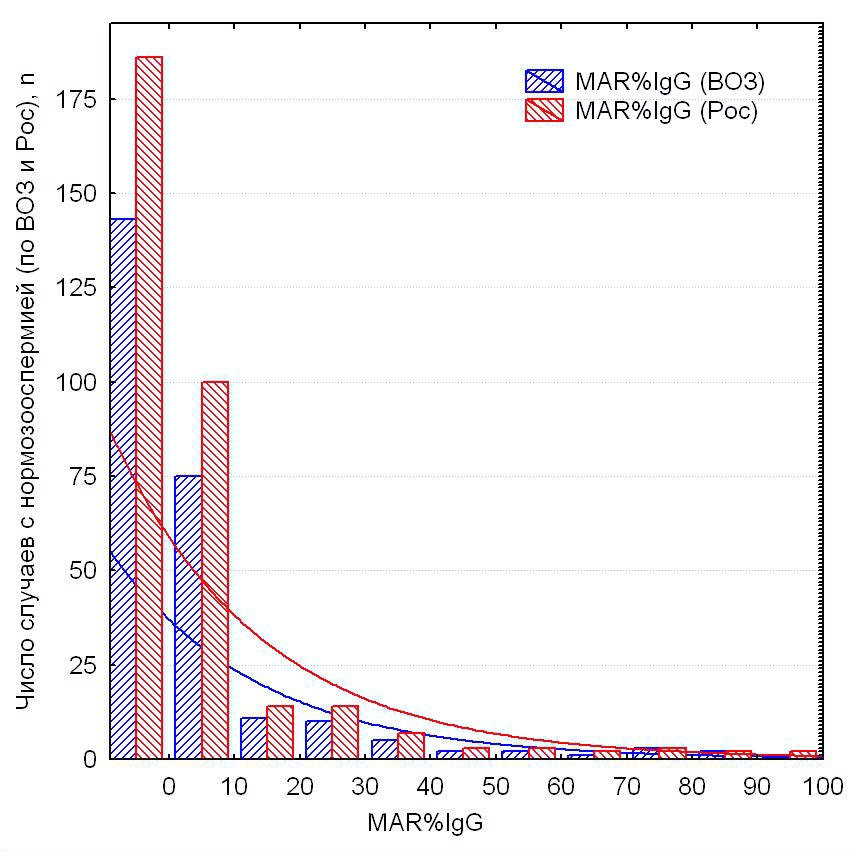
Рисунок 1. Количество фертильных мужчин с различным процентом АСАТ-позитивных сперматозоидов (MAR-IgG-тест от 0% до 100%) в группах с «нормозооспермией» по критериям ВОЗ (2021) (синие столбики) и российским референтным критериям [11] (красные столбики)
Figure 1. The distribution of fertile men across varying percentages of ASA-positive spermatozoa (MAR-IgG test range: 0% to 100%) is shown for subgroups classified as “normozoospermic” according to WHO 2021 criteria (blue bars) and Russian reference criteria [11] (red bars)
На рисунке 1 также видно, что больше фертильных мужчин соответствует критериям «нормозооспермии» по российским критериям (группа 2), чем по критериям ВОЗ (группа 1). При этом в обеих группах преобладают мужчины, у которых АСАТ на сперматозоидах не обнаружены (MAR-IgG = 0%). Почти в два раза меньше тех, у кого АСАТ покрывали 1% – 10% подвижных сперматозоидов. Медиана результатов MAR-IgG-теста в группе фертильных мужчин — 0%, 5% – 95%-ные центили — 0% – 40%. Случаи, когда в обеих группах MAR-IgG > 40%, можно назвать статистически редкими: 16 из 358 (4,5%).
В группе 1 медиана MAR-IgG — 0%, все случаи MAR-IgG > 10% — статистически выпадающие (рис. 2А), 95%-ный центиль — 36% (рис. 2В). По российским критериям выпадающими являются MAR-IgG-теста > 12% (рис. 3А), 95%-ный центиль — 40% (рис. 3В).
Различия между группами 1 и 2 по характеру распределения и характеристикам рядов данных статистически незначимы (p > 0,05).
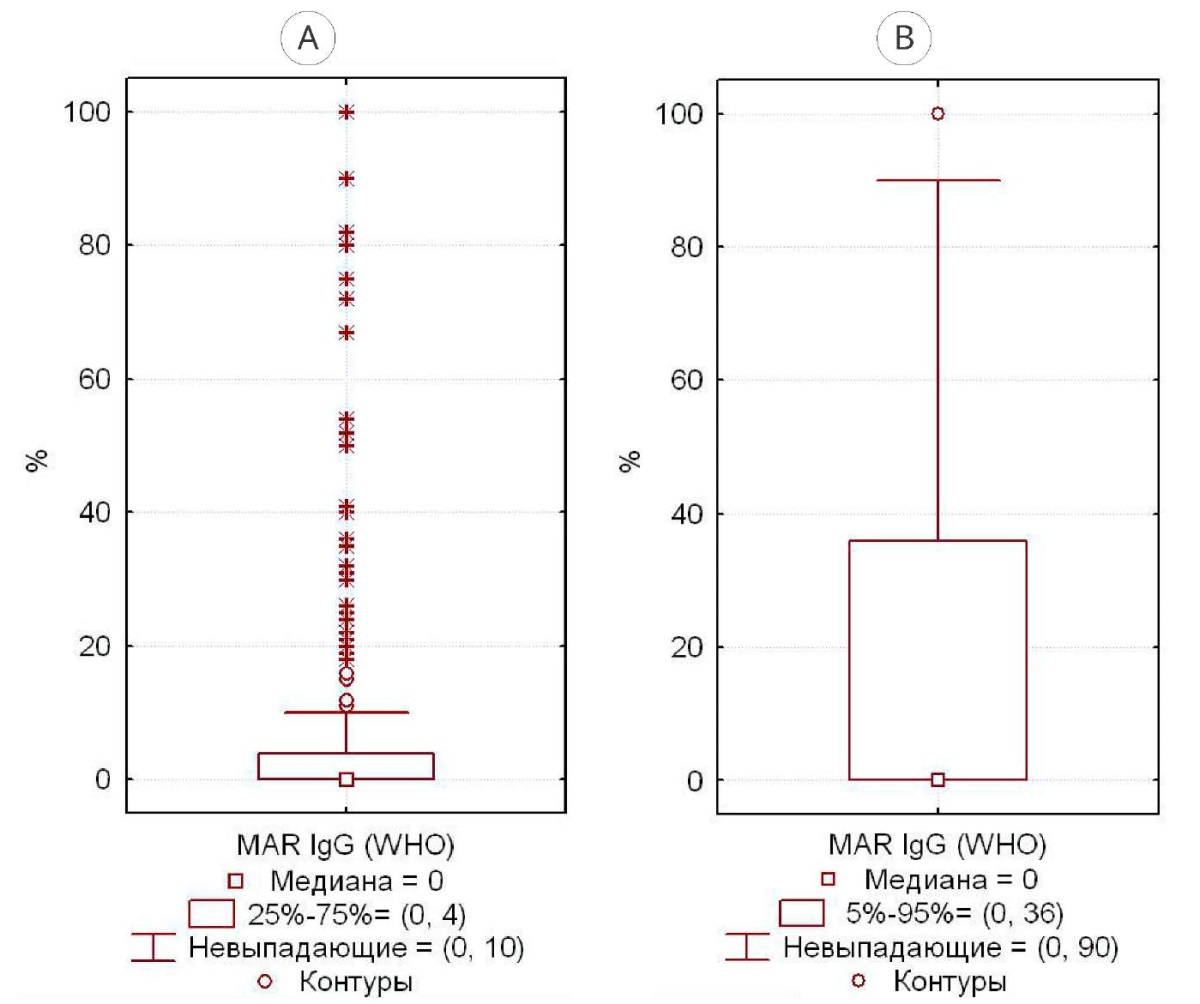
Рисунок 2. Разброс значений MAR-IgG-теста у фертильных мужчин с нормозооспермией по критериям ВОЗ (2021): А — 25% – 75%; В — 5% – 95%
Figure 2. The range of MAR-IgG test values in fertile men with normozoospermia according to WHO criteria (2021): A — 25% – 75%; B — 5% – 95%
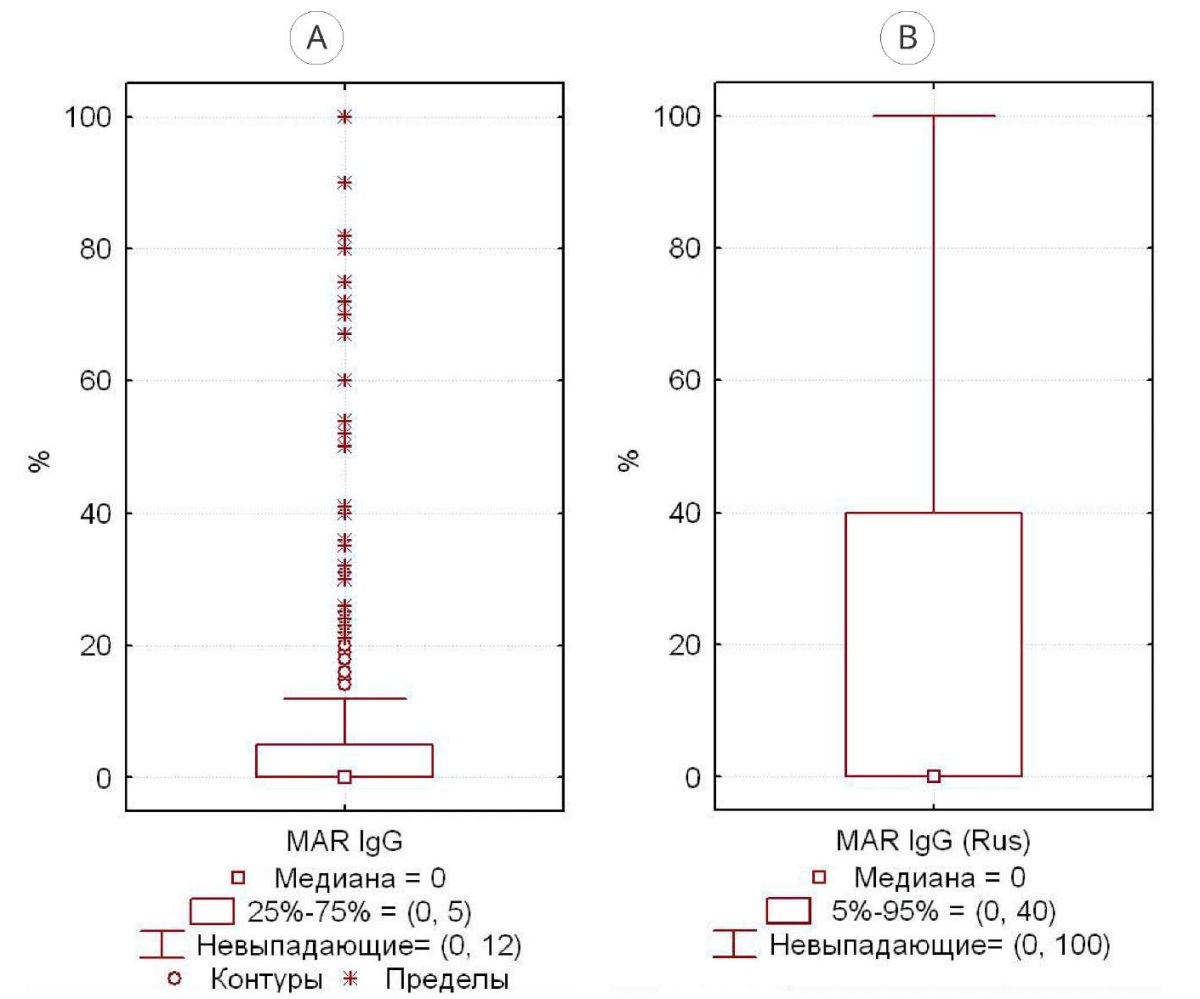
Рисунок 3. Разброс значений MAR-IgG-теста у фертильных мужчин с нормозооспермией по российским критериям [11]: А — 25% – 75%; В — 5% – 95%
Figure 3. The range of MAR-IgG test values in fertile men with normozoospermia according to Russian criteria [11]: A — 25% – 75%; B — 5% – 95%
Обсуждение
Аутоиммунные реакции против сперматозоидов, сопровождающиеся выработкой АСАТ, — давно известная причина мужского бесплодия [1]. Наличие АСАТ связано с уменьшением вероятности естественного зачатия и живорождения и влияет на успешность вспомогательных репродуктивных технологий [5 – 7][8][12]. Однако, как отмечали в своём обзоре на эту тему S. Leathersich и R.J. Hart (2022), «интерпретация данных относительно AСАТ и фертильности осложняется отсутствием стандартизации в методологии тестирования и пороговых значениях теста, а также отсутствием данных об их распространённости в здоровой фертильной популяции» [13].
Ранее сообщалось о большей распространённости AСАТ у бесплодных мужчин (3,9% – 15,6%) [6][14 – 16], чем у фертильных мужчин (0,9% – 2,5%) [6][14][17]. Однако в недавнем исследовании более 10 000 мужчин из бесплодных пар распространённость АСАТ оказалась не такой высокой, как ожидалось (2% – 4%) [18]. Вероятно, это было связано с пороговым значением, используемым для определения положительного теста AСАТ.
Эксперты ВОЗ неоднократно изменяли нормативные показатели для тестов на АСАТ: не более 40% подвижных АСАТ-позитивных в 1980 году, не более 10% — в 1986 и 1993 годах, меньше 50% — в 1999 и 2010 годах5,6. В актуальном Руководстве ВОЗ по исследованию спермы предлагается разрабатывать региональные нормативы2. Попытка этого и сделана в данной работе, выполненной на основе данных многоцентровых исследований, проведенных в специализированных андрологических лабораториях опытными и специально обученными сперматологии врачами клинической лабораторной диагностики с использованием метода смешанной реакции агглютинации2.
Чтобы минимизировать вклад других показателей эякулята (количество, подвижность и морфология сперматозоидов), в исследование включили мужчин с нормальными показателями базового исследования эякулята (диапазон 5% и 95%-ные центили). Поскольку руководство ВОЗ и в этом случае рекомендует опираться на оригинальные региональные данные, мы группу из 385 фертильных мужчин разделили на группы (частично пересекающиеся) с «нормозооспермией» по критериям ВОЗ-2021 (группа 1) и российским критериям [11] (группа 2).
Статистический анализ показал, что характерным для фертильных мужчин является отсутствие АСАТ на сперматозоидах (MAR-IgG = 0%). Почти в два раза меньше было мужчин, у которых АСАТ были связаны менее чем с 10% сперматозоидов. Остальные случаи составили менее 15% (рис. 1).
Для нормозооспермии по ВОЗ (2021) значения MAR-IgG > 10% являются статистически «выпадающими», верхний 95%-ный центиль — граница статистической «нормы», — составил 36% (рис. 2). По российским критериям [11], данные границы составили 12% и 40% соответственно. Мы считаем, что при отсутствии статистической значимости различий между группами предпочтение следует отдать российским критериям, в том числе и потому, что показатели эякулята большинства фертильных мужчин соответствуют именно российским критериям «нормозооспермии» (рис. 1), что логично, поскольку эти мужчины фертильны, то есть «нормальны» с точки зрения возможности достижения от них беременности.
Методологически и этически остаётся нерешаемым вопрос, можем ли мы быть уверенны, что все мужчины, вошедшие в изучаемую выборку, в действительности фертильны. Известно, что в 0,8% – 30,0% случаев (медиана 3,7%) мужчина не знает, что биологическим отцом его ребёнка официально в действительности является другой мужчина [19]. Поскольку данные базового анализа эякулята в наших группах 1 и 2, несмотря на некоторые различия, соответствуют референтным диапазонам для количества, подвижности и морфологии сперматозоидов, мы вправе считать, что значения больше 95%-ного центиля для процента АСАТ-позитивных сперматозоидов статистически не относятся к генеральной совокупности «фертильные мужчины» и могут рассматриваться как признак снижения репродуктивной функции, то есть риска бесплодия (с одновременной констатацией факта, что превышение референтных значений, полученных при оценке группы фертильных мужчин, по формальным признакам не могут однозначно трактоваться как признак бесплодия).
При этом следует иметь в виду, что различия в методологии проведения тестов (точность использования применяемых доз реагентов, температурный режим, время регистрации результата после добавления реагентов и другие), опыт специалиста лабораторной диагностики, особенности используемой тест-системы и применяемого оборудования могут влиять на результаты, а референтные интервалы являются лишь ориентиром при клинической интерпретации результатов, которая может быть сделана только врачом.
Также следует иметь в виду, что понятие «фертильный мужчина», то есть мужчина, от которого наступила клиническая беременность (ХГЧ > 100 мМЕ/мл и/или визуализация плодного яйца при УЗИ), не тождественно понятию «здоровый мужчина» в репродуктивном смысле, поскольку до 40% беременностей прерывается на ранних сроках из-за низкого качества сперматозоидов и связанных с этим нарушением развития зародыша7 [20]. А в анализируемой когорте значительную долю составляли мужчины из пар с замершими беременностями или выкидышами на ранних сроках.
Тем не менее представленные данные, на наш взгляд, позволяют в полной мере согласиться с мнением A.F. Silva et al. (2021) — авторов обзора на эту тему, — что «необходимо оценивать AСАТ во всех рутинных семенных анализах в соответствии с рекомендациями ВОЗ» [21].
Группами риска по развитию аутоиммунных реакций против сперматозоидов при этом будут [7][8][22]: 1) травма яичек или мошонки, 2) хирургическое вмешательство на мужских половых органах, включая вазэктомию (у 70% – 100% пациентов с АСАТ), 3) перекрут яичка, 4) рак яичек, 5) воспаление мочеполовых путей, 6) варикоцеле, 7) агглютинация сперматозоидов, 8) астенозооспермия, особенно при агглютинации. Предпочтение при этом следует отдавать прямым тестам обнаружения АСАТ (тесты MAR и IBТ)2, которые позволяют установить: 1) наличие АСАТ, 2) процент АСАТ-положительных сперматозоидов, 3) зону связывания АСАТ со сперматозоидом. При отсутствии или крайне низком количестве сперматозоидов в эякуляте и отсутствии прогрессивно подвижных сперматозоидов должны применяться непрямые методы с инкубацией отмытых от семенной плазмы донорских сперматозоидов в сперме пациента и оценке уже на них наличия и локализации АСАТ.
Заключение
Согласно полученным данным, для российских мужчин при использовании смешанной реакции агглютинации (MAR-IgG-тест) характерно не более 12% АСАТ-положительных прогрессивно-подвижных сперматозоидов. При 13% – 40% IgG-позитивных прогрессивно-подвижных сперматозоидов иммунный фактор бесплодия считать вероятным. Беременность статистически маловероятна при > 40% IgG-позитивных подвижных сперматозоидов даже при нормозооспермии, что можно считать фактором высокого риска иммунного бесплодия.
1. World Health Organization. WHO manual for the standardized investigation and diagnosis of the infertile couple. Cambridge: Cambridge University Press; 2000.
2. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 6th ed. Geneva: World Health Organization; 2021. Available from: https://iris.who.int/bitstream/handle/10665/343208/9789240030787-eng.pdf
3. Российское общество урологов. Клинические рекомендации «Мужское бесплодие». 2025. Доступно по: https://ooorou.ru/upload/iblock/aac/9huwoerxy2ign2nqd8e0cw6gulfwj2s2/KR5_3-Muzhskoe-besplodie-2025.pdf
4. European Association of Urology. EAU Guidelines on Sexual and Reproductive Health. Arnhem, The Netherlands: European Association of Urology; 2025. Available from: https://uroweb.org/guidelines/sexual-and-reproductive-health** [1] https://uroweb.org/guidelines/sexual-and-reproductive-health
5. World Health Organization. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction. 3rd ed. Cambridge: Cambridge University Press; 1993.
6. World Health Organization. WHO laboratory manual for the examination of human semen and sperm–cervical mucus interaction. 4th ed. Cambridge: Cambridge University Press; 1999.
7. Recurrent pregnancy loss. ESHRE Early Pregnancy Guideline Development Group. Guideline of the European Society of Human Reproduction and Embryology. Hum Reprod Open. 2023;2023(1):hoad002.
Список литературы
1. Wilson L. Sperm agglutinins in human semen and blood. Proc Soc Exp Biol Med. 1954;85(4):652-655. DOI: 10.3181/00379727-85-20982
2. Vazquez-Levin MH, Marín-Briggiler CI, Veaute C. Antisperm antibodies: invaluable tools toward the identification of sperm proteins involved in fertilization. Am J Reprod Immunol. 2014;72(2):206-218. DOI: 10.1111/aji.12272
3. Mazumdar S, Levine AS. Antisperm antibodies: etiology, pathogenesis, diagnosis, and treatment. Fertil Steril. 1998;70(5):799-810. DOI: 10.1016/s0015-0282(98)00302-1
4. Restrepo B, Cardona-Maya W. Antisperm antibodies and fertility association. Actas Urol Esp. 2013;37(9):571-578. DOI: 10.1016/j.acuro.2012.11.003
5. Francavilla F, Santucci R, Barbonetti A, Francavilla S. Naturally-occurring antisperm antibodies in men: interference with fertility and clinical implications. An update. Front Biosci. 2007;12:2890-2911. DOI: 10.2741/2280
6. Bozhedomov VA, Nikolaeva MA, Ushakova IV, Lipatova NA, Bozhedomova GE, Sukhikh GT. Functional deficit of sperm and fertility impairment in men with antisperm antibodies. J Reprod Immunol. 2015;112:95-101. DOI: 10.1016/j.jri.2015.08.002
7. Галимов Ш.Н., Божедомов В.А., Галимова Э.Ф., Павлов В.Н., Сухих Г.Т. Мужское бесплодие: молекулярные и иммунологические аспекты. Москва: ГЭОТАР-Медиа; 2020.
8. Gupta S, Sharma R, Agarwal A, Boitrelle F, Finelli R, Farkouh A, Saleh R, Abdel-Meguid TA, Gül M, Zilaitiene B, Ko E, Rambhatla A, Zini A, Leisegang K, Kuroda S, Henkel R, Cannarella R, Palani A, Cho CL, Ho CCK, Zylbersztejn DS, Pescatori E, Chung E, Dimitriadis F, Pinggera GM, Busetto GM, Balercia G, Salvio G, Colpi GM, Çeker G, Taniguchi H, Kandil H, Park HJ, Maldonado Rosas I, de la Rosette J, Cardoso JPG, Ramsay J, Alvarez J, Molina JMC, Khalafalla K, Bowa K, Tremellen K, Evgeni E, Rocco L, Rodriguez Peña MG, Sabbaghian M, Martinez M, Arafa M, Al-Marhoon MS, Tadros N, Garrido N, Rajmil O, Sengupta P, Vogiatzi P, Kavoussi P, Birowo P, Kosgi R, Bani-Hani S, Micic S, Parekattil S, Jindal S, Le TV, Mostafa T, Toprak T, Morimoto Y, Malhotra V, Aghamajidi A, Durairajanayagam D, Shah R. Antisperm Antibody Testing: A Comprehensive Review of Its Role in the Management of Immunological Male Infertility and Results of a Global Survey of Clinical Practices. World J Mens Health. 2022;40(3):380-398. DOI: 10.5534/wjmh.210164
9. Schlegel PN, Sigman M, Collura B, De Jonge CJ, Eisenberg ML, Lamb DJ, Mulhall JP, Niederberger C, Sandlow JI, Sokol RZ, Spandorfer SD, Tanrikut C, Treadwell JR, Oristaglio JT, Zini A. Diagnosis and Treatment of Infertility in Men: AUA/ASRM Guideline Part I. J Urol. 2021;205(1):36-43. DOI: 10.1097/JU.0000000000001521
10. Schlegel PN, Sigman M, Collura B, De Jonge CJ, Eisenberg ML, Lamb DJ, Mulhall JP, Niederberger C, Sandlow JI, Sokol RZ, Spandorfer SD, Tanrikut C, Treadwell JR, Oristaglio JT, Zini A. Diagnosis and treatment of infertility in men: AUA/ASRM guideline part II. Fertil Steril. 2021;115(1):62-69. DOI: 10.1016/j.fertnstert.2020.11.016
11. Божедомов В.А., Корнеев И.А., Липатова Н.А., Божедомова Г.Е., Камарина Р.А., Николаева М.А., Галимова Э.Ф., Галимов Ш.Н., Епанчинцева Е.А., Павлов В.Н., Камалов А.А. Референтные показатели базового анализа эякулята фертильных мужчин: российские региональные особенности (многоцентровое поперечное ретроспективное исследование). Урология. 2023;(5):48-56. DOI: 10.18565/urology.2023.5.48-56
12. Mukherjee AG, Gopalakrishnan AV. Anti-sperm Antibodies as an Increasing Threat to Male Fertility: Immunological Insights, Diagnostic and Therapeutic Strategies. Reprod Sci. 2024;31(11):3303-3322. Erratum in: Reprod Sci. 2024;31(8):2537. DOI: 10.1007/s43032-024-01610-y
13. Leathersich S, Hart RJ. Immune infertility in men. Fertil Steril. 2022;117(6):1121-1131. DOI: 10.1016/j.fertnstert.2022.02.010
14. Sinisi AA, Di Finizio B, Pasquali D, Scurini C, D’Apuzzo A, Bellastella A. Prevalence of antisperm antibodies by SpermMARtest in subjects undergoing a routine sperm analysis for infertility. Int J Androl. 1993;16(5):311-314. DOI: 10.1111/j.1365-2605.1993.tb01197.x
15. Tüttelmann F, Nieschlag E. Classification of andrological disorders. In: Nieschlag E, Behre HM, Nieschlag S, eds. Andrology: male reproductive health and dysfunction. Berlin: Springer; 2010.
16. Yasin AL, Yasin AL, Basha WS. The Epidemiology of Anti-Sperm Antibodies Among Couples with Unexplained Infertility in North West Bank, Palestine. J Clin Diagn Res. 2016;10(3):QC01-3. DOI: 10.7860/JCDR/2016/15788.7380
17. Heidenreich A, Bonfig R, Wilbert DM, Strohmaier WL, Engelmann UH. Risk factors for antisperm antibodies in infertile men. Am J Reprod Immunol. 1994;31(2-3):69-76. DOI: 10.1111/j.1600-0897.1994.tb00849.x
18. Barbonetti A, Castellini C, D’Andrea S, Cordeschi G, Santucci R, Francavilla S, Francavilla F. Prevalence of anti-sperm antibodies and relationship of degree of sperm auto-immunization to semen parameters and post-coital test outcome: a retrospective analysis of over 10 000 men. Hum Reprod. 2019;34(5):834-841. DOI: 10.1093/humrep/dez030
19. Bellis MA, Hughes K, Hughes S, Ashton JR. Measuring paternal discrepancy and its public health consequences. J Epidemiol Community Health. 2005;59(9):749-754. DOI: 10.1136/jech.2005.036517
20. Muncey W, Scott M, Lathi RB, Eisenberg ML. The paternal role in pregnancy loss. Andrology. 2025;13(1):146-150. DOI: 10.1111/andr.13603
21. Silva AF, Ramalho-Santos J, Amaral S. The impact of antisperm antibodies on human male reproductive function: an update. Reproduction. 2021;162(4):R55-R71. DOI: 10.1530/REP-21-0123
22. Божедомов В.А., Сухих Г.Т. Иммунное мужское бесплодие. Учебное пособие. М.: Е-noto, 2018.
Об авторах
В. А. БожедомовРоссия
Владимир Александрович Божедомов — д-р мед. наук, профессор.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Н. А. Липатова
Россия
Наталия Алексеевна Липатова — канд. мед. наук.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Р. А. Камарина
Россия
Римма Алексеевна Камарина
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. В. Божедомова
Россия
Анастасия Владимировна Божедомова
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. А. Корнеев
Россия
Игорь Алексеевич Корнеев — д-р мед. наук, профессор.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. А. Камалов
Россия
Армаис Альбертович Камалов — д-р мед. наук, профессор, академик РАН.
Москва
Конфликт интересов:
The authors declare no conflict of interest
Рецензия
Для цитирования:
Божедомов В.А., Липатова Н.А., Камарина Р.А., Божедомова А.В., Корнеев И.А., Камалов А.А. Критерии дифференциальной диагностики мужского иммунного бесплодия. Вестник урологии. 2025;13(3):30-38. https://doi.org/10.21886/2308-6424-2025-13-3-30-38
For citation:
Bozhedomov V.A., Lipatova N.A., Kamarina R.A., Bozhedomova A.V., Korneev I.A., Kamalov A.A. Male immune infertility: criteria for differential diagnosis. Urology Herald. 2025;13(3):30-38. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-3-30-38













































