Перейти к:
Экспрессия рецепторов ангиотензина II второго типа и синдекана-1 при раке предстательной железы
https://doi.org/10.21886/2308-6424-2024-12-5-45-54
Аннотация
Введение. Рак предстательной железы (РПЖ) остаётся актуальной проблемой современной онкоурологии в связи с высокими показателями заболеваемости и смертности.
Цель исследования. Оценить экспрессию рецепторов ангиотензина II второго типа (AT2-R) и синдекана-1 (CD138) при простатической интраэпителиальной неоплазии (ПИН) и раке предстательной железы.
Материалы и методы. Для иммуногистохимического (ИГХ) исследования использован материал полифокальных пункционных биопсий 20 мужчин: 10 мужчин — с ПИН-3, 10 мужчин — с РПЖ. Для ИГХ окрашивания использованы первичные антитела к AT2-R и антитела CD138 (клон MI 15), система визуализации EnVision FLEX. Постановка ИГХ реакций, интерпретация полученных результатов проведена по общепринятым правилам.
Результаты. Результаты исследования показали, что дефицит AT2-R увеличивается в ряду ПИН-3 — РПЖ. В опухолевых клетках при РПЖ отмечалась слабая экспрессия AT2-R либо её отсутствие, при этом локализация рецептора AT2-R — ядерная. При ПИН-3 экспрессия синдекана-1 локализовалась на мембране базальных клеток и базолатеральной стороне секреторных эпителиальных клеток, без экспрессии в прилегающей строме, при этом уровень экспрессии синдекана-1 всегда оставался высоким. При РПЖ мембранная экспрессия синдекана-1 сохранялась. При уменьшении или отсутствии ядерной экспрессии AT2-R в ткани рака простаты с повышением ISUP уровень экспрессии синдекана-1 снижался.
Заключение. Впервые показано одновременное снижение уровней экспрессии AT2-R и синдекана-1 при РПЖ. Комплексное определение уровней экспрессии рецепторов ангиотензина II второго типа и синдекана-1 является, по-видимому, перспективным для разработки диагностических и прогностических маркеров инициации и развития рака предстательной железы.
Ключевые слова
Для цитирования:
Черногубова Е.А., Аветян А.В., Чибичян М.Б., Коган М.И. Экспрессия рецепторов ангиотензина II второго типа и синдекана-1 при раке предстательной железы. Вестник урологии. 2024;12(5):45-54. https://doi.org/10.21886/2308-6424-2024-12-5-45-54
For citation:
Chernogubova E.A., Avetyan A.V., Chibichyan M.B., Kogan M.I. Expression of angiotensin II type 2 receptors and syndecan-1 in prostate cancer. Urology Herald. 2024;12(5):45-54. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-5-45-54
Введение
Рак предстательной железы (РПЖ) остается актуальной проблемой современной медицины в связи с высокими показателями заболеваемости и смертности [1][2].
Диагностика рака предстательной железы в настоящее время опирается в основном на морфологические характеристики, при этом недостаточно учитываются фундаментальные молекулярные механизмы, лежащие в основе канцерогенеза. Простатическая интраэпителиальная неоплазия — облигатный предрак предстательной железы, сопровождающийся очаговой пролиферацией эпителия протоков и ацинусов простаты с образованием клеток с признаками атипии, однако при этом сохраняется интактным базальный слой, что отличает ПИН от аденокарциномы [3]. Молекулярные механизмы онкогенной трансформации предстательной железы неясны. Сочетание воспалительных, доброкачественных и злокачественных процессов в предстательной железе снижает чувствительность, специфичность и диагностическую точность современных методов обследования.
Для рака предстательной железы параллельно исследуется несколько групп маркеров (диагностические, прогностические), позволяющие оценить степень злокачественности опухоли и риски прогрессии болезни. Для ранней диагностики РПЖ перспективным является определение, в каких случаях ПИН имеет потенциал к прогрессированию в клинически значимый РПЖ, а в каких останется индолентным гистопатологическим процессом. Анализ молекулярных механизмов канцерогенеза при раке предстательной железы может позволить идентифицировать диагностически значимые молекулярные маркеры детекции РПЖ, что повысит эффективность диагностики заболевания.
Ранее нами установлено, что активация локальной ренин-агиотензиновой системы (РАС) вовлечена в патогенез простатической пролиферации — РПЖ, гиперплазии предстательной железы и простатической интраэпителиальной неоплазии (ПИН) [4][5]. РАС представляет собой физиологический путь, способствующий пролиферации опухолевых клеток, ангиогенезу и воспалительной реакции в опухолевой ткани. В тканях простаты экспрессированы все основные компоненты РАС: ангиотензинпревращающий фермент (АПФ), рецепторы ангиотензина первого (AT1-R) и второго типов (AT2-R). ангиотензин II (Анг. II). Важное значение в реализации ответа клетки на действие ангиотензина II — основного эффекторного пептида РАС — имеет соотношение AT1-R и AT2-R, способствующее изменению баланса между проапоптотическими и пролиферативными сигнальными путями. Предполагается, что AT1-R и AT2-R играют разные роли в канцерогенезе. Действие Aнг. II через AT1-R связано с пролиферативным, антиапоптотическим, проангиогенным, провоспалительным и метастатическим действием, а также с блокировкой клеточного цикла в фазе G1, тогда как AT2-R — с замедлением роста опухоли, индукцией апоптоза и дифференциации, что определяет общее защитное и регенерирующее действие [6 – 8].
Синдекан-1 (syndecan 1; CD138) — трансмембранный протеогликан, который связывается со многими медиаторами патогенеза ряда заболеваний, регулирует широкий спектр физиологических и патологических процессов, таких как пролиферация клеток, миграция, воспаление, ремоделирование матрикса, заживление ран и онкогенез [9]. Синдекан-1 участвует в прогрессировании опухоли, контролируя пролиферацию, дифференцировку, адгезию и миграцию клеток [10].
Рецепторы ангиотензина II первого и второго типов принадлежат к классу рецепторов, сопряженных с G-белком. Синдекан-1 принадлежит к семейству трансмембранных белков, выступающих корецепторами рецепторов, сопряжённых с G-белком [11][12]. В связи с этим перспективным представляется анализ роли коэкспрессии и взаимосвязи рецепторов ангиотензина II второго типа и синдекана-1 в механизмах онкогенной трансформации простаты.
Цель исследования: оценить экспрессию рецепторов ангиотензина II второго типа и синдекана-1 при предраковых и злокачественных новообразованиях в предстательной железе.
Материалы и методы
Для иммуногистохимического (ИГХ) исследования использован материал полифокальных пункционных биопсий 20 мужчин. Группу 1 составили 10 мужчин с простатической интраэпителиальной неоплазией III степени (High-PIN), группу 2 – 10 мужчин с РПЖ (ISUP 1 – 2 — 8 пациентов, ISUP 3 – 4 — 2 пациента). Клиническая стадия РПЖ: сT1b — 1 больной, cT2a — 2 пациента, cT2c — 6 пациентов, cT3b — 1 больной.
Клиническая характеристика групп представлена в таблице.
Таблица. Клиническая характеристика групп, Me [LQ; UQ]
Table. Clinical characteristics of the groups, Me [LQ; UQ]
|
Показатели | Indicators |
Группа 1 | Group 1 (n = 10) |
Группа 2 | Group 2 (n = 10) |
P |
|
Возраст, лет | Age, years |
64,0 [ 63,0; 69,0] |
63,0 [ 59,0; 66,0] |
> 0,05 |
|
Объём простаты, см³ | Prostate volume, cm³ |
56,0 [ 33,0; 63,0] |
47,0 [ 21,5; 71,0] |
> 0,05 |
|
ПСА, нг/мл | PSA, ng/ml |
6,2 [ 4,8; 9,2] |
7,6 [ 6,2; 8,9] |
> 0,05 |
|
Индекс Глисона | Gleason index |
6,0 [ 6,0; 7,0] |
Примечание. n — количество случаев
Note. n — number of cases
По уровню воспаления в биоптатах и пальпируемому очагу в предстательной железе пациенты были однородны. Так, пальпируемый очаг при ПИН-3 не отмечался, а при РПЖ определялся у 1 пациента. Воспаление в предстательной железе при ПИН-3 и РПЖ отмечено у 7 и 4 пациентов соответственно.
Для ИГХ окрашивания использовали набор первичных антител Angiotensin II Type 2 Receptor (AT2-R), rabbit polyclonal, 1:100 (‘Abcam Ltd., Cambridge, UK) готовые к применению антитела CD138 (клон MI 15) и систему визуализации EnVision FLEX (‘Dako A/S’, Glostrup, Denmark). Постановка ИГХ реакций, интерпретация полученных результатов проведены по общепринятым правилам. Экспрессию АТ2-R оценивали полуколичественным методом по Allred [13]. При оценке ИГХ реакции определяли долю клеток с окрашенными ядрами по формуле TS = PS + IS, где TS (Total Score) — общий балл; PS (Proportion Score) — по шкале от 1 до 3 (3 — максимальный балл); IS (Intensity Score) — по шкале от 1 до 5 (5 — максимальный балл). Уровень экспрессии синдекана-1 определяли по интенсивности ИГХ окрашивания: слабое (1% или менее окрашенных клеток) — 1+; умеренное (1–10% окрашенных клеток) — 2+ и интенсивное (10% или более окрашенных клеток) — 3+ [13].
Работы с биологическими материалами, полученными у пациентов, проведены в соответствии с Национальным стандартом РФ «Надлежащая клиническая практика» (Good Clinical Practice; GCP)1. Исследование одобрено Комиссией по биоэтике Федерального государственного бюджетного учреждения науки «Федеральный исследовательский центр Южный научный центр Российской академии наук» (ЮНЦ РАН) (Протокол № 3 от 07 июля 2023 года).
Для поиска информации об известных и предсказанных белок-белковых взаимодействиях использовали базу данных STRING (Search Tool for the Retrieval of Interacting Genes / Proteins).
Статистический анализ. Обработку полученных данных проводили с применением программного обеспечения Statistica 25 (“StatSoft Inc.”, Tulsa, OK, USA). Данные представлены в виде медианы и интерквартильного размаха Me [LQ; UQ] (LQ — нижний квартиль, UQ — верхний квартиль). Сравнительный анализ проводили с использованием U-критерия Mann-Whitney. Статистически достоверными считали различия на уровне p < 0,05 [14].
Результаты
Экспрессия рецепторов ангиотензина II второго типа в группе 1 (TS — 7,23 ± 0,18 [ 6,0; 8,0]) значительно превышает таковую в группе 2 (TS — 2,52 ± 0,16 [ 2,0; 3,0]), (p < 0,05). Таким образом установлено, что экспрессия AT2-R в ткани предстательной железы снижалась в ряду ПИН — РПЖ. Максимальная экспрессия AT2-R в ткань предстательной железы отмечена при ПИН-3 (рис. 1А), минимальная — при РПЖ (рис. 1В). В опухолевых клетках при РПЖ отмечалась слабая экспрессия AT2-R либо его отсутствие, при этом локализация рецептора AT2-R — ядерная.
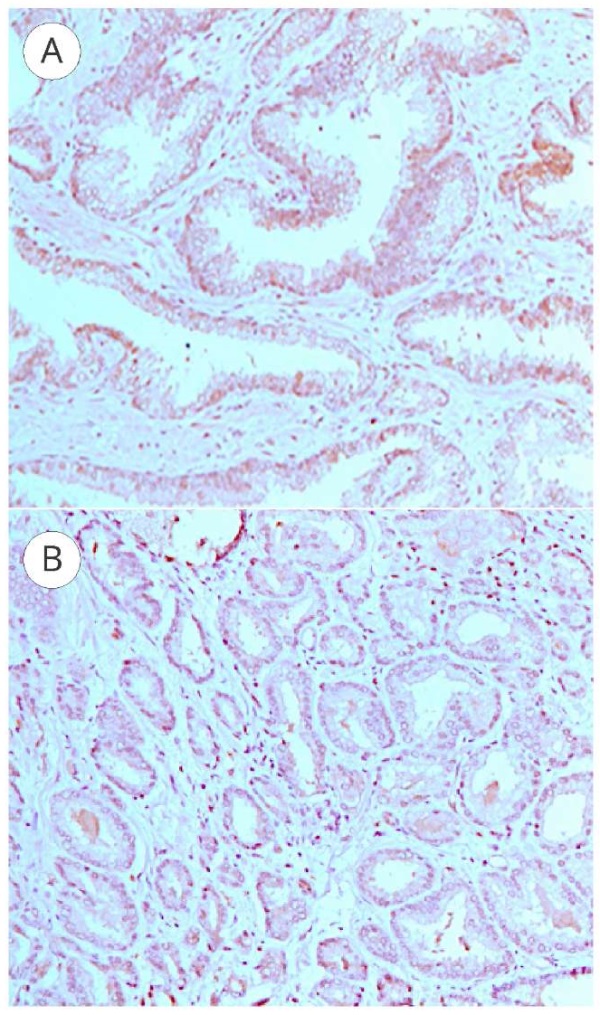
Рисунок 1. Экспрессия рецепторов ангиотензина II второго типа при ПИН-3 и РПЖ: А — ПИН-3 (x 200); В — РПЖ (x 200)
Figure 1. Expression of angiotensin II type 2 receptors in PIN-3 and prostate cancer: А — PIN-3 (x 200); B — prostate cancer (x 200)
В норме окрашивание CD138 предстательной железы ограничено базальными клетками. При ПИН-3 экспрессия синдекана-1 локализована на мембране базальных клеток и базолатеральной стороне секреторных эпителиальных клеток, без экспрессии в прилегающей строме, а уровень экспрессии синдекана-1 при ПИН-3 всегда является высоким (рис. 2A).
Так, при ПИН-3 высокая экспрессия синдекана-1 (3+) отмечена у 9 пациентов, у 1 — умеренная (2+). При РПЖ отмечено резкое снижение экспрессии синдекана-1, слабое (1+) ИГХ окрашивание отмечено у 6 пациентов, умеренное (2+) — у 4 (рис.2Б).
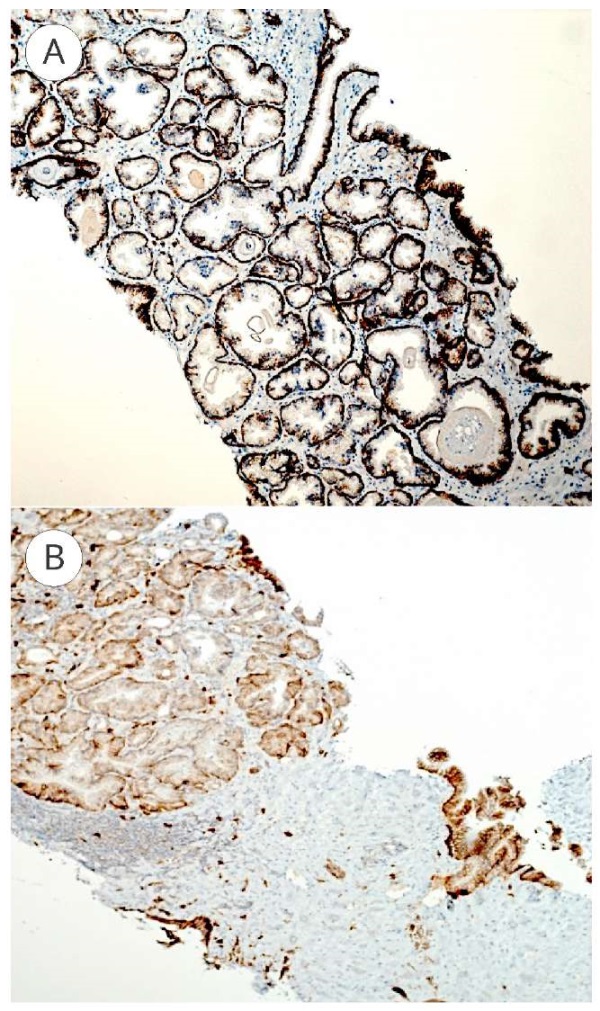
Рисунок 2. Экспрессия синдекана-1 при ПИН-3 и РПЖ: А — ПИН-3 (x 100); В — РПЖ (x 100)
Figure 2. Expression of syndecan-1 in PIN-3 and prostate cancer: A — PIN-3(x 100); В — prostate cancer (x 100)
При РПЖ имеет место мембранная экспрессия синдекана-1, но при уменьшении или отсутствии ядерной экспрессии AT2-R в ткани рака простаты, а также в связи с повышением ISUP, уровень экспрессии синдекана-1 снижен.
Обсуждение
Результаты исследования показали, что экспрессия рецепторов ангиотензина II второго типа снижается в ряду ПИН-3 – РПЖ. Необходимо отметить, что большинство эффектов ангиотензина II реализуется через активацию рецепторов ангиотензина II первого типа, тогда как рецепторы АТ2-R являются негативными регуляторами сигнальных путей, зависимых от АТ1-R. Проонкогенное влияние РАС опосредуется преимущественно через ангиотензин II-АТ1-R-зависимый сигналинг, который в опухолевых и окружающих опухоль клетках направлен на ускорение процесса пролиферации и переходу к злокачественности, а также вовлечён в модулирование ангиогенеза [15][16]. Существенных различий в количестве и распределении рецептора ангиотензина II первого типа при доброкачественной гиперплазии, высокодифференцированной простатической интраэпителиальной неоплазии и аденокарциноме предстательной железы, по данным других исследователей, не обнаружено [17]. Следовательно, более высокий уровень экспрессии AT2-R при ПИН-3 препятствует онкогенной трансформации простаты, а нарастающий дефицит AT2-R в ткани предстательной железы при РПЖ является одной из причин преобладания процессов, стимулирующих канцерогенез.
Синдеканы — небольшое семейство из четырёх трансмембранных протеогликанов млекопитающих. Синдеканы имеют сходную структурную организацию, состоят из N-концевого эктодомена, одного трансмембранного домена и С-концевого цитоплазматического домена. Синдекан-1 связывает многие медиаторы, играющие важную роль в патогенезе ряда заболеваний, в том числе и онкологических. Синдекан-1 модулирует рекрутирование лейкоцитов, пролиферацию и инвазию раковых клеток, ангиогенез, ремоделирование матрикса [9]. Синдекан-1 — неотъемлемый компонент внеклеточного матрикса — связывает цитокины и факторы роста, участвующие в модуляции микроокружения опухоли [9].
В норме экспрессия синдекана-1 в предстательной железе ограничена базальными клетками. В нормальных, неизменённых клетках синдекан-1 иммуногистохимическим методом выявляется на мембранах эпителиальных клеток с преимущественной базолатеральной локализацией. При РПЖ с ядерной экспрессией AT2-R выраженная мембранная экспрессия синдекана-1 сохраняется. Необходимо отметить, что рецепторы, сопряжённые с G-белками, в норме локализуются на мембране клеток. Нами же описан необычный — ядерный — характер экспрессии AT2-R. Наличие рецепторов ангиотензина II второго типа в ядрах опухолевых клеток, по-видимому, свидетельствует о переходе на другой путь регуляции при раке простаты. Активация G-белков при связывании рецепторов с лигандом (в нашем случае — с ангиотензином II) приводит к формированию клеточного ответа, причём его регуляция осуществляется аутокринным и паракринным путём. До последнего времени считалось, что этот способ межклеточной сигнализации характерен для тирозинкиназных рецепторов, Синдекан-1 служит важным корецептором для тирозинкиназных рецепторов и некоторых рецепторов, сопряжённых с G-белком. Связывая внеклеточные молекулы, он служит рецептором, который может приводить к передаче сигнала [11][12].
При РПЖ снижение ядерной экспрессии AT2-R или её отсутствие ассоциировано с низким уровнем экспрессии синдекана-1. Это свидетельствует также об уменьшении связи опухолевых клеток с компонентами межклеточного матрикса, что потенциально может приводить к более быстрому метастазированию и, как следствие, к неблагоприятному прогнозу при РПЖ. Необходимо отметить, что установлена связь между синдеканами и актиновым цитоскелетом. Так, экто- и цитоплазматические домены отвечают за взаимодействие с молекулами внеклеточного матрикса и внутриклеточными киназами соответственно. Эти взаимодействия указывают на то, что синдеканы являются ключевыми молекулами, участвующими в инициации и прогрессировании рака [18][19].
С учётом одновременного уменьшения экспрессии AT2-R в ядрах и синдекана-1 на мембранах опухолевых клеток можно сделать предположение о том, что синдекан-1, вероятно, выступает в качестве гена-супрессора опухолевого роста при РПЖ, а уровни экспрессии рецепторов ангиотензина II второго типа и синдекана-1 являются лимитирующими факторами онкогенной трансформации предстательной железы.
Одной из причин снижения мембранной экспрессии синдекана-1 является, по-видимому, удаление его эктодомена с поверхности мембраны, в результате чего образуется так называемый «растворимый» синдекан. Подобное удаление, или шеддинг, с последующим восстановлением — важная характеристика синдеканов [20]. Механизм шеддинга в настоящее время не полностью изучен, но недавно был описан новый механизм, в котором матриксная металлопротеиназа 9 (MMP-9) усиливает шеддинг синдекана-1 [20]. Концентрация «растворимого» синдекана-1 в норме низкая. Повышенная цитоплазматическая экспрессия синдекана-1 ассоциирована с агрессивными формами рака предстательной железы и является независимым предиктором биохимического рецидива [21]. Оценка уровня растворимого синдекана-1 может быть многообещающим инструментом для стратификации риска и мониторинга терапии [22]. Таким образом, цитоплазматическая экспрессия синдекана-1 является сильным и независимым предиктором неблагоприятного прогноза при раке предстательной железы.
Показано также, что синдекан-1 способствует канцерогенезу предстательной железы, поддерживая стабильность клеток, инициирующих образование опухоли при раке предстательной железы [10][23]. Синдекан-1 играет непосредственную роль в связывании факторов роста и стимулировании миграции клеток, а его экспрессия связана с развитием биохимического рецидива РПЖ после радикальной простатэктомии [23]. Необходимо отметить, что синдекан-1 — многообещающий предиктивный и прогностический маркер рака предстательной железы, однако на сегодняшний день проведено слишком мало исследований, позволяющих определить его клиническое применение.
Ранее нами было установлено, что активность АПФ в секрете предстательной железы и уровень экспрессии AT2-R также являются перспективными прогностическими маркерами клинически агрессивных форм РПЖ. Увеличение активности АПФ на ранних этапах развития рецидива РПЖ приводит к накоплению Анг. II, при этом наличие AT2-R, по-видимому, является лимитирующим фактором развития агрессивных форм РПЖ [24][25]. Это позволяет предполагать, что AT2-R обладают протективными свойствами при рецидиве РПЖ.
Дифференциальная экспрессия AT2-R и синдекана-1 в предраковых и злокачественных новообразованиях предстательной железы позволяет предположить, что эти белки играют важную роль в патогенезе РПЖ и прогрессировании заболевания. Дефицит рецепторов ангиотензина II второго типа и синдекана-1, по-видимому, является одной из метаболических основ онкогенной трансформации простаты. Синхронность изменения уровней экспрессии AT2-R и синдекана-1 свидетельствует о существовании общего механизма регуляции разных сигнальных путей в патогенезе прогрессии РПЖ.
Используя базу данных STRING, мы идентифицировали сеть потенциальных взаимодействий для AT2-R и синдекана-1, которые могут быть вовлечены в патогенез РПЖ (рис. 3). Программа STRING использует коммерческие и общедоступные базы данных по сигнальным, регуляторным и метаболическим путям. Построена сеть белок-белковых взаимодействий на основе данных о прямых физических взаимодействиях между белками, которые могут быть получены в экспериментах in vitro или in vivo либо могут быть предсказаны с помощью компьютерных методов [26]. Сеть представлена в виде ненаправленного графа, где белки представляют собой вершины, а взаимодействия между ними являются рёбрами, цвет линий между белками обозначает различные типы доказательств взаимодействия.
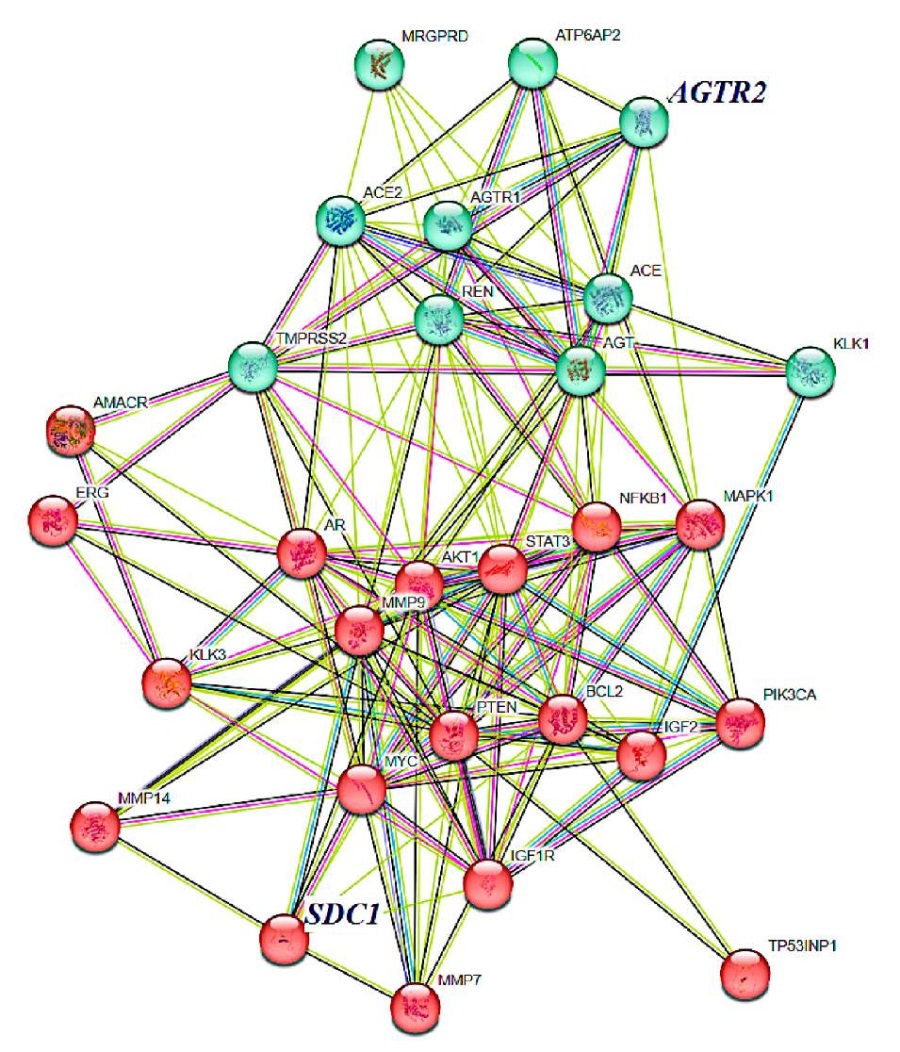
Рисунок 3. Рецептор ангиотензина II второго типа (AGTR2) и синдекан-1 (SDC1) — взаимодействующие белки, которые участвуют в развитии и прогрессировании РПЖ. 1. Зеленые узлы — белки РАС: ACE — ангиотензинпревращающий фермент; ACE2 —ангиотензинпревращающий фермент второго типа; AGT — ангиотензин 1 – 4; REN — ренин; AGTR1 — рецептор ангиотензина II первого типа; AGTR2 — рецептор ангиотензина II второго типа; ATP6AP2 — проренин / (про)рецептор ренина; KLK1 — калликреин; TMPRSS2 — трансмембранная сериновая протеаза 2. Красные узлы — белки, важные для метаболизма РПЖ, где: ICAM3 — молекула клеточной адгезии 3; MAPK1 — митоген-активируемая протеинкиназа 1; NFKB1 — ядерный фактор NF-каппа-B 1; PIK3CA — альфа-изоформа каталитической субъединицы фосфатидилинозитол-4,5-бисфосфат-3-киназы; STAT3 — сигнальный белок и активатор транскрипции из семейства белков STAT; MMP9 — матриксная металлопротеиназа 9; MRGPRD — Mas-рецептор, сопряженный с G-белком; KLK3 — простатоспецифический антиген; PTEN — гомолог фосфатазы и тензина, располагается в 10-й хромосоме; AR — андрогеновый рецептор; SDC1 — синдекан-1; AMACR — альфа-метилацил-коэнзим А рацемаза; BCL2 —регулятор апоптоза
Figure 3. Angiotensin II type 2 receptor (AGTR2) and syndecan-1 (SDC1) are interacting proteins that are involved in the development and progression of PCa. 1. Green clusters are proteins of RAS: ACE — Angiotensin-converting enzyme; ACE2 — Angiotensin-converting enzyme 2; AGT — Angiotensin 1 – 4; REN — Renin; AGTR2 — Type-2 angiotensin II receptor; ATP6AP2 — (Pro)renin Receptor; KLK1 — Kallikrein-1; TMPRSS2 — Transmembrane serine protease 2. Red clusters are proteins important for the metabolism of prostate cancer: ICAM3 — Intercellular adhesion molecule 3; MAPK1— Mitogen-activated protein kinase 1; NFKB1 — Nuclear factor NF-kappa-B; PIK3CA — Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform; STAT3 — Signal transducer and activator of transcription 3; MMP9 — matrix metalloproteinase-9; MRGPRD — Mas-related G-protein coupled receptor member D; KLK3 — Prostate-specific antigen; PTEN — phosphatase and tensin homolog deleted on chromosome 10; AR — Androgen receptor; SDC1 — Syndecan-1; AMACR — Alpha-methylacyl-CoA racemase; BCL2 — Apoptosis regulator Bcl-2
В результате поиска естественных кластеров на основе стохастического потока было выделено два кластера: белки ренин-ангиотензиновой системы и белки, важные для метаболизма РПЖ.
РАС включает протеолитические ферменты, вовлечённые во взаимопревращения пептидов ангиотензинового семейства, ангиотензиновые пептиды, их рецепторы и сопряжённые с ними внутриклеточные сигнальные каскады и эффекторы [27]. «Классическая» ось регуляции РАС — ангиотензинпревращающий фермент (АПФ) / ангиотензин II / рецепторы ангиотензина II (AT1-R и AT2-R). Новые «альтернативные» оси регуляции РАС — АПФ2 / ангиотензин 1–7 / MAS-рецептор, проренин / (про)рецептор ренина / MAP-киназа, ангиотензин A / аламандин / рецептор D (MrgD) сопряжённый с G-белком). В ткани предстательной железы экспрессированы все основные компоненты РАС. Ренин-ангиотензиновый каскад участвует в пролиферации опухолевых клеток, ангиогенезе и воспалительной реакции в опухолевой ткани [4][28].
Роль рецептора андрогенов (AR) в пролиферации опухолей простаты хорошо изучена. Нарушение регуляции AR является распространённой причиной возникновения рака предстательной железы [29]. Следует отметить, что зависимость пролиферации клеток РПЖ от андрогенов не является молекулярной патологией, а, напротив, отражает нормальные особенности функционирования предстательной железы
Значительную роль в молекулярных механизмах канцерогенеза простаты играет онкосупрессор PTEN, который кодирует фосфатазу, субстратом которой является важнейший вторичный переносчик клеточных сигналов PI3K, участвующий в активации целого ряда молекулярных каскадов, вовлечённых в процессы пролиферации, апоптоза, ангиогенеза [30]. PTEN выступает в качестве переключателя между протеинкиназными сигнальными каскадами PI3K / AKT и MAPK / ERK [31]. Транскрипционный регулятор Myc также участвует в регуляции активности сигнальных каскадов PI3K / AKT и MAPK / ERK, обеспечивающих выживание и рост при раке предстательной железы [32][33]. Прогрессирование рака предстательной железы регулируется различными факторами, одним из которых является передача сигналов STAT3 [34].
Необходимо отметить, что в кластер, связанный с метаболизмом РПЖ, включены KLK3: простатоспецифический антиген (ПСА), который остаётся «золотым стандартом» диагностики РПЖ, и AMACR (альфа-метилацил-коэнзим А рацемаза — хорошо изученный маркер, широко используемый в диагностике рака предстательной железы) [35].
Всё это демонстрирует тесную взаимосвязь AT2-R и синдекана-1 в сигнальных и метаболических путях, а снижение их экспрессии играет важную роль в канцерогенезе в предстательной железе.
Таким образом, синдекан-1 и рецептор ангиотензина II второго типа участвуют в фундаментальных механизмах канцерогенеза при раке предстательной железы.
Возможно, синдекан-1 выступает в качестве гена-супрессора опухолевого роста. Снижение экспрессии синдекана-1 и AT2-R в ткани простаты является, по-видимому, предиктором развития РПЖ и его агрессивных форм.
Одновременное определение данных маркеров может представлять интерес в качестве индикатора прогрессии РПЖ, однако полученные данные нуждаются в дальнейшем изучении.
Заключение
Впервые показано одновременное снижение уровней экспрессии рецепторов ангиотензина II второго типа в ядрах и синдекана-1 на мембранах клеток при раке предстательной железы. Определение уровней экспрессии рецепторов ангиотензина II второго типа и синдекана-1 является, по-видимому, перспективным для разработки диагностических и прогностических маркеров инициации и развития рака предстательной железы. Снижение экспрессии синдекана-1 и AT2-R в ткани простаты может явиться показанием для повторной биопсии простаты и предиктором развития РПЖ и его агрессивных форм. Дальнейшее изучение связи простатической интраэпителиальной неоплазии и рака предстательной железы открывает новые перспективы для хемопревенции и лечения.
1. ГОСТ Р 52379-2005. Национальный стандарт Российской Федерации «Надлежащая клиническая практика» (Good Clinical Practice, GCP) (утверждён приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 г. № 232-ст).
GOST R 52379-2005. Russian National Standard Good Clinical Practice (GCP) (approved by Order No 232-st of the Federal Agency on Technical Regulation and Metrology from September 27th, 2005). (In Russian).
Список литературы
1. Злокачественные новообразования в России в 2023 году (заболеваемость и смертность). Под ред. Каприна А.Д., Старинского В.В., Шахзадовой А.О. М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2024.
2. Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA Cancer J Clin. 2024;74(1):12-49. Erratum in: CA Cancer J Clin. 2024;74(2):203. DOI: 10.3322/caac.21820
3. Красняк С.С. Патогенетическая терапия доброкачественной гиперплазии предстательной железы и простатической интраэпителиальной неоплазии. Экспериментальная и клиническая урология. 2020(4):66-74. DOI: 10.29188/2222-8543-2020-13-4-66-74
4. Коган М.И., Ахохов З.М., Черногубова Е.А., Гусев А.А., Ойтова З.Х. Ренин-ангиотензиновая система: роль в развитии и прогрессии почечно-клеточного рака (обзор литературы). Онкоурология. 2019;15(3):143-149. DOI: 10.17650/1726-9776-2019-15-3-143-149
5. Чибичян М.Б., Черногубова Е.А., Аветян А.В., Лаптева Т.О., Павленко И.А., Коган М.И. Роль ангиотензинпревращающего фермента и рецепторов ангиотензина II второго типа в патогенезе пролиферативных заболеваний предстательной железы. Урология. 2022;(1): 5-10. DOI: 10.18565/urology.2022.1.5-10
6. Domińska K, Lachowicz-Ochedalska A. Zaangazowanie układu renina-angiotensyna (RAS) w proces kancerogenezy [The involvement of the renin-angiotensin system (RAS) in cancerogenesis]. Postepy Biochem. 2008;54(3):294-300. (In Polish). PMID: 19112828
7. Wolgien MCGM, Correa SAA, Breuel PAF, Nazário ACP, Facina G. Renin Angiotensin System Components and Cancer:Reports of Association. J. Biosci. Med. 2016;(4):65–75. DOI: 10.4236/jbm.2016.45007
8. D’Ardes D, Boccatonda A, Rossi I, Guagnano MT, Santilli F, Cipollone F, Bucci M. COVID-19 and RAS: Unravelling an Unclear Relationship. Int J Mol Sci. 2020;21(8):3003. DOI: 10.3390/ijms21083003
9. Teng YH, Aquino RS, Park PW. Molecular functions of syndecan-1 in disease. Matrix Biol. 2012;31(1):3-16. DOI: 10.1016/j.matbio.2011.10.001
10. Lazniewska J, Li KL, Johnson IRD, Sorvina A, Logan JM, Martini C, Moore C, Ung BS, Karageorgos L, Hickey SM, Prabhakaran S, Heatlie JK, Brooks RD, Huzzell C, Warnock NI, Ward MP, Mohammed B, Tewari P, Martin C, O’Toole S, Edgerton LB, Bates M, Moretti P, Pitson SM, Selemidis S, Butler LM, O’Leary JJ, Brooks DA. Dynamic interplay between sortilin and syndecan-1 contributes to prostate cancer progression. Sci Rep. 2023;13(1):13489. DOI: 10.1038/s41598-023-40347-7
11. Zhang Y, McKown RL, Raab RW, Rapraeger AC, Laurie GW. Focus on molecules: syndecan-1. Exp Eye Res. 2011;93(4):329-330. DOI: 10.1016/j.exer.2010.06.008
12. Chaudhary PK, Kim S. An Insight into GPCR and G-Proteins as Cancer Drivers. Cells. 2021;10(12):3288. DOI: 10.3390/cells10123288
13. Ahmad Fauzi MF, Wan Ahmad WSHM, Jamaluddin MF, Lee JTH, Khor SY, Looi LM, Abas FS, Aldahoul N. Allred Scoring of ER-IHC Stained Whole-Slide Images for Hormone Receptor Status in Breast Carcinoma. Diagnostics (Basel). 2022;12(12):3093. DOI: 10.3390/diagnostics12123093
14. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: МедиаСфера; 2002.
15. Kaschina E, Unger T. Angiotensin AT1/AT2 receptors: regulation, signalling and function. Blood Press. 2003;12(2):70-88. DOI: 10.1080/08037050310001057
16. Singh KD, Karnik SS. Angiotensin Receptors: Structure, Function, Signaling and Clinical Applications. J Cell Signal. 2016;1(2):111. DOI: 10.4172/jcs.1000111
17. Septiadi SS, Noegroho BS, Tjahjodjati T, Safriadiet F., Siregar S, Adriansjahal R, Adi K, Si-hombing AT, Pramod SV, Nasution R, Hernowo BS. Angiotensin II type-1 receptor (AT1R) distribution in BPH, high grade PIN and adenocarcinoma of the prostate. Indonesian Journal of Urology. 2010;17(2):55-57. DOI: 10.32421/juri.v17i2.348
18. Santos NJ, Barquilha CN, Barbosa IC, Macedo RT, Lima FO, Justulin LA, Barbosa GO, Carvalho HF, Felisbino SL. Syndecan Family Gene and Protein Expression and Their Prognostic Values for Prostate Cancer. Int J Mol Sci. 2021;22(16):8669. DOI: 10.3390/ijms22168669
19. Logan JM, Martini C, Sorvina A, Johnson IRD, Brooks RD, Caruso MC, Huzzell C, Moore CR, Karageorgos L, Butler LM, Tewari P, Prabhakaran S, Hickey SM, Klebe S, Samaratunga H, Delahunt B, Moretti K, O’Leary JJ, Brooks DA, Ung BS. Reinterpretation of prostate cancer pathology by Appl1, Sortilin and Syndecan-1 biomarkers. Sci Data. 2024;11(1):852. DOI: 10.1038/s41597-024-03696-0
20. Леонова Е.И. Галзитская О.В. Сравнительная характеристика структуры и функции синдекана-1 позвоночных животных. Молекулярная биология. 2013;47(3):505-512. DOI: 10.7868/S0026898413030075
21. Kind S, Kluth M, Hube-Magg C, Möller K, Makrypidi-Fraune G, Lutz F, Lennartz M, Rico SD, Schlomm T, Heinzer H, Höflmayer D, Weidemann S, Uhlig R, Huland H, Graefen M, Bernreuther C, Tsourlakis MC, Minner S, Dum D, Hinsch A, Lübke AM, Simon R, Sauter G, Marx A, Polonski A. Increased Cytoplasmic CD138 Expression Is Associated with Aggressive Characteristics in Prostate Cancer and Is an Independent Predictor for Biochemical Recurrence. Biomed Res Int. 2020;2020:5845374. DOI: 10.1155/2020/5845374
22. Szarvas T, Sevcenco S, Módos O, Keresztes D, Nyirády P, Kubik A, Romics M, Kovalszky I, Reis H, Hadaschik B, Shariat SF, Kramer G. Circulating syndecan-1 is associated with chemotherapy-resistance in castration-resistant prostate cancer. Urol Oncol. 2018;36(6):312.e9-312.e15. DOI: 10.1016/j.urolonc.2018.03.010
23. Shimada K, Anai S, Fujii T, Tanaka N, Fujimoto K, Konishi N. Syndecan-1 (CD138) contributes to prostate cancer progression by stabilizing tumour-initiating cells. J Pathol. 2013;231(4):495-504. DOI: 10.1002/path.4271
24. Коган М.И., Черногубова Е.А., Чибичян М.Б., Матишов Д.Г. Ангиотензинпревращающий фермент — новый прогностический маркер рецидива при терапии рака предстательной железы. Онкоурология. 2016;12(4):87-93. DOI: 10.17650/1726-9776-2016-12-4-87-93
25. Чибичян М.Б., Коган М.И., Черногубова Е.А., Павленко И.А. Матишов Д.Г. Роль рецепторов ангиотензина II второго типа в прогнозировании биохимического рецидива при терапии рака предстательной железы. Урология. 2016;(6):89-94.
26. Csermely P, Korcsmáros T, Kiss HJ, London G, Nussinov R. Structure and dynamics of molecular networks: a novel paradigm of drug discovery: a comprehensive review. Pharmacol Ther. 2013;138(3):333-408. DOI: 10.1016/j.pharmthera.2013.01.016
27. Шпаков А.О. Ангиотензинпревращающий фермент 2-го типа, как молекулярный посредник для инфицирования клетки вирусами SARS-Cov и SARS-Cov-2. Российский физиологический журнал им. И.М. Сеченова. 2020;106(6):795-810. DOI: 10.31857/S086981392006013
28. Sehn F, Büttner H, Godau B, Müller M, Sarcan S, Offermann A, Perner S, Kramer MW, Merseburger AS, Roesch MC. The alternative renin-angiotensin-system (RAS) signalling pathway in prostate cancer and its link to the current COVID-19 pandemic. Mol Biol Rep. 2023;50(2):1809-1816. DOI: 10.1007/s11033-022-08087-5
29. Gujrati H, Ha S, Wang BD. Deregulated microRNAs Involved in Prostate Cancer Aggressiveness and Treatment Resistance Mechanisms. Cancers (Basel). 2023;15(12):3140. DOI: 10.3390/cancers15123140
30. Имянитов Е.Н. Эпидемиология и биология рака простаты. Практическая онкология. 2008;9(2):57-64. eLIBRARY ID: 19130354; EDN: QCQJKL
31. Zhou J, Du T, Li B, Rong Y, Verkhratsky A, Peng L. Crosstalk Between MAPK/ERK and PI3K/AKT Signal Pathways During Brain Ischemia/ Reperfusion. ASN Neuro. 2015;7(5):1759091415602463. DOI: 10.1177/1759091415602463
32. Butler DE, Marlein C, Walker HF, Frame FM, Mann VM, Simms MS, Davies BR, Collins AT, Maitland NJ. Inhibition of the PI3K/AKT/mTOR pathway activates autophagy and compensatory Ras/Raf/MEK/ERK signalling in prostate cancer. Oncotarget. 2017;8(34):56698-56713. DOI: 10.18632/oncotarget.18082
33. Shorning BY, Dass MS, Smalley MJ, Pearson HB. The PI3K-AKT-mTOR Pathway and Prostate Cancer: At the Crossroads of AR, MAPK, and WNT Signaling. Int J Mol Sci. 2020;21(12):4507. DOI: 10.3390/ijms21124507
34. Sadrkhanloo M, Paskeh MDA, Hashemi M, Raesi R, Motahhary M, Saghari S, Sharifi L, Bokaie S, Mirzaei S, Entezari M, Aref AR, Salimimoghadam S, Rashidi M, Taheriazam A, Hushmandi K. STAT3 signaling in prostate cancer progression and therapy resistance: An oncogenic pathway with diverse functions. Biomed Pharmacother. 2023;158:114168. DOI: 10.1016/j.biopha.2022.114168
35. Luo J, Zha S, Gage WR, Dunn TA, Hicks JL, Bennett CJ, Ewing CM, Platz EA, Ferdinandusse S, Wanders RJ, Trent JM, Isaacs WB, De Marzo AM. Alphamethylacyl-CoA racemase: a new molecular marker for prostate cancer. Cancer Res. 2002;62(8):2220-2226. PMID: 11956072
Об авторах
Е. А. ЧерногубоваРоссия
Черногубова Елена Александровна — канд. биол. наук.
Ростов-на-Дону
Конфликт интересов:
Нет
А. В. Аветян
Россия
Аветян Андрей Владимирович.
Ростов-на-Дону
Конфликт интересов:
Нет
М. Б. Чибичян
Россия
Чибичян Микаел Бедросович — д-р мед. наук, доцент.
Ростов-на-Дону
Конфликт интересов:
Нет
М. И. Коган
Россия
Коган Михаил Иосифович — д-р мед. наук, профессор, заслуженный деятель науки РФ.
Ростов-на-Дону
Конфликт интересов:
Нет
Рецензия
Для цитирования:
Черногубова Е.А., Аветян А.В., Чибичян М.Б., Коган М.И. Экспрессия рецепторов ангиотензина II второго типа и синдекана-1 при раке предстательной железы. Вестник урологии. 2024;12(5):45-54. https://doi.org/10.21886/2308-6424-2024-12-5-45-54
For citation:
Chernogubova E.A., Avetyan A.V., Chibichyan M.B., Kogan M.I. Expression of angiotensin II type 2 receptors and syndecan-1 in prostate cancer. Urology Herald. 2024;12(5):45-54. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-5-45-54













































