Перейти к:
Удержание мочи после экстраперитонеальной радикальной простатэктомии: роль хирургической техники и реконструкции фасциальных пространств таза
https://doi.org/10.21886/2308-6424-2024-12-3-114-124
Аннотация
Введение. Недержание мочи является частым осложнением радикальной простатэктомии. Разработка хирургических приёмов при выполнении радикальной простатэктомии, улучшающих функцию удержания мочи после операции является актуальным направлением исследований.
Цель исследования. Сравнить функцию удержания мочи в долгосрочном наблюдении после открытой и лапароскопической радикальной простатэктомии, выполненной с использованием только задней или сочетанной (передняя + задняя) реконструкций фасциальных пространств таза.
Материалы и методы. В исследование вошли 130 пациентов в возрасте 63,0 [59,0; 68,0] лет с локальным раком предстательной железы (сT1a-2сN0-xM0; 1 – 4 группы ISUP), подвергнутых ненервсберегающей позадилонной радикальной простатэктомии с задней реконструкцией и ненервсберегающей экстраперитонеальной лапароскопической радикальной простатэктомии с изолированно задней или сочетанной (передняя + задняя) реконструкциями фасциальных пространств таза. Послеоперационную функцию удержания мочи изучали в 1-й, 3-й, 6-й и 12-й месяцы после операции посредством стандартного теста с прокладками.
Результаты. Частота удержания мочи была выше во все сроки наблюдения при лапароскопической хирургии. Начиная с 6 месяца наблюдения эти пациенты не имели тяжёлого недержания мочи. В то же время скорость прироста части пациентов, начавших удерживать мочу, не зависела от способа реконструкции фасциальных пространств таза. Применение сочетанной реконструкции фасциальных пространств таза к 12 месяцам наблюдения показало преимущество в удержании мочи перед выполнением только задней реконструкции. Такие пациенты достигли удержания мочи в 90% случаев против 80,0% в сравнении. При этом восстановление удержания мочи на всех сроках наблюдения имело относительно равномерную линейную скорость прироста показателя.
Заключение. Реконструкция фасциальных пространств таза при открытой и лапароскопической радикальной простатэктомии позволяет достичь удовлетворительной континенции в послеоперационном периоде. При этом более высокая результативность достигается при применении сочетанной техники реконструкции.
Ключевые слова
Для цитирования:
Чибичян М.Б., Коган М.И., Белоусов И.И., Сизякин Д.В., Аветян А.В., Трусов П.В., Шкодкин С.В., Пчелкин А.С. Удержание мочи после экстраперитонеальной радикальной простатэктомии: роль хирургической техники и реконструкции фасциальных пространств таза. Вестник урологии. 2024;12(3):114-124. https://doi.org/10.21886/2308-6424-2024-12-3-114-124
For citation:
Chibichyan M.B., Kogan M.I., Belousov I.I., Sizyakin D.V., Avetyan A.V., Trusov P.V., Shkodkin S.V., Pchelkin A.S. Urinary continence following extraperitoneal radical prostatectomy: impact of surgical technique and pelvic fascial spaces reconstruction. Urology Herald. 2024;12(3):114-124. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-3-114-124
Введение
Радикальная простатэктомия (РПЭ) остаётся стандартным хирургическим методом в стратегии лечения локализованного рака предстательной железы (РПЖ) [1][2]. Данная хирургия может сопровождаться рядом осложнений, связанных с зоной реконструкции пузырно-уретрального сегмента и значительно ухудшающих качество жизни пациентов, например, стеноз везико-уретрального анастомоза, диагностируемый с частотой 3 – 10% [3]. В то же время наиболее частым и не менее неприятным осложнением радикальной хирургии простаты, развивающимся в послеоперационном периоде, является недержание мочи (НМ) при напряжении с частотой выявляемости 88 – 100% случаев [4 – 6].
Наиболее вероятными причинами его развития являются травматизация наружного уретрального сфинктера при обработке дорсального венозного комплекса, повреждение мышц уретры при её диссекции и последующем наложении анастомоза [7]. Учитывая, что иннервация наружного сфинктера уретры осуществляется половым нервом, находящимся в составе сосудисто-нервного пучка, нельзя исключить, что интраоперационное повреждение последнего также может являться причиной НМ, при том, что его сохранение в ходе операции сопровождается более ранним контролем над функцией удержания мочи [8].
Показатель восстановления функции удержания мочи варьируется от 66,7 до 97,0% случаев через 48 недель после лапароскопической и лапароскопической робот-ассистированной РПЭ, уровень удержания через 12 недель варьируется более широко (от 17 до 89% случаев) [9][10].
Вероятно, достижение восстановления ранней континентности является сложной задачей и имеет большее влияние на качество жизни пациентов, чем восстановление удержания мочи в целом [11]. На сегодняшний день известно множество технических модификаций для улучшения послеоперационной функции удержания мочи, в том числе интраоперационная апикальная диссекция и сохранение мембранозной уретры [12], сохранение дорсального венозного комплекса [13], интрафасциальный нервсберегающий подход [14], сохранение пубопростатических связок [15].
Кроме того, достаточное число публикаций свидетельствует о протективном влиянии восстановления мышечно-фасциальных пространств таза, когда выполняются изолированные передняя [16], задняя [17] или сочетанная (передняя + задняя) [18] реконструкции.
Таким образом, очевидно, что причины развития НМ после РПЭ множественны, характер нарушений анатомо-функциональных структур, ответственных за континентность, до конца не изучен, а поиск путей профилактики послеоперационной инконтиненции продолжается.
Цель исследования. Первичной целью исследования определён сравнительный анализ функции удержания мочи в долгосрочном наблюдении после РПЭ, выполненной открытым и лапароскопическим подходами, вторичной — сравнение эффективности функции удержания мочи при лапароскопической РПЭ, когда выполнялись только задняя или сочетанная (передняя + задняя) реконструкции фасциальных пространств таза.
Материалы и методы
В исследование включены 130 пациентов с РПЖ в возрасте от 48 до 78 лет, подвергнутые РПЭ. Показанием к РПЭ являлся локальный РПЖ и предполагаемая продолжительность жизни более 10 лет.
Всем пациентам было проведено стандартное предоперационное обследование при РПЖ, включая оценку симптомов нижних мочевых путей (СНМП), которую изучали с помощью опросника «Международный индекс простатических симптомов» (International Prostate Symptom Score — IPSS).
Из 130 пациентов в 69,2% случаев (1-я группа, n = 90) выполнена открытая позадилонная РПЭ по методике P.S. Walsh (1983) без выполнения приёмов нервсбережения, но с реконструкцией задних мышечно-фасциальных пространств таза. В остальных 30,8% случаев (2-я группа, n = 40) применена лапароскопическая РПЭ из экстраперитонеального доступа экстрафасциальным подходом, также без нервсбережения. Нервнесберегающая техника выбрана в связи с объёмом распространения опухолевого процесса в железе.
При этом пациентам с лапароскопической РПЭ в равных долях выполнена изолированная реконструкция задних (2А подгруппа, n = 20) и сочетанная реконструкция задних и передних фасциальных пространств таза (2Б подгруппа, n = 20). Задняя реконструкция фасциальных структур проводилась по авторской методике (патент РФ № 2809655): после удаления предстательной железы либо открытым, либо лапароскопическим способом края висцеральной части эндопельвикальной фасции, покрывающие m. levator ani, сшиваются друг с другом непрерывным продольным швом (V-loc № 3). Тем самым восстанавливается фасциальная опора уретровезикального сегмента и задней стенки мочевого пузыря над прямой кишкой [19]. Переднюю фиксацию проводили посредством сшивания околошеечных тканей мочевого пузыря с пубопростатическими связками.
Уретральный катетер удаляли на 12 – 14-е сутки после оперативного вмешательства, осуществляя предварительный рентгенологический контроль герметичности пузырно-уретрального анастомоза посредством перикатетерной ретроградной уретрографии. При выявлении экстравазации контрастного вещества в зоне пузырно-уретрального анастомоза (единичные случаи) интубацию уретры пролонгировали ещё на 7 суток для достижения полной герметичности уретровезикального анастомоза.
Послеоперационную функцию удержания мочи изучали в четырёх контрольных точках (1-й, 3-й, 6-й и 12-й месяцы после РПЭ) посредством оценки результатов общепринятого теста с прокладками. Удерживающими мочу считали пациентов, использующих 0 – 1 прокладку в сутки [20]. Больных, использующих 2 прокладки, относили к имеющим слабое НМ, тех, кто применял 3 и более прокладок в сутки, — к тяжёлому НМ. Начиная со второй контрольной точки наблюдения пациентов, неудерживающих мочу, анализировали отдельно.
Статистический анализ. Статистическую обработку полученных результатов проводили, используя программу Statistica 10.0 (“StatSoft Inc.”, Tulsa, OK, USA). Данные обработаны непараметрическими методами анализа. Качественные показатели представлены как абсолютные и относительные частоты (проценты). Описательная статистика количественных признаков представлена в виде медианы (Me), межквартильного размаха [нижний (LQ) и верхний (UQ) квартили] и крайних значений (минимум (min) – максимум (max), в тексте представлено как Me [LQ; UQ] (min – max). Обработку полученных данных между двумя независимыми выборками выполняли посредством U-критерия Mann-Whitney, сравнение связанных признаков проводили ранговым дисперсионным анализом Friedman. Принятый уровень достоверности — p < 0,05.
Результаты
Средний возраст пациентов составил 63,0 [ 59,0; 68,0] (48,0 –78,0) лет. Индекс массы тела — 27,5 [ 25,1; 30,1] (19,4 – 35,4) кг/см². У всех пациентов РПЖ был верифицирован до введения в исследование, клиническая стадия заболевания находилась в рамках сT1a-2сN0-xM0 и 1 – 4 группы ISUP. При этом, согласно результатам медианного анализа, уровень общего простатического специфического антигена составил 8,8 [ 5,9 – 15,0] нг/мл (от 0,49 до 60,0 нг/мл), объём простаты — 45,1 [ 34,5 – 58,5] см³ (от 14,9 до 133,0 см³). Уровень симптомов нижних мочевых путей (СНМП) в совокупности составил 11,0 [ 8,0 – 16,0] баллов (от 2 до 32 баллов), что соответствует умеренным нарушениям мочеиспускания.
Межгрупповое сравнение исходных клинических данных пациентов в интересующих точках наблюдения показало, что в 1-й группе медиана возраста пациентов была статистически значимо ниже, чем во 2-й группе. В то же время размеры простаты по медианному анализу в группах статистически значимых различий не имели. Показатели общего балла СНМП (опросник I-PSS) в группах имели статистически значимые отличия, но при этом частота ирритативных и обструктивных СНМП в группах была подобна. Указанные межгрупповые различия, вероятно, отчасти объясняются отличиями в размерах предстательных желез, хотя статистически значимой разницы в этом показателе не установлено (табл. 1).
Таблица 1. Клинические данные пациентов 1-й и 2-й групп
Параметры Me [LQ; UQ] (min – max) | Группа 1 (n = 90) | Группа 2 (n = 40) | Р |
Возраст, годы | 62,0 [ 59,0; 68,0] (48,0 – 78,0) | 66,0 [ 62,0; 68,5] (51,0 – 71,0) | 0,031 |
ИМТ, см/кг² | 27,5 [ 25,0; 30,1] (19,4 – 30,1) | 27,3 [ 25,4; 30,7] (21,7 – 35,4) | 0,515 |
Объём простаты, см³ | 45,9 [ 35,4; 58,5] (16,0 – 133,0) | 40,5 [ 33,2 –58,4] (14,9 – 96,7) | 0,287 |
СНМП, баллы | 12,5 [ 10,0; 19,0] (4,0 – 32,0) | 8,0 [ 5,5 – 11,5] (2,0 – 15,0) | 0,000 |
Примечание. ИМТ — индекс массы тела; СНМП — симптомы нижних мочевых путей;
р — критерий статистической значимости U-критерий Манна-Уитни
В то же время сопоставление таковых данных в подгруппах пациентов, подвергнутых лапароскопической РПЭ, не показало статистически значимых отличий, что позволяет считать результаты сравнимыми (табл. 2).
Таблица 2. Клинические данные пациентов 2А и 2Б подгрупп 2-й группы
Параметры Me [LQ; UQ] (min-max) | Подгруппа 2А (n = 20) | Подгруппа 2Б (n = 20) | Р |
Возраст, годы | 64,5 [ 61,5 – 67,5] (51,0 – 71,0) | 67,0 [ 63,0 – 69,0] (60,0 – 71,0) | 0,165 |
ИМТ, см/кг² | 26,8 [ 24,9; 29,0] (22,5 – 35,4) | 28,0 [ 26,1; 31,7] (21,7 – 35,2) | 0,253 |
Объём простаты, см³ | 39,95 [ 31,1 – 50,6] (23,8 – 96,7) | 43,75 [ 34,6 – 64,15] (14,9 – 78,5) | 0,445 |
СНМП, баллы | 6,5 [ 3,5 – 11,0] (2,0 – 15,0) | 9,5 [ 6,5 – 12,0] (3,0 – 15,0) | 0,114 |
Примечание. ИМТ — индекс массы тела; СНМП — симптомы нижних мочевых путей;
р — критерий статистической значимости U-критерий Манна-Уитни
Оценка континентности в группах с различными хирургическими подходами (1-й и 2-й группы) показала, что частота удержания мочи через месяц после удаления уретрального катетера была выше на 6,7% во 2-й группе, чем в 1-й (43,3% против 50,0% для 1-й и 2-й групп соответственно). Подобное соотношение отмечено и к концу периода наблюдения (12 месяцев), когда число удерживающих мочу пациентов во 2-й группе превысило количество таковых в 1-й на 13,9% (71,1% против 85,0% случаев для 1-й и 2-й групп соответственно) (рис. 1). При этом следует отметить тот факт, что динамика прироста количества удерживающих мочу пациентов в 1-й и 2-й группах сравнима, что достаточно наглядно представлено на рисунке 1. Таким образом, преимущество лапароскопического подхода в сравнении с открытым по количеству удерживающих мочу пациентов является очевидным.
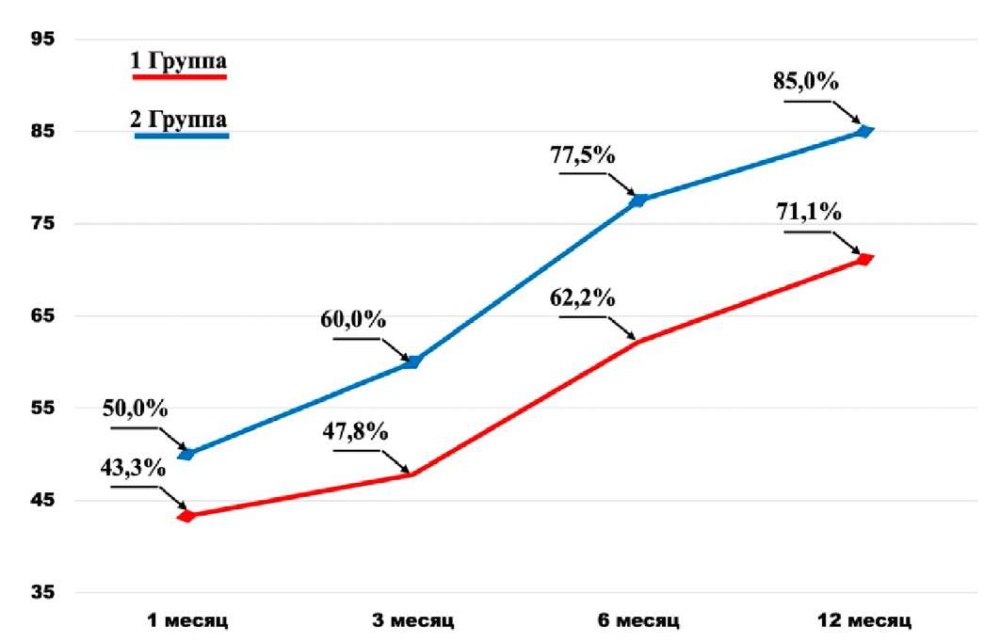
Рисунок 1. Частота и динамика прироста континентных пациентов
после открытой и лапароскопической РПЭ за период наблюдения
Отдельно изучены результаты инконтинентных пациентов, имеющих лёгкое (2 прокладки в сутки) и тяжёлое (3 и более прокладок в сутки) НМ. Анализ показал, что исходно (1-я контрольная точка), более тяжёлое повреждение функции удержания мочи имели пациенты 1-й группы (56,7%, против 50,0% во 2-й группе). Частота тяжёлой степени НМ у пациентов этой группы также была выше на 6,1% в сравнении со 2-й. Неверно было бы относить это только на счёт открытого хирургического подхода с большей травматизацией тканей, поскольку в 1-й группе у пациентов имелись более выраженные исходные СНМП, 12,5 [ 10,0; 19,0] баллов против 8,0 [ 5,5 – 11,5] баллов (p < 0,000).
При последующем наблюдении над пациентами с НМ была установлена существенная регрессия тяжёлой степени НМ до лёгкой как в 1-й, так и во 2-й группах. Вместе с тем у больных 2-й группы уже с 6-го месяца наблюдения полностью отсутствовало тяжёлое НМ, а доля лёгкого была значимо ниже в сравнении с пациентами 1-й группы (рис. 2).
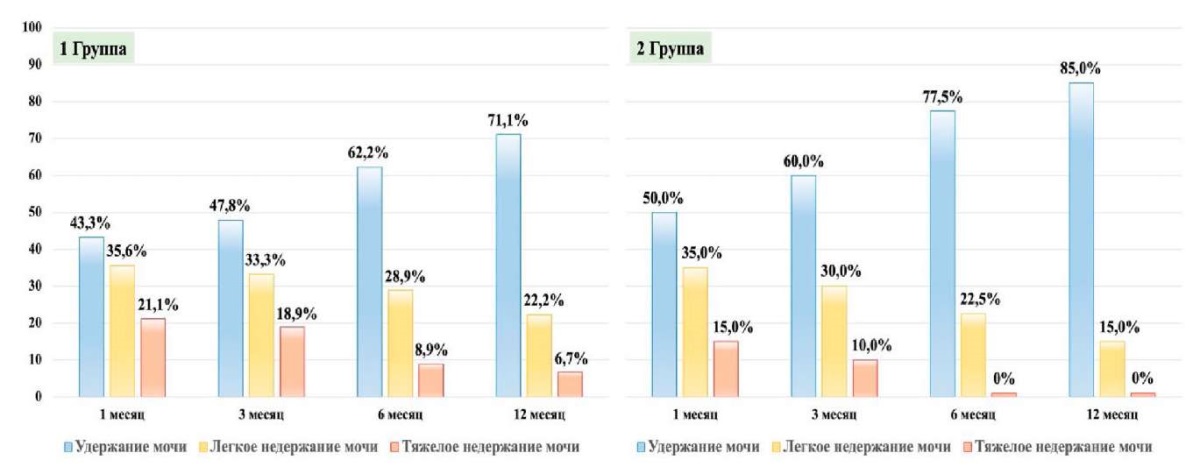
Рисунок 2. Динамика тяжести НМ после открытой и лапароскопической РПЭ
Подобным образом нами были сопоставлены больные, оперированные лапароскопическим методом, где в ходе РПЭ выполнялась только задняя или сочетанная (передняя + задняя) реконструкции фасциальных пространств таза, 2А и 2Б подгруппы соответственно.
Оценка в 1-й контрольной точке продемонстрировала значимое преимущество в количестве пациентов, удерживающих мочу, в случае выполнения сочетанной реконструкции в сравнении только с задней, 60% против 40,0% для 2 Б и 2А подгрупп соответственно. К 12 месяцам наблюдения прирост полностью континентных больных был на 40% выше в 2А подгруппе, в то время как во 2Б подгруппе достиг 30,0%. Тем не менее в конце года наблюдения доля континентных пациентов была выше во 2Б подгруппе (80,0% и 90,0% случаев для 2А и 2Б подгрупп соответственно). Наряду с этим у пациентов 2А подгруппы восстановление удержания мочи (2-я и 3-я контрольные точки) характеризовалось равномерной линейной скоростью прироста, тогда как во 2А подгруппе аналогичный процесс был неравномерным, с максимальным приростом к 6 месяцу наблюдения и последующим снижением динамики изменений (рис. 3).
Эти данные позволяют считать, что лучшая континентность после лапароскопической РПЭ в сравнении с позадилонной РПЭ определяется в том числе меньшей травматичностью и большей прецизионностью метода, а также объёмом интраоперационной фасциальной реконструкции.
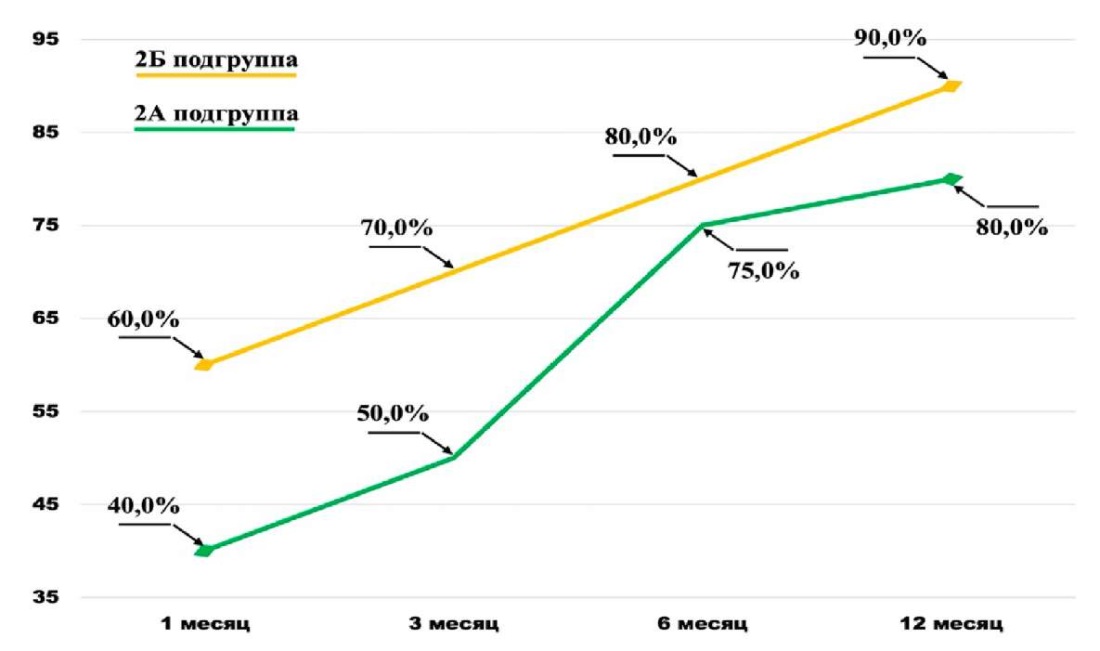
Рисунок 3. Частота и динамика долей континентных пациентов
в случае изолированной и сочетанной реконструкций фасций таза
при лапароскопической РПЭ
Сравнительный анализ инконтинентных пациентов подгрупп 2А и 2Б 2-й группы показал, что применение сочетанной реконструкции (2Б подгруппа) уже в первой и далее во второй контрольных точках наблюдения приводит к снижению частоты инконтиненции на 20,0% в сравнении с выполненной только задней реконструкцией (2А подгруппа). Эти изменения затрагивают только пациентов с лёгкой степенью НМ, доли тяжёлой инконтиненции в группах одинаковы. Так, у пациентов подгруппы 2Б в сравнении с таковыми подгруппы 2А частота лёгкого НМ уже в 1-й контрольной точке в 1,8 раз меньше, и снижается в 2; 1,3 и 2 раза в последующих контрольных точках наблюдения. Стоит также обратить внимание на тот факт, что через 6 месяцев после РПЭ ни у одного из пациентов 2А и 2Б подгрупп не регистрируется тяжёлое НМ (рис. 4).
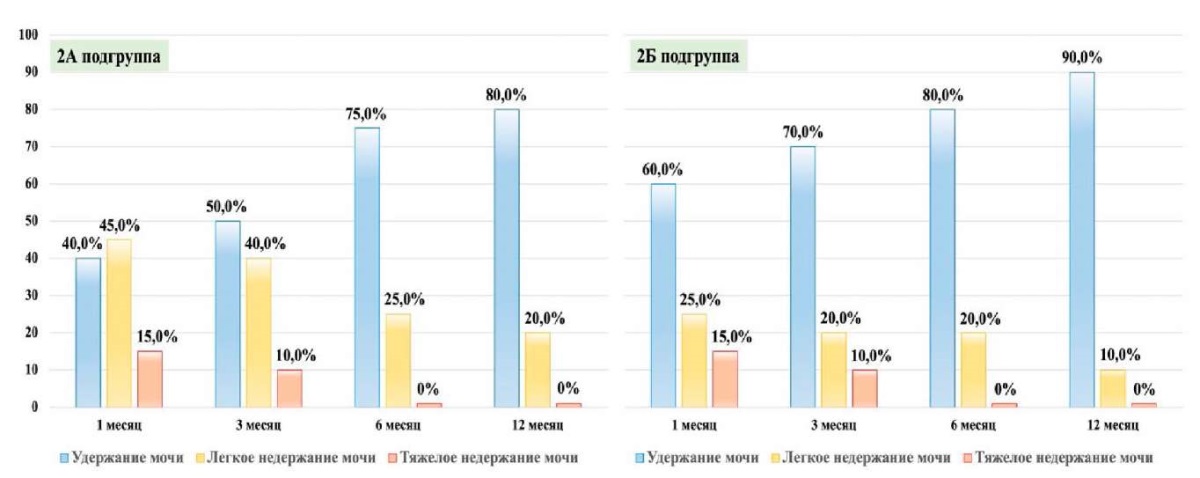
Рисунок 4. Регрессия тяжести НМ
при выполнении изолированной и сочетанной реконструкции фасций таза
при лапароскопической РПЭ
Обсуждение
Несмотря на все предпринимаемые хирургами усилия, частота НМ после РПЭ в опубликованных сериях варьируется от 2% до 66% в зависимости от методики оценки НМ, длительности послеоперационного периода и метода применённой хирургии [21].
Интересно, но трактовки удержания мочи после РПЭ до сих пор весьма вариабельны. На наш взгляд, очевидным является утверждение о том, что под континентностью следует понимать отсутствие непроизвольной потери мочи и необходимости использования защитных приспособлений (прокладки, памперсы и т.д.), что первоначально и было предложено Р. Walsh (1994) [22]. Но вскоре другие авторы сочли возможным считать, что континентным следует считать пациента, использующего либо 0 – 1 защитную прокладки в день, либо 1 страховочную [20]. ICS (International Continence Society) в своих рекомендациях предлагает считать удержанием отсутствие выделения мочи в покое или при физической активности с возможным использованием одной прокладки в сутки в качестве «страховочной». Тем не менее распространённой также является и точка зрения о так называемом «социальном» удержании, когда допускается использование 1 защитной прокладки в сутки. Такая широта параметров оценки послеоперационного НМ, к сожалению, затрудняет сравнение результатов и возможные сопоставления исследовательских данных различных центров. Например, в систематическом обзоре и метаанализе 51 хирургической серии в период с 2008 по 2011 год зарегистрированные показатели 12-месячного недержания мочи при использовании определения удержания как отсутствия необходимости в прокладках, составляли от 4% до 31%, в среднем 16%. Исследования, в которых использовались оценочные нормы «социального» удержания, показали, что частота 12-месячного недержания мочи колебалась от 8% до 11%, в среднем — 9% [23].
В нашей работе мы не использовали идеальную оценку континенции Walsh. Полученные нами данные, во-первых, согласуются с результатами коллег в подобных исследованиях, во-вторых, позволяют продемонстрировать преимущества лапароскопической РПЭ перед позадилонной, а также различных приёмов реконструкции мышечно-фасциальных пространств таза в сохранении функции удержания мочи и более раннем восстановлении контроля над континентностью.
Сегодня известны факторы, оказывающие влияние на восстановление удержания мочи после РПЭ. К ним в основном относят возраст, индекс массы тела, тяжесть СНМП, коморбидность, дооперационную эректильную дисфункцию, объём простаты, длину уретры и опыт хирурга [24 – 27].
Нами изучены некоторые из этих показателей, такие как возраст пациентов, индекс массы тела, размеры предстательной железы, уровень СНМП. Индекс массы тела и размеры предстательных желез не имели статистических различий при всех межгрупповых сравнениях, следовательно не были значимы в полученных результатах.
Неоднозначны данные по возрасту. Так, пациенты, подвергнутые открытой РПЭ, были моложе в сравнении с оперированными лапароскопическим способом, однако результаты континенции у них были хуже. В подгруппах лапароскопической РПЭ этот показатель был сравним.
Также неясно влияние исходного уровня СНМП на инконтиненцию: вероятно, он мог бы утяжелить развитие и течение НМ у пациентов после открытой РПЭ, поскольку был у них статистически значимо выше в сравнении с оперированными лапароскопическим методом, но соотношение ирритативных и обструктивных СНМП в группах было сравнимо, что не даёт должного объяснения этому факту. Среди пациентов, перенёсших лапароскопическую РПЭ, различий в этом показателе не наблюдалось.
Дискуссии о степени влияния различных хирургических подходов на развитие послеоперационной инконтиненции при выполнении РПЭ продолжается по сей день. Безусловно, лапароскопическая робот-ассистированная РПЭ является в настоящее время идеалом для сравнения с другими хирургическими методами и представляет существенно большие возможности в профилактике НМ, чем открытая хирургия, однако однозначного преимущества одного подхода над другим в современной литературе по данной проблеме не описано. Так, представленные L. Cao et al. (2019) результаты мета-анализа пяти исследований продемонстрировали, что частота континенции через 12 месяцев после лапароскопической робот-ассистированной и открытой РПЭ составила 71,6% (1845 из 2575 случаев) и 70,8% (1176 из 1661 случая) соответственно. При этом авторы указали на отсутствие значимого различия среди групп по этому показателю [28]. В проспективном сравнительном исследовании, опубликованном G.B. Di Pierro (2011), говорится, что восстановление функции удержания мочи для групп открытой и робот-ассистированной РПЭ через 3 месяца после РПЭ происходит достаточно равномерно, 83% и 95% соответственно, при этом данные по удержанию мочи через 12 месяцев после операции сравнимы [29]. В нашем исследовании мы также установили, что проведение РПЭ лапароскопическим подходом позволяет не только снизить количество инконтинентных пациентов, но и укоротить период восстановления функции удержания мочи в сравнении с открытой позадилонной РПЭ.
Помимо хирургической техники, в настоящее время немаловажное значение в профилактике послеоперационной инконтиненции отводится и техническим приёмам реконструкции фасциально-мышечных пространств таза. Первая реконструктивная техника, обеспечивающая как лучший гемостаз, так и сохранение поддерживающих структур уретрального сфинктера, была предложена и описана P. Walsh et al. в 1998 году. Она заключалась в выполнении передней суспензии, проходящей между уретрой и ДВК, и фиксирующей эти ткани к надкостнице лонной кости [30]. Впоследствии в литературе эта техника была ассоциирована с более коротким сроком восстановления удержания мочи [31]. В дальнейшем V.R. Patel et al. (2009) установили, что передняя реконструкция, улучшая функциональные результаты удержания после лапароскопической робот-ассистированной РПЭ в сроки до 3 месяцев, не влияет на уровень восстановления континенции через 6 и 12 месяцев наблюдения [16]. В 2001 году F. Rocco et al. (2001) описали методику улучшения восстановления функции удержания мочи после открытой РПЭ. Техника подразумевает фиксацию задней мышечно-фасциальной пластинки путём подшивания срединного дорсального шва к остаткам фасции Denonvilliers, расположенной кзади от мочевого пузыря, что позволяет обеспечить адекватную апроксимацию мембранозной уретры и шейки мочевого пузыря [32]. Этот метод со временем был внедрён при лапароскопических и роботизированных вмешательствах и ассоциирован с более ранним восстановлением континенции после РПЭ [33 – 35]. Однако следует заметить, что в отношении функциональных результатов РПЭ эти данные не были подтверждены другими исследовательскими группами [35][36].
В мета-анализе 21 исследования A.A. Grasso et al. (2016) показали значительное преимущество, связанное с применением задней реконструкции, с точки зрения послеоперационного удержания мочи в разные временные интервалы (3, 7, 30 и 90 дней после удаления катетера, но не в более поздние сроки) [37]. В другом недавнем мета-анализе применение задней реконструкции оказалось связано со значительно более высокими показателями полного восстановления функции удержания мочи через 1 – 4, 28 – 42, 90, 180 и 360 дней после удаления катетера [38].
В нашем исследовании мы отметили прямую зависимость между объёмом реконструкции фасциальных пространств таза и улучшением континентности. Это выражалось как в большем числе удерживающих мочу на ранних сроках после операции, так и в количестве восстановивших удержание при последующем долгосрочном наблюдении. Кроме того, сочетанная реконструкция привела к более быстрой регрессии инконтиненции и снижению её тяжести в сравнении с теми больными, у кого была выполнена только задняя фасциальная фиксация.
Таким образом, приводимые в мировой литературе данные по проблеме функциональных изменений акта мочеиспускания после проведённой РПЭ весьма неоднозначны. С одной стороны, это определяется отсутствием регламентирующих документов оценки континентности и степени тяжести НМ. С другой — нет однозначных результатов преимущества каких-либо хирургических методов в восстановлении функции нижних мочевых путей в долгосрочном наблюдении. Кроме того, разнообразие авторских хирургических методик, используемых хирургами, не позволяет проводить полномасштабные сравнительные исследования, а тем более проводить сравнения уже полученных результатов. Относительно недавние, последнего десятилетия, исследования, посвящённые сохранению уретры и шейки мочевого пузыря, реконструкциям миофасциальных тазовых пространств при выполнении РПЭ показали воспроизводимость положительных результатов этих технических действий касательно протекции функции удержания мочи.
Нередко планируя или выполняя РПЭ, хирург сталкивается с ситуацией, когда выполнение нервсбережения в данном конкретном случае не представляется возможным. Причины такого ограничения многообразны и в ряде случаев могут быть определены только интраоперационно. И, хотя функциональные результаты РПЭ не являются главной целью хирургического лечения РПЖ, для пациента они крайне важны и это надо учитывать. В этой связи использование иных хирургических приёмов, сравнимых по функциональной результативности с нервсбережением, весьма актуально.
Как показали наши результаты, реконструкция фасциальных пространств таза как при открытой РПЭ, так и при использовании лапароскопической техники даже без использования нервсбережения позволяет достичь относительно высоких результатов в достижении удержания мочи как в ближайшее время после операции, так и в долгосрочном наблюдении. При этом более высокая результативность достигается при выполнении одномоментного восстановления как задних, так и передних фасциальных пространств таза.
Заключение
РПЭ, выполненная как открытым, так и лапароскопическим методами вне приёмов нервсбережения, но дополненная техниками реконструкции фасциальных пространств таза, позволяет достичь высокой частоты континентности у пациентов в долгосрочном наблюдении, а к шестому месяцу наблюдения полностью избавить пациентов от тяжёлого НМ. При этом скорость восстановления удержания мочи значимо больше при лапароскопическом подходе.
При выполнении лапароскопической РПЭ сочетанная реконструкция фасций таза в сравнении с только задней обладает доказанными преимуществами, выражающимися в высокой частоте и более раннем восстановлении удержания мочи. Кроме того, при долгосрочном наблюдении у пациентов с методикой сочетанной реконструкции отмечается более динамичная регрессия НМ.
Список литературы
1. Чибичян М.Б. Открытая позадилонная радикальная простатэктомия. Вестник урологии. 2018;6(1):81-93. DOI: 10.21886/2308-6424-2018-6-1-81-93
2. EAU guidelines on prostate cancer. (Accessed on 10.02.2024) URL: https://uroweb.org/guidelines/prostate-cancer/chapter/treatment
3. Чибичян М.Б., Коган М.И., Лаптева Т.О., Белоусов И.И., Иванов А.Г., Черногубова Е.А. Перипростатическое воспаление как фактор риска развития стеноза везико-уретрального анастомоза после радикальной простатэктомии. Урология. 2015;6:52-57. eLIBRARY ID: 25133511; EDN: VDZXMZ
4. Groutz A, Blaivas JG, Chaikin DC, Weiss JP, Verhaaren M. The pathophysiology of post-radical prostatectomy incontinence: a clinical and video urodynamic study. J Urol. 2000;163(6):1767-1770. PMID: 10799178
5. Kielb SJ, Clemens JQ. Comprehensive urodynamics evaluation of 146 men with incontinence after radical prostatectomy. Urology. 2005;66(2):392-396. DOI: 10.1016/j.urology.2005.03.026
6. Sandhu JS, Breyer B, Comiter C, Eastham JA, Gomez C, Kirages DJ, Kittle C, Lucioni A, Nitti VW, Stoffel JT, Westney OL, Murad MH, McCammon K. Incontinence after Prostate Treatment: AUA/SUFU Guideline. J Urol. 2019;202(2):369-378. DOI: 10.1097/JU.0000000000000314
7. Chao R, Mayo ME. Incontinence after radical prostatectomy: detrusor or sphincter causes. J Urol. 1995;154(1):16-8. DOI: 10.1016/s0022-5347(01)67212-4
8. van der Poel HG, de Blok W, Joshi N, van Muilekom E. Preservation of lateral prostatic fascia is associated with urine continence after robotic-assisted prostatectomy. Eur Urol. 2009;55(4):892-900. DOI: 10.1016/j.eururo.2009.01.021
9. Menon M, Shrivastava A, Kaul S, Badani KK, Fumo M, Bhandari M, Peabody JO. Vattikuti Institute prostatectomy: contemporary technique and analysis of results. Eur Urol. 2007;51(3):648-657; discussion 657-658. DOI: 10.1016/j.eururo.2006.10.055
10. Ficarra V, Novara G, Artibani W, Cestari A, Galfano A, Graefen M, Guazzoni G, Guillonneau B, Menon M, Montorsi F, Patel V, Rassweiler J, Van Poppel H. Retropubic, laparoscopic, and robot-assisted radical prostatectomy: a systematic review and cumulative analysis of comparative studies. Eur Urol. 2009;55(5):1037-1063. DOI: 10.1016/j.eururo.2009.01.036
11. Sanda MG, Dunn RL, Michalski J, Sandler HM, Northouse L, Hembroff L, Lin X, Greenfield TK, Litwin MS, Saigal CS, Mahadevan A, Klein E, Kibel A, Pisters LL, Kuban D, Kaplan I, Wood D, Ciezki J, Shah N, Wei JT. Quality of life and satisfaction with outcome among prostate-cancer survivors. N Engl J Med. 2008;358(12):1250-1261. DOI: 10.1056/NEJMoa074311
12. Mungovan SF, Sandhu JS, Akin O, Smart NA, Graham PL, Patel MI. Preoperative Membranous Urethral Length Measurement and Continence Recovery Following Radical Prostatectomy: A Systematic Review and Meta-analysis. Eur Urol. 2017;71(3):368-378. DOI: 10.1016/j.eururo.2016.06.023
13. Hoshi A, Usui Y, Shimizu Y, Tomonaga T, Kawakami M, Nakajima N, Hanai K, Nomoto T, Terachi T. Dorsal vein complex preserving technique for intrafascial nerve-sparing laparoscopic radical prostatectomy. Int J Urol. 2013;20(5):493-500. DOI: 10.1111/j.1442-2042.2012.03181.x
14. Stolzenburg JU, Rabenalt R, Do M, Schwalenberg T, Winkler M, Dietel A, Liatsikos E. Intrafascial nerve-sparing endoscopic extraperitoneal radical prostatectomy. Eur Urol. 2008;53(5):931-940. DOI: 10.1016/j.eururo.2007.11.047
15. Stolzenburg JU, Liatsikos EN, Rabenalt R, Do M, Sakelaropoulos G, Horn LC, Truss MC. Nerve sparing endoscopic extraperitoneal radical prostatectomy--effect of puboprostatic ligament preservation on early continence and positive margins. Eur Urol. 2006;49(1):103-111; discussion 111-112. DOI: 10.1016/j.eururo.2005.10.002
16. Patel VR, Coelho RF, Palmer KJ, Rocco B. Periurethral suspension stitch during robot-assisted laparoscopic radical prostatectomy: description of the technique and continence outcomes. Eur Urol. 2009;56(3):472-478. DOI: 10.1016/j.eururo.2009.06.007
17. Nguyen MM, Kamoi K, Stein RJ, Aron M, Hafron JM, Turna B, Myers RP, Gill IS. Early continence outcomes of posterior musculofascial plate reconstruction during robotic and laparoscopic prostatectomy. BJU Int. 2008;101(9):1135-1139. DOI: 10.1111/j.1464-410X.2007.07425.x
18. Tewari A, Jhaveri J, Rao S, Yadav R, Bartsch G, Te A, Ioffe E, Pineda M, Mudaliar S, Nguyen L, Libertino J, Vaughan D. Total reconstruction of the vesico-urethral junction. BJU Int. 2008;101(7):871-877. DOI: 10.1111/j.1464-410X.2008.07424.x
19. Патент № 2809655 C1 Российская Федерация, МПК A61B 17/00. . Аветян А.В., Чибичян М.Б., Белоусов И.И., Шевченко А.Н., Трусов П.В. Способ профилактики недержания мочи после радикальной простатэктомии : № 2023115805 : заявл. 15.06.2023 : опубл. 14.12.2023. Ссылка активна на 16.01.2024 URL: https://www.elibrary.ru/download/elibrary_59918491_64251534.PDF
20. Lepor H, Kaci L, Xue X. Continence following radical retropubic prostatectomy using self-reporting instruments. J Urol. 2004;171(3):1212-1215. DOI: 10.1097/01.ju.0000110631.81774.9c
21. MacDiarmid SA. Incontinence after radical prostatectomy: pathophysiology and management. Curr Urol Rep. 2001;2(3):209-213. DOI: 10.1007/s11934-001-0080-2
22. Walsh PC, Partin AW, Epstein JI. Cancer control and quality of life following anatomical radical retropubic prostatectomy: results at 10 years. J Urol. 1994;152(5 Pt 2):1831-1836. DOI: 10.1016/s0022-5347(17)32396-0
23. Ficarra V, Novara G, Rosen RC, Artibani W, Carroll PR, Costello A, Menon M, Montorsi F, Patel VR, Stolzenburg JU, Van der Poel H, Wilson TG, Zattoni F, Mottrie A. Systematic review and meta-analysis of studies reporting urinary continence recovery after robot-assisted radical prostatectomy. Eur Urol. 2012;62(3):405-417. DOI: 10.1016/j.eururo.2012.05.045
24. Pacik D, Fedorko M. Literature review of factors affecting continence after radical prostatectomy. Saudi Med J. 2017;38(1):9-17. DOI: 10.15537/smj.2017.1.15293
25. Wei Y, Wu YP, Lin MY, Chen SH, Lin YZ, Li XD, Zheng QS, Xue XY, Xu N. Impact of Obesity on Long-Term Urinary Incontinence after Radical Prostatectomy: A Meta-Analysis. Biomed Res Int. 2018;2018:8279523. DOI: 10.1155/2018/8279523
26. Wenzel M, Preisser F, Mueller M, Theissen LH, Welte MN, Hoeh B, Humke C, Bernatz S, Bodelle B, Würnschimmel C, Tilki D, Huland H, Graefen M, Roos FC, Becker A, Karakiewicz PI, Chun FKH, Kluth LA, Mandel P. Effect of prostatic apex shape (Lee types) and urethral sphincter length in preoperative MRI on very early continence rates after radical prostatectomy. Int Urol Nephrol. 2021;53(7):1297-1303. DOI: 10.1007/s11255-021-02809-7
27. Kadono Y, Nohara T, Kawaguchi S, Iwamoto H, Yaegashi H, Shigehara K, Izumi K, Mizokami A. Impact of Pelvic Anatomical Changes Caused by Radical Prostatectomy. Cancers (Basel). 2022;14(13):3050. DOI: 10.3390/cancers14133050
28. Cao L, Yang Z, Qi L, Chen M. Robot-assisted and laparoscopic vs open radical prostatectomy in clinically localized prostate cancer: perioperative, functional, and oncological outcomes: A Systematic review and meta-analysis. Medicine (Baltimore). 2019;98(22):e15770. DOI: 10.1097/MD.0000000000015770
29. Di Pierro GB, Baumeister P, Stucki P, Beatrice J, Danuser H, Mattei A. A prospective trial comparing consecutive series of open retropubic and robot-assisted laparoscopic radical prostatectomy in a centre with a limited caseload. Eur Urol. 2011;59(1):1-6. DOI: 10.1016/j.eururo.2010.10.026
30. Walsh PC. Anatomic radical prostatectomy: evolution of the surgical technique. J Urol. 1998;160(6 Pt 2):2418-2424. DOI: 10.1097/00005392-199812020-00010
31. Walz J, Epstein JI, Ganzer R, Graefen M, Guazzoni G, Kaouk J, Menon M, Mottrie A, Myers RP, Patel V, Tewari A, Villers A, Artibani W. A Critical Analysis of the Current Knowledge of Surgical Anatomy of the Prostate Related to Optimisation of Cancer Control and Preservation of Continence and Erection in Candidates for Radical Prostatectomy: An Update. Eur Urol. 2016;70(2):301-311. DOI: 10.1016/j.eururo.2016.01.026
32. Rocco F, Gadda F, Acquati P, Carmignani L, Favini P, Dell'Orto P, Ferruti M, Avogadro A, Casellato S, Grisotto M. Ricerca personale: la ricostruzione dello sfintere striato uretrale [Personal research: reconstruction of the urethral striated sphincter]. Arch Ital Urol Androl. 2001;73(3):127-137. (In Italian). PMID: 11822054.
33. Rocco B, Gregori A, Stener S, Santoro L, Bozzola A, Galli S, Knez R, Scieri F, Scaburri A, Gaboardi F. Posterior reconstruction of the rhabdosphincter allows a rapid recovery of continence after transperitoneal videolaparoscopic radical prostatectomy. Eur Urol. 2007;51(4):996-1003. DOI: 10.1016/j.eururo.2006.10.014
34. Coelho RF, Chauhan S, Orvieto MA, Sivaraman A, Palmer KJ, Coughlin G, Patel VR. Influence of modified posterior reconstruction of the rhabdosphincter on early recovery of continence and anastomotic leakage rates after robot-assisted radical prostatectomy. Eur Urol. 2011;59(1):72-80. Erratum in: Eur Urol. 2018. DOI: 10.1016/j.eururo.2010.08.025
35. Rocco B, Cozzi G, Spinelli MG, Coelho RF, Patel VR, Tewari A, Wiklund P, Graefen M, Mottrie A, Gaboardi F, Gill IS, Montorsi F, Artibani W, Rocco F. Posterior musculofascial reconstruction after radical prostatectomy: a systematic review of the literature. Eur Urol. 2012;62(5):779-790. DOI: 10.1016/j.eururo.2012.05.041
36. Sutherland DE, Linder B, Guzman AM, Hong M, Frazier HA 2nd, Engel JD, Bianco FJ Jr. Posterior rhabdosphincter reconstruction during robotic assisted radical prostatectomy: results from a phase II randomized clinical trial. J Urol. 2011;185(4):1262-1267. DOI: 10.1016/j.juro.2010.11.085
37. Grasso AA, Mistretta FA, Sandri M, Cozzi G, De Lorenzis E, Rosso M, Albo G, Palmisano F, Mottrie A, Haese A, Graefen M, Coelho R, Patel VR, Rocco B. Posterior musculofascial reconstruction after radical prostatectomy: an updated systematic review and a meta-analysis. BJU Int. 2016;118(1):20-34. DOI: 10.1111/bju.13480
38. Cui J, Guo H, Li Y, Chen S, Zhu Y, Wang S, Wang Y, Liu X, Wang W, Han J, Chen P, Nie S, Yin G, Shi B. Pelvic Floor Reconstruction After Radical Prostatectomy: A Systematic Review and Meta-analysis of Different Surgical Techniques. Sci Rep. 2017;7(1):2737. DOI: 10.1038/s41598-017-02991-8
Об авторах
М. Б. ЧибичянРоссия
Микаел Бедросович Чибичян — д-р мед. наук, доцент
Ростов-на-Дону
М. И. Коган
Россия
Михаил Иосифович Коган — д-р мед. наук, профессор, заслуженный деятель науки РФ
Ростов-на-Дону
И. И. Белоусов
Россия
Игорь Иванович Белоусов — д-р мед. наук, доцент
Ростов-на-Дону
Д. В. Сизякин
Россия
Дмитрий Владимирович Сизякин — д-р мед. наук, профессор
Ростов-на-Дону
А. В. Аветян
Россия
Андрей Владимирович Аветян
Ростов-на-Дону
П. В. Трусов
Россия
Пётр Владимирович Трусов — канд. мед. наук
Ростов-на-Дону
С. В. Шкодкин
Россия
Сергей Валентинович Шкодкин — д-р мед. наук, доцент
Белгород
А. С. Пчелкин
Россия
Артём Сергеевич Пчелкин
Ростов-на-Дону
Рецензия
Для цитирования:
Чибичян М.Б., Коган М.И., Белоусов И.И., Сизякин Д.В., Аветян А.В., Трусов П.В., Шкодкин С.В., Пчелкин А.С. Удержание мочи после экстраперитонеальной радикальной простатэктомии: роль хирургической техники и реконструкции фасциальных пространств таза. Вестник урологии. 2024;12(3):114-124. https://doi.org/10.21886/2308-6424-2024-12-3-114-124
For citation:
Chibichyan M.B., Kogan M.I., Belousov I.I., Sizyakin D.V., Avetyan A.V., Trusov P.V., Shkodkin S.V., Pchelkin A.S. Urinary continence following extraperitoneal radical prostatectomy: impact of surgical technique and pelvic fascial spaces reconstruction. Urology Herald. 2024;12(3):114-124. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-3-114-124













































