Перейти к:
Эндоскопическое удаление камней мочевых путей у пациентов с бессимптомной бактериурией
https://doi.org/10.21886/2308-6424-2024-12-1-69-79
Аннотация
Введение. На сегодняшний день основным видом лечения пациентов с конкрементами верхних мочевых путей являются различные виды эндоскопических операций, показывающее высокую эффективность. Тем не менее эти методы сопряжены с риском развития постоперационных инфекционных осложнений, основным фактором риска которых является положительный посев мочи. Учитывая возможность выявления устойчивой бессимптомной бактериурии у данной категории больных, а также отсутствие чётких алгоритмов и схем терапии бактериурии перед эндоскопическими вмешательствами проведение сравнительного анализа инфекционных осложнений у пациентов со стерильной мочой и бактериурией, подвергающихся эндоскопическому удалению камней верхних мочевых путей является актуальной задачей.
Цель исследования. Анализ вероятности возникновения инфекционных осложнений у пациентов, подвергающихся эндоскопическому удалению камней ВМП, в том числе имеющих перед операцией данные за бессимптомную бактериурию
Материалы и методы. Проведено когортное, ретроспективное исследование данных пациентов, которые подверглись эндоскопическому удалению камней почек и мочеточника в период с января 2023 года по июль 2023 года. Из отобранных 449 историй болезни пациентов в дальнейший анализ были включены 211 пациентов, соответствующих установленным критериям включения и невключения. При первичном стерильном посеве мочи антибактериальная профилактика назначалась за несколько часов до операции, при клинически незначимой бактериурии — за 3 дня до операции, при клинически значимой бактериурии — за 7 дней до операции со сдачей контрольного посева мочи и определения антибактериальной профилактики по предложенной методике.
Результаты. По результатам статистического анализа первичный стерильный посев мочи диагностирован у 152 (72,0%) пациентов, тогда как у 59 пациентов 28% [22%; 34,5%] выявлена бактериурия, из них у 28 пациентов 13,3% [9%; 18,6%] выявлена клинически значимая бактериурия в титре ≥ 105 КОЕ/мл. После курса антибактериальной терапии бактериурия сохранилась у 6 пациентов (22%). В послеоперационном периоде лейкоцитоз выше 12×109/л отмечен у 54 пациентов (25,6%), гипертермия — у 17 пациентов (8,1%), у 11 пациентов (5,2%) подъём температуры сопровождался лейкоцитозом. У 1 (0,5%) пациента отмечено появление системной воспалительной реакции. По результатам многофакторной логистической регрессии выявлены статистически значимые связи между вероятностью развития гипертермии и бактериурией непосредственно перед операцией. Положительный посев мочи увеличивает шанс возникновения гипертермии в 4,75 раз (ОШ = 4,75, 95% ДИ [1,222; 18,803], р = 0,023). Факторами, влияющими на развитие лейкоцитоза, являлись такие переменные, как объём конкремента (р = 0,008) и дренирование верхних мочевых путей стентом (р = 0,006). При этом наличие стента снижает шанс (ОШ = 0,154, 95% ДИ [0,033; 0,512], р = 0,006) возникновения лейкоцитоза, а объём конкремента увеличивает шанс возникновения лейкоцитоза в 1,54 раза при увеличении на 1 см3 (ОШ = 1,543, 95% ДИ [1,128; 2,158], р = 0,008).
Заключение. Бактериурия является значимым фактором риска инфекционных осложнений, предварительный курс специфической антибактериальной терапии позволяет добиться стерильного посева мочи в подавляющем большинстве случаев. Расширенные курсы антибактериальной профилактики продолжительностью в 7 и 3 дня у пациентов с клинически значимой и клинически незначимой бактериурией, соответственно, представляются адекватными с точки зрения минимизации рисков постоперационных инфекционных осложнений.
Ключевые слова
Для цитирования:
Малхасян В.А., Гаджиев Н.К., Сухих С.О., Мальцев Е.Г., Киндаров И.З., Пушкарь Д.Ю. Эндоскопическое удаление камней мочевых путей у пациентов с бессимптомной бактериурией. Вестник урологии. 2024;12(1):69-79. https://doi.org/10.21886/2308-6424-2024-12-1-69-79
For citation:
Malkhasyan V.A., Gadzhiev N.K., Sukhikh S.O., Maltsev E.G., Kindarov I.Z., Pushkar D.Yu. Endoscopic stone surgery in patients having asymptomatic bacteriuria. Urology Herald. 2024;12(1):69-79. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-1-69-79
Введение
Мочекаменная болезнь (МКБ) остаётся одним из часто встречаемых урологических заболеваний, которым подвержено взрослое население [1]. В среднем на долю МКБ приходится около 50,0 – 60,0% пациентов, находящихся в стационаре [2]. Эндоурологические операции представляют собой основной метод лечения пациентов с уролитиазом. На сегодняшний день контактная уретеролитотрипсия (КУЛТ), гибкая уретеропиелокаликоскопия с литотрипсией (гибкая УРС) или перкутанная нефролитотомия (ПНЛ) являются самыми распространёнными методами лечения камней верхних мочевых путей (ВМП). Широкое распространение данных оперативных вмешательств обусловлено как высокими показателями избавления от камня, так и приемлемой частотой послеоперационных осложнений. Одним из наиболее часто встречающихся послеоперационных неблагоприятных явлений могут быть осложнения инфекционного характера, к которым относят гипертермию, острый пиелонефрит, системную воспалительную реакцию (СВР) и сепсис.
Согласно данным исследований, вероятность возникновения инфекционных осложнений после проведения литотрипсии может достигать порядка 19% (после гибкой УРС до 13,4%, после ПНЛ до 18,9%) [3]. Наиболее распространённым послеоперационным осложнением, не требующим изменения тактики лечения, является лихорадка, её происхождение различно и в ряде случаев может быть обусловлено реактивными или резорбтивными процессами [4-6]. Частота послеоперационной гипертермии после эндоурологических операций составляет от 2,8% до 17,5% [4]. Риск развития синдрома системного воспалительного может достигать 9,7%, а частота возникновения уросепсиса — до 4,7% случаев [2][7-10]. Одним из известных модифицируемых факторов риска инфекционных осложнений является бактериурия [11]. Национальные клинические рекомендации Министерства Здравоохранения Российской Федерации предписывают выполнение микробиологического (культурального) исследования мочи на бактериальные патогены c определением чувствительности к антибиотикам всем пациентам с МКБ на предоперационном этапе. Также в рамках антибактериальной (АБ) профилактики перед выполнением КУЛТ или гибкой УРС пациентам со стерильным посевом мочи рекомендуется однократный приём антибактериального препарата. При планировании ПНЛ рекомендуется стандартная АБ профилактика с дальнейшим продолжением АБ терапии [12].
Рекомендации Европейской Ассоциации Урологов / European Association of Urology (EAU) также предписывают обязательное выполнение бактериального посева мочи пациентам, которым планируется выполнение эндоурологических вмешательств. При выполнении эндоурологических операций, сопряжённых с нарушением целостности слизистой, пациентам с бессимптомной бактериурией рекомендуется антибактериальная терапия с целью профилактики инфекционных осложнений [13].
К сожалению, ни отечественные клинические рекомендации, ни рекомендации Европейской урологической ассоциации не содержат чётких алгоритмов и схем терапии бессимптомной бактериурии перед эндоскопическими вмешательствами. В большинстве исследований, на которые ссылаются зарубежные рекомендации, говорится об антибактериальной профилактике в виде назначения препарата до оперативного вмешательства. В рекомендациях Американской ассоциации урологов также отмечается необходимость выполнения бактериологического исследования мочи для решения вопроса о целесообразности дальнейшей антибиотикопрофилактики [14]. Пациентам с бактериурией перед выполнением эндоурологических операций рекомендуется назначать специфическую АБ профилактику по результатам антибиотикограммы [15]. Известно, что предоперационная антибактериальная профилактика является эффективной мерой снижения частоты инфекционных осложнений у пациентов с бактериурией, увеличивающей частоту стерильных посевов лоханочной мочи и камня, полученных интраоперационно [16].
Данные современных исследований говорят о более высокой эффективности расширенных курсов антибактериальной профилактики в части предотвращения системного воспалительного ответа и сепсиса у пациентов с факторами высокого риска инфекционных осложнений, например, такими как положительный посев мочи [17-19].
С учётом данных современной литературы, свидетельствующих о повышенном риске инфекционных осложнений у пациентов с положительным посевом мочи, желание урологов провести фармакологическую санацию мочевых путей до уровня полной стерильности мочи перед эндоскопическими операциями представляется логичным и обоснованным, однако, несмотря на это, около 17,0% пациентов с положительным после антибиотикопрофилактик посевом мочи подвергаются ПНЛ [20]. Следует также отметить, что многократные курсы антибактериальной терапии, которые назначаются пациентам в попытке стерилизовать посев мочи перед оперативным вмешательством, не всегда приводят урологов к желаемой цели и могут приводить к формированию полирезистентных бактериальных штаммов.
Цель исследования. Анализ вероятности возникновения инфекционных осложнений у пациентов, подвергающихся эндоскопическому удалению камней ВМП, в том числе имеющих перед операцией данные за бессимптомную бактериурию.
Материалы и методы
В клинике урологии «РосУниМед» на базе городской клинической больницы им. С.И. Спасокукоцкого было проведено когортное, ретроспективное исследование пациентов, которые подверглись эндоскопическому удалению камней почек и мочеточника в период с января 2023 года по июль 2023 года.
Критерии включения:
- пациенты, подвергшиеся эндоскопическому удалению камней верхних мочевых путей, прошедшие стандартное предоперационное обследование в нашей клинике;
- пациенты, в том числе с положительным посевом мочи, получившие курсы предоперационной антибактериальной профилактики в соответствии с утверждённым в клинике протоколом.
Критерии невключения:
- пациенты, в медицинской документации которых не содержалось адекватной информации о предоперационном обследовании;
- пациенты, полностью или частично прошедшие предоперационное обследование в других учреждениях;
- пациенты, которым по определённым причинам антибактериальная профилактика проводилась с отклонениями от стандартных схем, утверждённых в клинике протоколом, в том числе пациентам с полирезистентной бактериальной флорой;
- пациенты с лейкоцитурией;
- пациенты с аномалиями развития мочевой системы;
- пациенты с ВИЧ-инфекцией;
- пациенты с иммуносупрессивными состояниями;
- пациенты с постоянным уретральным катетером или цистостомическим дренажем.
Были отобраны 449 историй болезни пациентов, подвергнутых эндоскопическому удалению камней мочевых путей. В дальнейшем в анализ были включены 211 пациентов, соответствующих критериям включения и невключения в возрасте от 18 до 75 лет. Всем пациентам, согласно клиническим рекомендациям, выполняли бактериологический посев мочи с определением антибиотикочувствительности, клинический анализ крови, общий анализ мочи и МСКТ мочевыделительной системы (Toshiba Aquilion 64 — “Canon-Toshiba Medical Systems Corp.”, Ōtawara, Japan) до проведения оперативного лечения (КУЛТ, ПНЛ — оборудование “Karl Storz SE GmbH & Co. KG.”, Tutlingen, Germany; гибкая УРС — оборудование “Innovex Medical Co., Ltd.”, Pudong, Shanghai, PRC), лазерное оборудование FiberLase U2 (НПО «ИРЭ Полюс», Фрязино, РФ).
Пациентам со стерильным посевом мочи проводили антимикробную профилактику до операции по стандартной схеме, утверждённой внутрибольничным протоколом (цефтриаксон 1000 мг в/м за 2 – 3 часа до оперативного лечения) (рис. 1). При выявлении бактериурии в титре < 105 КОЕ/мл пациентам назначали курс антибактериальной профилактики с учётом чувствительности выявленного возбудителя длительностью 3 дня до операции. При выявлении одного или более видов бактерий, растущих в моче в титре ≥ 105 КОЕ/мл, назначали курс антибактериальной терапии с учётом чувствительности выявленного возбудителя длительностью 7 дней, после чего спустя 7 дней после окончания курса пациентам выполняли повторное бактериологическое исследование. В случае отсутствия роста микрофлоры проводили антимикробную профилактику по стандартной схеме, утверждённой внутрибольничным протоколом (цефтриаксон 1000 мг в/м за 2 – 3 часа до оперативного лечения). В случае выявления роста патогенной флоры с пациентом проводили беседу о высоких рисках инфекционных осложнений в послеоперационном периоде при настойчивом желании пациента избавиться от конкремента пациентам с бактериурией в титре < 105 КОЕ/мл назначали курс антибактериальной терапии с учётом чувствительности выявленного возбудителя длительностью 3 дня до операции, а пациентам с бактериурией в титре > 105 КОЕ/мл назначали курс антибактериальной терапии с учётом чувствительности выявленного возбудителя длительностью 7 дней до операции. В послеоперационном периоде оценивали частоту возникновения инфекционных осложнений: эпизодов гипертермии (повышение температуры тела более 37,6 0С), повышение уровня лейкоцитов крови > 12 × 109/л, острого деструктивного пиелонефрита, подтверждённого инструментальными методами, и сепсиса, укладывающегося в критерии Динамической оценки органной недостаточности (быстрой) / Quick Sequential Organ Failure Assessment (qSOFA).
Статистический анализ. При анализе количественных данных проведено предварительное тестирование на нормальность распределения с помощью теста Shapiro-Wilk. В случае нормального распределения показатель представлен в виде среднего (M) ± стандартного отклонения (SD), при отклонении от нормального распределения значения представлены в виде медианы (Me) и нижнего / верхнего квартилей — [Q1; Q3]. Категориальные показатели представлены с указанием абсолютных значений (n) и частот / долей (%). При необходимости для каждого показателя проценты рассчитываются как доля субъектов с заданным признаком от общего количества субъектов в исследуемой группе. Для оценивания долей и построения 95% доверительных интервалов (ДИ) к ним используется биномиальный тест. Для анализа вероятности возникновения гипертермии и лейкоцитоза, а также для факторов, влияющих на эту вероятность, использована модель многофакторной логистической регрессии (МЛР). Для оценивания качества модели проведён ROC-анализ. Статистический анализ проводился с использованием программы R version 4.1.3 (“The R Foundation for Statistical Computing”, Vienna, Austria).
Результаты
По результатам анализа возраст пациентов составил 57 [ 44; 66] лет. Гендерное распределение: 93 (44,1%) пациента были женского пола, 118 (55,9%) — мужского пола. Индекс массы тела (ИМТ) — 28,7 [ 25,08; 32,4] кг/м2. Коморбидный фон 26 (12,3%) пациентов был отягощён сахарным диабетом 2 типа. Первичное камнеобразование отмечено у 144 (68,2%) пациентов, у 67 (31,8%) пациентов данная госпитализация осуществлялась по поводу повторного (вторичного) камнеобразования. Максимальный размер камня — 12 [ 9; 17] см3. Объём камня — 0,44 [ 0,15; 1,11] см3. Плотность конкрементов — 1100 [ 803,5; 1337] HU (HU — единицы Hounsfield). Единичный конкремент диагностирован у 89 (42,2%) пациентов, в 48 (22,7%) случаях диагностировано два конкремента, в 33 (15,6%) случаях— 3 конкремента, у 41 (19,4%) пациента дроблению было подвергнуто 4 и более конкрементов.
До оперативного лечения у 43 (20,0%) пациентов ВМП были дренированы. У 31 (14,7%) пациента ВМП были дренированы мочеточниковым стентом, а у 12 (5,7%) пациентов — нефростомическим дренажём.
26 (12,3%) пациентам выполнена контактная уретеролитотрипсия (КУЛТ), 16 (7,6%) пациентам — гибкая уретероскопия с литотрипсией (УРС), 169 (80,1%) пациентам — перкутанная нефролитотомия (ПНЛ) (рис. 2). В 149 (70,6%) случаях оперативное вмешательство проводили под общим эндотрахеальным наркозом, в 55 (26,1%) случаях — под спиномозговой анестезией, в 7 (3,3%) случаях применяли внутривенный наркоз.
155 (73,5%) пациентов имели II степень анестезиолого-операционного риска, 56 (26,5%) — III степень. Медианное время оперативного вмешательства составила 40 [ 30; 50] минут.
Всем пациентам перед оперативными вмешательствами был проведён бактериологический анализ мочи. Первичный стерильный посев мочи диагностирован у 152 (72%) пациентов, тогда как у 59 (28%) [ 22%; 34,5%] пациентов при подготовке к оперативному лечению в посеве мочи была обнаружена бактериурия. Из них у 31 (14,7%) пациента — клинически незначимая бактериурия в титре < 105 КОЕ/м, а у 28 (13,3%) [ 9%; 18,6%] пациентов выявлена клинически значимая бактериурия в титре ≥ 105 КОЕ/мл. При этом доля пациентов с положительным посевом мочи среди пациентов с дренированными мочевыми путями (мочеточниковым стентом или нефростомическим дренажом) составила 34,9% [ 21%; 50,6%] против 26,2% [ 19,7%; 33,5%] у пациентов без дренирования ВМП. Однако данная разница не была статистически значимой (р-значение точного теста Fisher = 0,427).
Среди пациентов с дренированием ВМП мочеточниковым стентом бактериурия в посеве мочи была выявлена у 4 (33%) человек и у 11 (92%) пациентов с нефростомическим дренажём.
Наиболее часто в посеве мочи выявляли Enterococcus faecalis — 18 (8,5%), Escherichia coli — 15 (7,1%), Klebsiella pneumoniae — 8 (3,8%) (табл.).
После антибактериальной терапии пациентов с бактериурией в титре, превышающем ≥ 105 КОЕ/мл, непосредственно перед оперативным лечением у 22 (78,6%) [ 59%; 91,7%] пациентов удалось добиться стерильного посева мочи. После курса антибактериальной терапии бактериурия сохранилась у 6 (22%) пациентов, у 3 (11%) пациентов в клинически значимом титре, ещё у 3 (11%) пациентов — в клинически незначимом титре. Соответственно, 37 (17,5%) [ 12,8%; 23,4%] пациентов после подробной разъяснительной беседы о характере и рисках оперативного вмешательства подверглись эндоскопическому удалению камней мочевых путей, среди которых 3 (8%) пациента с клинически значимой бактериурией и 34 (92%) с клинически незначимой бактериурией.
В послеоперационном периоде лейкоцитоз свыше 12 × 109/л отмечен у 54 (25,6%) пациентов, гипертермия — у 17 (8,1%) пациентов, у 11 (5,2%) пациентов подъём температуры сопровождался лейкоцитозом.
Гипертермия значимо чаще отмечалась у 6 (16,2%) пациентов с бактериурией по сравнению с 11 (6,3%) пациентов со стерильным посевом ОШ [ 95% ДИ] 2,85 [ 0,8; 9,18], (р-значение для точного теста Fisher = 0,087).
У 2 пациентов с клинически значимым посевом в послеоперационном периоде наблюдалась гипертермия. Случаев деструктивного пиелонефрита и сепсиса зарегистрировано не было.
По результатам оценки параметров многофакторной логистической регрессии выявлены статистически значимые связи между вероятностью развития гипертермии и бактериурией непосредственно перед операцией (рис. 3). Положительный посев мочи увеличивает шанс возникновения гипертермии в 4,75 раз (ОШ = 4,75, 95% ДИ [ 1,222; 18,803], р = 0,023). Статистическая значимость связи гипертермии с другими параметрами модели, такими как пол, возраст, ИМТ, наличие сахарного диабета, объём и размер конкремента, различные виды дренирования ВМП, длительность операции, не выявлена (р > 0,05). AUC для ROC кривой составила 0,78, что говорит об удовлетворительном качестве модели.
Статистически значимая связь между бактериурией и дренированием ВМП в данной модели отсутствует (р = 0,427).
По результатам оценки параметров многофакторной логистической регрессии факторами, статистически значимо влияющими на развитие лейкоцитоза, являются объём конкремента (р = 0,008) и дренирование ВМП мочеточниковым стентом (р = 0,006). При этом дренирование ВМП мочеточниковым стентом (ОШ = 0,154, 95% ДИ [ 0,033; 0,512], р = 0,006) снижает шанс возникновения лейкоцитоза, а объём конкремента увеличивает шанс возникновения лейкоцитоза в 1,54 раза (ОШ = 1,543, 95% ДИ [ 1,128; 2,158], р = 0,008). Статистическая значимая связь с развитием лейкоцитоза остальных параметров модели, таких как пол, возраст, ИМТ, сахарный диабет, наличие нефростомического дренажа, положительный посев непосредственно перед операцией, длительность операции, тип операции не выявлена (р > 0,05). AUC для ROC составляет 0,75, что говорит об удовлетворительном качестве модели (рис. 4). Также при анализе данных было показано, что развитие лейкоцитоза > 12 × 109/л увеличивает риск развития гипертермии в 8,57 раз (ОШ = 8,57, 95% ДИ [ 2,63; 32,85], р < 0,001).
Таблица. Возбудители, обнаруженные в первичном посеве мочи перед оперативным лечением
Table. Pathogens detected in the initial urine culture prior to surgery
|
Возбудитель Bacterial pathogen |
Количество пациентов с бактериурией, n (%) Patients with bacteriuria, n (%) |
|
Enterococcus faecalis |
18 (8,5) |
|
Escherichia coli |
15 (7,1) |
|
Klebsiella pneumoniae |
8 (3,8) |
|
Proteus spp. |
7 (3,3) |
|
Pseudomonas aeruginosa |
1 (0,5) |
|
Morganella morganii |
1 (0,5) |
|
Другие Other |
9 (4,3) |
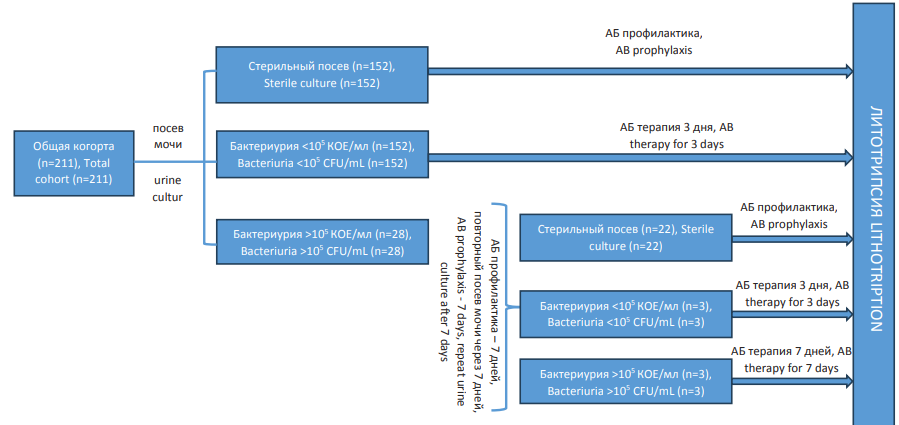
Рисунок 1. Дизайн исследования
Figure 1. Study design
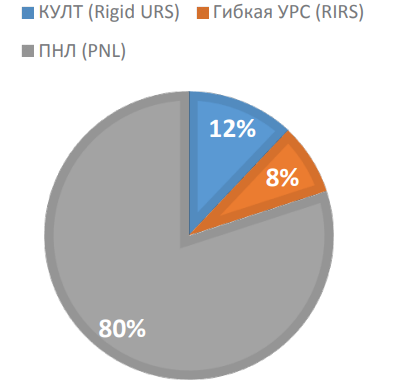
Рисунок 2. Распределение пациентов по типу оперативного вмешательства
Figure 2. Distribution of patients according to the surgery type
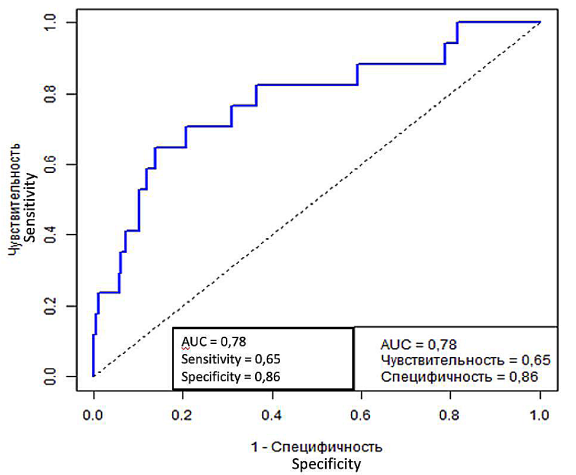
Рисунок 3. ROC-кривая многофакторной логистической регрессии для гипертермии
Figure 3. ROC curve of multivariate logistic regression for hyperthermia
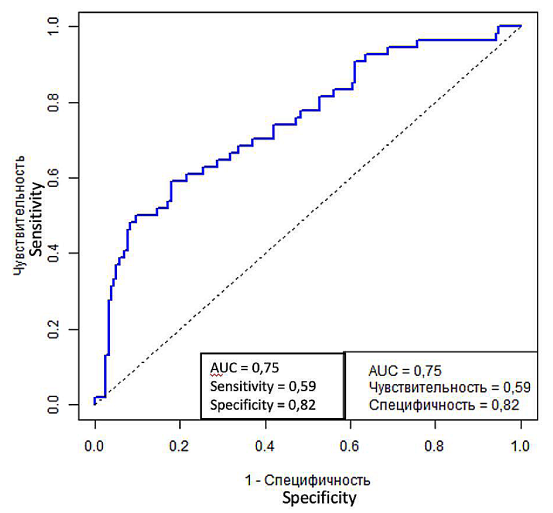
Рисунок 4. ROC-кривая многофакторной логистической регрессии для лейкоцитоза
Figure 4. ROC curve of multivariate logistic regression for leukocytosis
Обсуждение
Согласно результатам мета-анализа, проведённого R. Bapir et al. (2022), возникновение инфекционных осложнений не зависит от выбора вида эндоурологического вмешательства [3]. Было показано, что риск развития острого воспаления остаётся схожим при проведении различных операций, таких как гибкая УРС, стандартная ПНЛ, миниПНЛ и бездренажная ПНЛ. Преимущество в данном аспекте выявлено лишь при использовании аспирационной техники в ходе ПНЛ, что, вероятно, связано с предотвращением избыточного внутрипочечного давления. С другой стороны, рядом авторов были выявлены главные факторы риска инфекционных осложнений [10][21][22], к которым относятся женский пол, лейкоцитурия, лейкоцитоз, высокое нейтрофильно-лимфоцитарное соотношение, мочеточниковый стент, сахарный диабет, размер конкремента, множественные доступы в почку в рамках одной операции, длительность оперативного вмешательства, резидуальные фрагменты, инфекционные камни, положительный посев мочи, положительный посев лоханочной мочи и положительный посев камня. Несмотря на то, что бактериурия является признанным фактором риска развития инфекционных осложнений, современные данные свидетельствуют о том, что значимая часть пациентов с положительным посевом мочи подвергается оперативному лечению. В мультицентровом, ретроспективном исследовании J. Gutierrez et al. (2013) был проведён анализ 5354 пациентов с МКБ после проведения ПНЛ [20]. Так, на этапе предоперационной диагностики у 865 (16,2%) пациентов была выявлена бактериурия по данным посева мочи, где самым частым возбудителем являлась E. coli — 350 (6,5%) пациентов. В послеоперационном периоде гипертермия наблюдалась у 8,8% пациентов с отрицательным посевом и у 18,2% — с положительным. К сожалению, на сегодняшний момент ни один клинический гайдлайн не содержит рекомендаций по алгоритму предоперационной подготовки пациентов с бактериурией, в этой связи решение о возможности выполнения хирургического удаления камня и выбора схемы антибактериальной профилактики принимается каждым хирургом индивидуально. Наличие бактериурии нередко становится причиной отказа пациенту в хирургической операции, поскольку воспринимается урологами как противопоказание к хирургическому вмешательству. В то же самое время появляются работы, преломляющие господствующую парадигму о достаточности однократного назначения антибактериального препарата в рамках профилактики инфекционных осложнений [23] и демонстрирующие более высокую эффективность расширенных (до 7 дней) курсов антибактериальной профилактики в части предотвращения системного воспалительного ответа и сепсиса у пациентов с такими факторами высокого риска инфекционных осложнений, как положительный посев мочи [16-18].
На сегодняшний день в большинстве работ не указываются такие детали, как доли пациентов с клинически значимым посевом и попытки купировать бактериурию путём назначения антибактериальной терапии с последующим культурологическим контролем. В нашем исследовании было показано, что доля пациентов с бактериурией, которые обращаются за хирургической помощью по поводу эндоскопического удаления камней мочевых путей, составляет 28,0%, при этом клинически значимая бактериурия выявляется почти в половине случаев 47,5%. Курс антибактериальной терапии, основанной на результатах посева мочи, позволяет добиться стерильности анализа у 79,0% пациентов, при этом после подобного лечения у 11,0% сохраняется бактериурия в клинически значимом титре. Наряду с этим наше исследование выявило статистически значимую связь между бактериурией и развитием инфекционных осложнений. Примечательно, что статистически достоверной связи между инфекционными осложнениями и другими факторами риска выявлено не было, как и между бактериурией и дренированием мочевых путей, которая наблюдалась у 35,0% против 26,0% у пациентов без дренирования верхних мочевых путей.
Умеренный, сопоставимый с общемировыми показателями показатель развития гипертермии 8,0% в нашем исследовании, наряду с отсутствием случаев деструктивного пиелонефрита, системной воспалительной реакции и сепсиса свидетельствуют об адекватности нашего протокола профилактики инфекционных осложнений, основанного на назначении расширенных схем дифференцированной антибактериальной терапии (7 дней или 3 дня), основанной на клинической значимости бактериурии.
Ограничения исследования. К ограничениям исследования можно отнести его ретроспективный характер, а также невключение пациентов с полирезистентной бактериальной флорой, что ограничивает полученные результаты популяцией пациентов контаминированных негоспитальными штаммами бактерий.
Заключение
Бактериурия является значимым фактором риска инфекционных осложнений, предварительный курс антибактериальной терапии позволяет добиться стерильного посева мочи в подавляющем большинстве случаев. Расширенные курсы антибактериальной профилактики продолжительностью в 7 дней и 3 дня у пациентов соответственно с клинически значимой и клинически незначимой бактериурией представляются адекватными с точки зрения минимизации рисков инфекционных осложнений. Проведение в дальнейшем проспективного рандомизированного исследования, с включением пациентов с полирезистентной бактериальной флорой позволит расширить полученные результаты и возможно сформировать новые протоколы лечения пациентов данной категории.
Ключевые моменты:
- положительный посев мочи увеличивает шанс возникновения гипертермии в 4,75 раз;
- факторами, влияющими на развитие лейкоцитоза, являлись такие переменные, как объём конкремента и дренирование верхних мочевых путей мочеточниковым стентом;
- объём конкремента увеличивает шанс возникновения лейкоцитоза в 1,54 раза при увеличении на 1 см3;
- расширенные курсы антибактериальной профилактики продолжительностью в 7 и 3 дня у пациентов соответственно с клинически значимой и клинически незначимой бактериурией представляются адекватными, с точки зрения минимизации рисков инфекционных осложнений.
Список литературы
1. Gadzhiev N, Prosyannikov M, Malkhasyan V, Akopyan G, Somani B, Sivkov A, Apolikhin O, Kaprin A. Urolithiasis prevalence in the Russian Federation: analysis of trends over a 15-year period. World J Urol. 2021;39(10):3939-3944. DOI: 10.1007/s00345-021-03729-y
2. Ghani KR, Roghmann F, Sammon JD, Trudeau V, Sukumar S, Rahbar H, Kumar R, Karakiewicz PI, Peabody JO, Menon M, Sun M, Trinh QD. Emergency department visits in the United States for upper urinary tract stones: trends in hospitalization and charges. J Urol. 2014;191(1):90-96. DOI: 10.1016/j.juro.2013.07.098
3. Bapir R, Bhatti KH, Eliwa A, García-Perdomo HA, Gherabi N, Hennessey D, Mourmouris P, Ouattara A, Perletti G, Philipraj J, Trinchieri A, Buchholz N. Infectious complications of endourological treatment of kidney stones: A metaanalysis of randomized clinical trials. Arch Ital Urol Androl. 2022;94(1):97-106. DOI: 10.4081/aiua.2022.1.97
4. Seitz C, Desai M, Häcker A, Hakenberg OW, Liatsikos E, Nagele U, Tolley D. Incidence, prevention, and management of complications following percutaneous nephrolitholapaxy. Eur Urol. 2012;61(1):146-158. DOI: 10.1016/j.eururo.2011.09.016
5. Dybowski B, Bres-Niewada E, Rzeszutko M, Tkaczyk A, Woźniak B, Wójcik M, Znajdek Z. Risk factors for infectious complications after retrograde intrarenal surgery - a systematic review and narrative synthesis. Cent European J Urol. 2021;74(3):437-445. DOI: 10.5173/ceju.2021.250
6. Senocak C, Ozcan C, Sahin T, Yilmaz G, Ozyuvali E, Sarikaya S, Resorlu B, Oguz U, Bozkurt OF, Unsal A, Adsan O. Risk Factors of Infectious Complications after Flexible Ureterorenoscopy with Laser Lithotripsy. Urol J. 2018;15(4):158-163. DOI: 10.22037/uj.v0i0.3967
7. Kreydin EI, Eisner BH. Risk factors for sepsis after percutaneous renal stone surgery. Nat Rev Urol. 2013;10(10):598-605. DOI: 10.1038/nrurol.2013.183
8. Li T, Sun XZ, Lai DH, Li X, He YZ. Fever and systemic inflammatory response syndrome after retrograde intrarenal surgery: Risk factors and predictive model. Kaohsiung J Med Sci. 2018;34(7):400-408. DOI: 10.1016/j.kjms.2018.01.002
9. Mi Q, Meng X, Meng L, Chen D, Fang S. Risk Factors for Systemic Inflammatory Response Syndrome Induced by Flexible Ureteroscope Combined with Holmium Laser Lithotripsy. Biomed Res Int. 2020;2020:6842479. DOI: 10.1155/2020/6842479
10. Chen Y, Wen Y, Yu Q, Duan X, Wu W, Zeng G. Percutaneous nephrolithotomy versus flexible ureteroscopic lithotripsy in the treatment of upper urinary tract stones: a metaanalysis comparing clinical efficacy and safety. BMC Urol. 2020;20(1):109. DOI: 10.1186/s12894-020-00677-4
11. Zhou G, Zhou Y, Chen R, Wang D, Zhou S, Zhong J, Zhao Y, Wan C, Yang B, Xu J, Geng E, Li G, Huang Y, Liu H, Liu J. The influencing factors of infectious complications after percutaneous nephrolithotomy: a systematic review and meta-analysis. Urolithiasis. 2022;51(1):17. DOI: 10.1007/s00240-022-01376-5
12. Российское общество урологов. Клинические рекомендации «Мочекаменная болезнь». 2020.
13. European Association of Urology. Guidelines on Urolithiasis. 2023. https://uroweb.org/guidelines/urolithiasis
14. Assimos D, Krambeck A, Miller NL, Monga M, Murad MH, Nelson CP, Pace KT, Pais VM Jr, Pearle MS, Preminger GM, Razvi H, Shah O, Matlaga BR. Surgical Management of Stones: American Urological Association/Endourological Society Guideline, PART I. J Urol. 2016;196(4):1153-1160. DOI: 10.1016/j.juro.2016.05.090
15. Wolf JS Jr, Bennett CJ, Dmochowski RR, Hollenbeck BK, Pearle MS, Schaeffer AJ; Urologic Surgery Antimicrobial Prophylaxis Best Practice Policy Panel. Best practice policy statement on urologic surgery antimicrobial prophylaxis. J Urol. 2008;179(4):1379-1390. Erratum in: J Urol. 2008;180(5):2262-2263. PMID: 18280509. DOI: 10.1016/j.juro.2008.01.068
16. Yu J, Guo B, Yu J, Chen T, Han X, Niu Q, Xu S, Guo Z, Shi Q, Peng X, Deng Z, Yang P. Antibiotic prophylaxis in perioperative period of percutaneous nephrolithotomy: a systematic review and meta-analysis of comparative studies. World J Urol. 2020;38(7):1685-1700. DOI: 10.1007/s00345-019-02967-5
17. Sur RL, Krambeck AE, Large T, Bechis SK, Friedlander DF, Monga M, Hsi RS, Miller NL, Chew BH, Lange D, Knudsen B, Sourial MW, Humphreys MR, Stern KL, Shah O, Abbott JE, Abedi G. A Randomized Controlled Trial of Preoperative Prophylactic Antibiotics for Percutaneous Nephrolithotomy in Moderate to High Infectious Risk Population: A Report from the EDGE Consortium. J Urol. 2021;205(5):1379-1386. DOI: 10.1097/JU.0000000000001582
18. Jung HD, Cho KS, Moon YJ, Chung DY, Kang DH, Lee JY. Antibiotic prophylaxis for percutaneous nephrolithotomy: An updated systematic review and meta-analysis. PLoS One. 2022;17(4):e0267233. DOI: 10.1371/journal.pone.0267233
19. Xu P, Zhang S, Zhang Y, Zeng T, Chen D, Wu W, Tiselius HG, Li S, Huang J, Zeng G, Wu W. Preoperative antibiotic therapy exceeding 7 days can minimize infectious complications after percutaneous nephrolithotomy in patients with positive urine culture. World J Urol. 2022;40(1):193-199. DOI: 10.1007/s00345-021-03834-y
20. Gutierrez J, Smith A, Geavlete P, Shah H, Kural AR, de Sio M, Amón Sesmero JH, Hoznek A, de la Rosette J; CROES PCNL Study Group. Urinary tract infections and post-operative fever in percutaneous nephrolithotomy. World J Urol. 2013;31(5):1135-1140. DOI: 10.1007/s00345-012-0836-y
21. Bhojani N, Miller LE, Bhattacharyya S, Cutone B, Chew BH. Risk Factors for Urosepsis After Ureteroscopy for Stone Disease: A Systematic Review with Meta-Analysis. J Endourol. 2021;35(7):991-1000. DOI: 10.1089/end.2020.1133
22. Wang F, Hong Y, Yang Z, Ye L. Comparison of retrograde intrarenal surgery and standard percutaneous nephrolithotomy for management of stones at ureteropelvic junction with high-grade hydronephrosis. Sci Rep. 2021;11(1):14050. DOI: 10.1038/s41598-021-93551-8
23. Chew BH, Miller NL, Abbott JE, Lange D, Humphreys MR, Pais VM Jr, Monga M, Krambeck AE, Sur RL. A Randomized Controlled Trial of Preoperative Prophylactic Antibiotics Prior to Percutaneous Nephrolithotomy in a Low Infectious Risk Population: A Report from the EDGE Consortium. J Urol. 2018;200(4):801-808. DOI: 10.1016/j.juro.2018.04.062
Об авторах
В. А. МалхасянРоссия
Виген Андреевич Малхасян — д-р мед. наук, профессор кафедры урологии; заведующий урологическим отделением № 67
Москва
Н. К. Гаджиев
Россия
Нариман Казиханович Гаджиев — д-р мед. наук; заместитель директора по медицинской части (урология)
Санкт-Петербург
С. О. Сухих
Россия
Сергей Олегович Сухих — канд. мед. наук; врач-уролог урологического отделения № 67
Москва
Е. Г. Мальцев
Россия
Егор Георгиевич Мальцев — врач-уролог клинико-диагностического отделения
Москва
И. З. Киндаров
Россия
Ислам Заурович Киндаров — ординатор кафедры урологии
Москва
Д. Ю. Пушкарь
Россия
Дмитрий Юрьевич Пушкарь — д-р мед. наук, профессор, акад. РАН; заведующий кафедрой урологии; руководитель Московского урологического центра
Москва
Рецензия
Для цитирования:
Малхасян В.А., Гаджиев Н.К., Сухих С.О., Мальцев Е.Г., Киндаров И.З., Пушкарь Д.Ю. Эндоскопическое удаление камней мочевых путей у пациентов с бессимптомной бактериурией. Вестник урологии. 2024;12(1):69-79. https://doi.org/10.21886/2308-6424-2024-12-1-69-79
For citation:
Malkhasyan V.A., Gadzhiev N.K., Sukhikh S.O., Maltsev E.G., Kindarov I.Z., Pushkar D.Yu. Endoscopic stone surgery in patients having asymptomatic bacteriuria. Urology Herald. 2024;12(1):69-79. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-1-69-79













































