Перейти к:
Таргетное исследование свежезамороженных срезов для определения статуса хирургического края при выполнении радикальной простатэктомии
https://doi.org/10.21886/2308-6424-2023-11-3-44-53
Аннотация
Введение. Радикальная простатэктомия (РПЭ) — «золотой стандарт» лечения пациентов с раком предстательной железы (РПЖ). Одним из активно изучаемых предикторов биохимического рецидива является наличие положительного хирургического края (ПХК).
Цель исследования. Разработать и первично оценить методики таргетного (прицельного) срочного интраоперационного гистологического исследования свежезамороженных срезов при выполнении радикальной простатэктомии.
Материалы и методы. В Университетской клинике урологии РНИМУ им. Н.И. Пирогова на базе ГКБ № 1 им. Н.И. Пирогова проведено проспективное клиническое исследование по исследованию свежезамороженных срезов во время выполнения РПЭ. В период с февраля 2021 года по апрель 2022 года в исследование включено 112 пациентов с диагнозом РПЖ, которым одним хирургом была выполнена лапароскопическая РПЭ (экстра- и трансперитонеальным доступами). В группу А (62 человека) вошли пациенты, которым на основании предоперационных данных (МРТ, FUSION биопсия) выполнено интраоперационное исследование свежезамороженных срезов. Группа Б (50 человек) — контрольная группа (ретроспективная), в которую вошли пациенты со стандартным выполнением РПЭ без срочного гистологического исследования.
Результаты. Онкологический процесс в макропрепаратах, полученных при выполнении cito гистологии, был обнаружен у 42 (67,7%) пациентов, первично ПХК — у 12 (19,4%). В группе Б (контрольная группа, без выполнения cito гистологии) ПХК выявлен в 7 (14%) случаях. Миграция статуса ХК из первично негативно в окончательно позитивный установлена у 2 (3,3%) пациентов и, напротив, из первично положительного в отрицательный ХК — у 2 (3,3%). Истинно негативный ХК определён у 48 из 50 пациентов, а истинно положительный ХК — у 10 из 12. Таким образом, специфичность и чувствительность методики составили 96,1% и 83,3% соответственно. Среднее время выполнения срочного гистологического исследования составило 24 минуты.
Заключение. Полученные результаты указывают на эффективность и целесообразность использования таргетного (прицельного) cito-гистологического исследования во время выполнения РПЭ.
Для цитирования:
Котов С.В., Бядретдинов И.Ш., Гуспанов Р.И., Пульбере С.А., Юсуфов А.Г. Таргетное исследование свежезамороженных срезов для определения статуса хирургического края при выполнении радикальной простатэктомии. Вестник урологии. 2023;11(3):44-53. https://doi.org/10.21886/2308-6424-2023-11-3-44-53
For citation:
Kotov S.V., Byadretdinov I.Sh., Guspanov R.I., Pulbere S.A., Yusufov A.G. Target urgent study of fresh frozen sections to define the surgical margin status during radical prostatectomy. Urology Herald. 2023;11(3):44-53. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-3-44-53
Введение
Радикальная простатэктомия (РПЭ) — «золотой стандарт» лечения пациентов с раком предстательной железы (РПЖ) [1 – 3]. Определение и разработка предикторов развития биохимического рецидива (БР) является одной из основополагающих задач, решение которой необходимо для достижения максимально эффективного лечения РПЖ. Одним из активно изучаемых предикторов БР является наличие положительного хирургического края (ПХК). За последние десятилетия прогностические возможности значительно расширились, и клиницисты получили многочисленные инструменты, направленные на создание алгоритмов лечения и определения объёма оперативного вмешательства. Однако, несмотря на свою ценность, эти инструменты не являются «идеальными» и обладают определённой погрешностью.
В настоящее время актуальным направлением в хирургическом лечении РПЖ является разработка методов интраоперационного определения статуса хирургического края (ХК), способных повысить эффективность лечения. В последние годы было предложено множество методов интраоперационной оценки статуса ХК. К ним можно отнести использование аминолевулиновой кислоты, оптическую когерентную томографию, оптическую спектроскопию, конфокальную лазерную микроскопию, 3D-дополненную реальность и прочие [4]. Наиболее зарекомендованным способом на данный момент является исследование свежезамороженных срезов. При этом преимущественно описанные методики исследования свежезамороженных срезов выполняются для определения статуса ХК в определённых зонах предстательной железы (верхушка, заднелатеральная поверхность и так далее) без учёта персонифицированного подхода. В большинстве случаев необходим забор большого объёма операционного материала. Данное обстоятельство, несомненно, влияет как на длительность, так и на экономическую целесообразность выполнения интраоперационного гистологического исследования.
Цель исследования. Разработка и первичная оценка методики таргетного (прицельного) срочного интраоперационного гистологического исследования свежезамороженных срезов при выполнении радикальной простатэктомии.
Материалы и методы
В Университетской клинике урологии РНИМУ им. Н. И. Пирогова на базе ГКБ № 1 им. Н. И. Пирогова проведено проспективное клиническое исследование по исследованию свежезамороженных срезов во время выполнения РПЭ. В период с февраля 2021 года по апрель 2022 года в исследование включено 112 пациентов с диагнозом РПЖ, которым одним хирургом была выполнена лапароскопическая РПЭ.
В группу А (62 человека) вошли пациенты, которым на основании предоперационных данных (МРТ, FUSION биопсия) выполнено интраоперационное исследование свежезамороженных срезов. Группа Б / контрольная группа (50 человек), в которую вошли пациенты со выполнением РПЭ без срочного гистологического исследования. Критериями включения в экспериментальную группу являлись наличие очага PIRADS 3 – 5 в периферической зоне согласно картированию предстательной железы (27 зон)) на МРТ органов малого таза, объём верифицированного онкологического очага > 1 см³, расстояние от патологического очага до капсулы предстательной железы 1 см и менее.
Расширенную тазовую лимфодиссекцию и нервосберегающую технику выполняли исходя из предоперационных данных (клиническая стадия, номограмма Briganti 2012, опросник IIEF-5, желание пациента).
Алгоритм исследования.
- Согласно данным МРТ органов малого таза с внутривенным контрастированием и результатам пальцевого ректального исследования производили FUSION биопсию предстательной железы.
- По данным заключения FUSION биопсии формировали отчёт о локализации и объёме поражения простаты (кол-во поражённых биоптатов в каждой зоне).
- Интраоперационно, после удаления предстательной железы, на предметном столе производили визуальный осмотр и пальпацию предстательной железы на наличие уплотнённых очагов. Учитывая данные визуального осмотра, пальпации, данных МРТ и заключения FUSION биопсии предстательной железы, определяли зону наиболее вероятного наличия онкологического процесса.
- Производили лигирование препарата в зоне подозрительной области. Прошивание выполняли таким образом, чтобы лигатура была в центре предполагаемого клиновидного среза. Количество накладываемых швов пропорционально объёму подозрительного очага. При размере очага более 2 см³ выполняли наложение двухузловых швов, при размере очага более 3 см³ — наложение трёхузловых швов и так далее.
- После наложение лигатур(ы) препарат направляли в патологоанатомическое отделение. После окрашивания препарата производили нарезку интересуемых зон с помощью клиновидного иссечения. Основание клиновидного среза представляет собой прямоугольник длиной не более 1,5 см и шириной не более 1 см. Высота, проведённая от центра основания (зона наложения лигатуры) до вершины треугольника, составляет не более 1,5 см. Данные параметры обусловлены оптимальным размером необходимым для замораживания срезов в криостате.
- Полученные в ходе нарезки макропрепараты нумеровали и отправляли в криостат, где выполнялась заморозка (-27 °С). После чего производили нарезку макропрепаратов на микропрепараты толщиной 7 – 9 мкм. Далее микропрепараты фиксировали на предметном стекле и окрашивали гематоксилином-эозином.
- Окрашенные микропрепараты направляли патологоанатому для микроскопического исследования:
- оценка поражения полученных образцов по шкале Gleason;
- оценка статуса хирургического края;
- наличие экстракапсулярной инвазии;
- оценка периневральной, эндоваскулярной, эндолимфатической инвазии.
Полученную информацию врач-патологоанатом передавал оперирующему хирургу. При наличии ПХК хирург выполнял иссечение сосудисто-нервной ножки поражённой стороны (при использовании нервосберегающей техники), при наличии отрицательного ХК хирург заканчивал оперативное вмешательство по стандартной технике.
Срочные гистологические и окончательные гистологическое исследования всех удалённых препаратов проводили в патологоанатомическом отделении ГКБ № 1 им. Н.И. Пирогова одним патологоанатомом. Наличие опухолевой ткани в окрашенном крае резекции трактовалось как ПХК. Краткие шаги по выполнению исследованию свежезамороженных срезов представлены на рисунке 1.
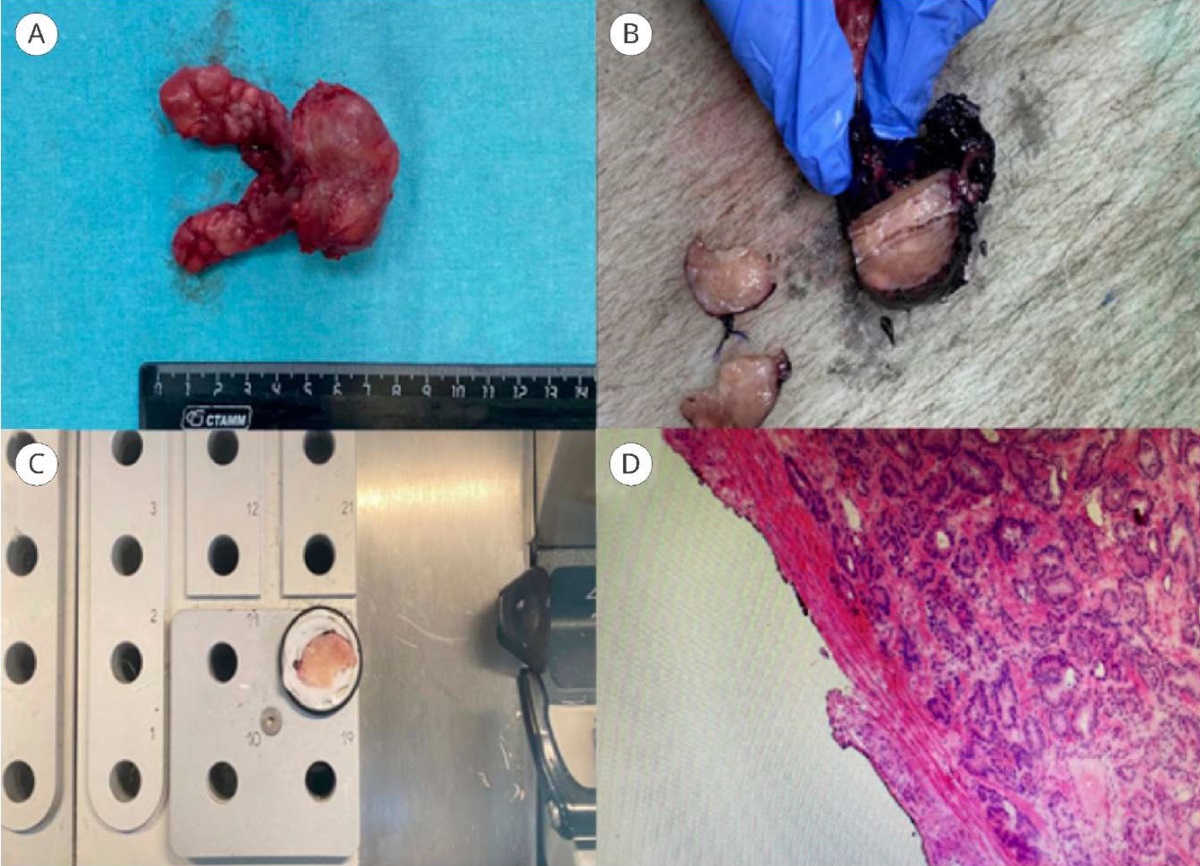
Рисунок 1. Исследование свежезамороженных срезов:
A — удалённый макропрепарат;
B — клиновидное срез интересуемой зоны;
C — нарезка препарата в криотоме;
D — ацинарная аденокарцинома Gleason 6 (3 + 3),
хирургический край отрицательный.
Ув. × 40
Figure 1. Histological examination of fresh frozen sections:
A — Removed prostate;
B — Wedge-shaped section of prostate;
C — Cutting in cryotome;
D — Acinar adenocarcinoma Gleason 6 (3 + 3),
the surgical margin is negative.
Magn. × 40
Статистический анализ. Организацию и статистическую обработку данных выполняли с использованием «Microsoft Office Excel 2016» («Microsoft Corp.», Redmond, WA, USA) и пакета прикладных программ «IBM SPSS Statistics ver. 17» («SPSS: An IBM Company», IBM SPSS Corp., Armonk, NY, USA). Все полученные анамнестические, клинические, лабораторные и инструментальные данные вносили в базу данных «Microsoft Office Excel», разработанную автором, и обрабатывали методом вариационной статистики. Для проверки статистических гипотез о виде распределения был применен критерий Колмогорова-Смирнова. Для количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (M) и стандартное отклонение (SD), которые были представлены в виде M ± SD. Если количественные данные не подчинялись закону нормального распределения, для их описания применяли медиану (Me) а также нижний и верхний квартиль [Q1; Q3]. Для сравнения числовых данных c нормальным распределением использовали t-критерий Student для двух независимых выборок, для сравнения числовых данных при ненормальном распределении — критерий Mann-Whitney. Сравнение двух независимых групп по качественным признакам производили с использованием критерия хи-квадрат Pearson (χ²). Статистически значимыми считали отличия при p < 0,05 (95%-й уровень значимости).
Результаты
Краткие предоперационные данные пациентов представлены в таблице 1.
Таблица 1. Предоперационная характеристика пациентов
Table 1. Preoperative characteristics of patients
Параметры Characteristics | Группа А Group A | Группа Б Group B | p |
Средний возраст, лет Mean age, years | 63,9 ± 3,9 | 63,9 ± 4,1 | > 0,05 |
ПСА, нг/мл PSA, ng/ml | 11,86 [ 4,7; 23,1] | 7,9 [ 3,5; 15,3] | < 0,05 |
Объём простаты, см³ Prostate volume, cc | 44 [ 38; 81,1] | 52,6 [ 29,3; 72,4] | < 0,05 |
МИЭФ-5, баллы IIEF-5 score | 17 [ 8,4; 21,1] | 16,4 [ 9,3; 23,2] | > 0,05 |
cT стадия, n (%) cT stage, n (%) | |||
Т1с | 28 (45) | 26 (52) | — |
Т2а – T3b | 34 (55) | 24 (48) | |
Классификация D’Amico, n (%) D'amico classification, n (%) | |||
Низкий риск | Low risk | 24 (38) | 24 (48) | — |
Промежуточный риск | Intermediate risk | 18 (30) | 12 (24) | |
Высокий риск | High risk | 20 (32) | 14 (28) | |
Gleason баллы, n (%) Gleason score, n (%) | |||
6 (3 + 3) | 39 (63) | 41 (82) | — |
7 (3 + 4) | 13 (21) | 6 (12) | |
7 (4 + 3) | 4 (6) | 2 (4) | |
8 (4 + 4) | 6 (10) | — | |
9 (4 + 5) | — | 1 (2) | |
Примечание. ПСА — простатспецифический антиген;
МИЭФ — Международный индекс эректильной функции
Note. PSA — prostate-specific antigen;
IIEF — International Index of Erectile Function
Основные результаты, полученные нами в работе, представлены в таблице 2.
Таблица 2. Результаты исследования свежезамороженных срезов
Table 2. Results of the study of fresh frozen sections
Показатели Characteristics | Группа А Group A |
Наличие онкологического процесса в макропрепарате (cito), n (%) Сancer cito samples, n (%) | 42 (67,7) |
Положительный ХК (cito), n (%) Positive SM (cito), n (%) | 12 (19,4) |
Наличие онкологического процесса во вторично иссечённой ткани, n (%) Cancer process in secondary neurovascular bundle resection, n (%) | 2 (3,3) |
Миграция статуса ХК из негативного в положительный, n (%) Migration of SM from negative to positive, n (%) | 2 (3,3) |
Миграция статуса ХК из положительного в отрицательный, n (%) Migration of SM from positive to negative, n (%) | 2 (3,3) |
Чувствительность метода (истинно положительный ХК), % Sensitivity (true positive), % | 83,3 (10 из | from 12) |
Специфичность метода (истинно негативный ХК), % Specificity (true negative), % | 96,1 (48 из | from 50) |
Средняя время cito гистологии, мин Average time of cito-histology, min | 27 |
Примечание. ХК — хирургический край
Note. SM — surgical margin
Наличие онкологического процесса в макропрепаратах, полученных при выполнении cito гистологии, было найдено у 42 (67,7%) пациентов. При этом у пациентов, кому была выполнена РПЭ с использованием нервосберегающей техники, онкологический процесс выявлен в 18 (81,8%) случаях. Первично ПХК обнаружен у 12 (19,4%) пациентов. В группе Б (контрольная группа, без выполнения cito гистологии) ПХК обнаружен у 7 (14%) пациентов. Стоит отметить, что в группу А было включено больше пациентов с высоким риском прогрессии (32% против 28%).
Миграция статуса ХК из первично негативно в окончательно позитивный обнаружена у 2 (3,3%) пациентов, что обусловлено прицельным взятием интересуемой зоны, а не всей поверхности простаты. Миграция статуса ХК из первично положительного в отрицательный обнаружена в 2 (3,3%) случаях. У данных пациентов было подтверждено наличие онкологического процесса во вторично иссечённой ткани. Специфичность методики (истинно негативный край) составила 96% (48 из 50) пациентов, а чувствительность (истинно положительный край) — 83,3% (10 из 12).
Среднее время выполнения методики срочного гистологического исследования от момента извлечения предстательной железы до получения информации о статусе ХК составило 24 минуты для 1 среза; 27 минут — для 2 срезов; 30 минут — для исследования 3 срезов. Время оперативного вмешательства и кровопотеря в группах А и Б статистически не различались.
Приводим клинический пример выполнения предлагаемого способа.
Больной П., 54 года. Жалобы на учащённое мочеиспускание, ноктурию до 2 – 3 раз. При обследовании в поликлинике по месту жительства выявлено повышение общего уровня ПСА крови до 6,15 нг/мл. По результатам МРТ органов малого таза в периферической зоне слева (4 – 6 часов условного циферблата), на уровне средней трети определяется очаг размером 13 × 11 × 9 мм, прилегающей к капсуле железы, без достоверного наличия экстракапсулярной инвазии (PIRADS 4) (рис. 2).
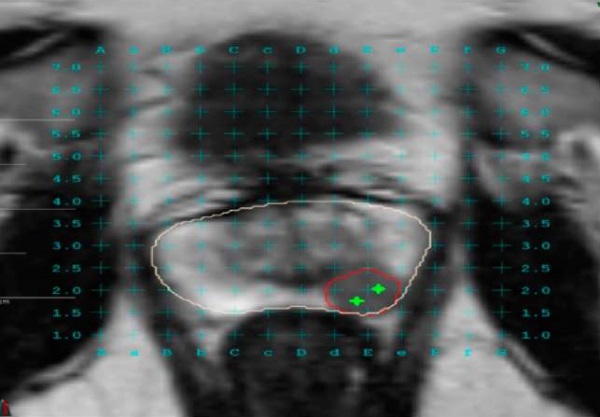
Рисунок 2. МРТ изображение
с наложенными контурами предстательной железы (бежевый),
подозрительного очага (красный) и таргетными биоптатами (зелёный)
Figure 2. MRI scan with superimposed contours of prostate (beige),
suspicious focus (red) and targeted biopsy specimens (green)
Данных о наличии регионарной лимфаденопатии не получено. Объём предстательной железы — 45 см³. IPSS — 3 балла, МИЭФ-5 — 23 балла. По данным пальцевого ректального исследования, простата умеренно увеличена, плотно-эластичной консистенции, симметричная, с чёткими контурами, без очагов уплотнения. Пациенту выполнена FUSION биопсия предстательной железы. Во время выполнения FUSION биопсии выполнено 14 вколов (2 таргетных, прицельных и 12 системных). По данным гистологического заключения, в 2 из 2 таргетных биоптатах слева (в зонах 12р и 10р на рис. 3) обнаружена ацинарная аденокарцинома Gleason 7 (3 + 4). Достоверного наличия онкологического процесса в системных биоптатах не получено. С пациентом проведена беседа о возможных способах лечения. Принято решение о проведение хирургического вмешательства в объёме лапароскопической РПЭ с техникой нервосбережения.
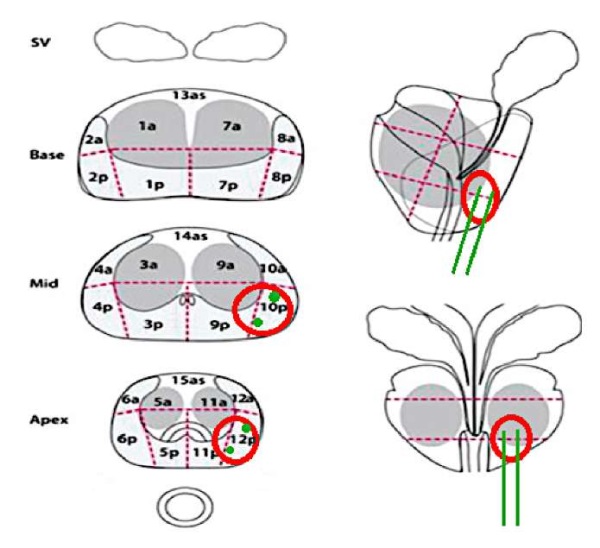
Рисунок 3. Картирование предстательной железы (27 зон)
с наложением контуров FUSION биопсии.
Красным цветом обозначены основные зоны поражения — 10р и 12р,
объём очага > 1 см³, расстояние до капсулы < 1 см;
зелёным цветом отмечены места вколов
Figure 3. Prostate mapping (27 zones) with superimposed contours of FUSION biopsy.
The main affected areas are marked (red) — 10p and 12p, the focus volume is > 1 cm³,
the distance to the capsule is < 1 cm; biopsy cores are marked in green
Пациент был госпитализирован в отделение урологии ГКБ № 1, где ему было проведено плановое оперативное вмешательство — лапароскопическая РПЭ с техникой нервосбережения по предложенной методике. После удаления предстательная железа с семенными пузырьками помещена на предметный столик. Учитывая визуальный осмотр, пальпацию подозрительных очагов, предоперационные данные (МРТ и данные FUSION биопсии) было проведено лигирование левой заднебоковой зоны предстательной железы (12р и 10р). Препарат отправлен к патологоанатому, где был исследован по вышеописанной методике. По результатам срочной гистологии в образце № 1 (зона 10р), была обнаружена ацинарная аденокарцинома Gleason 7 (3 + 4) без признаков экстракапсулярной инвазии, ХК положительный; в образце № 2 (зона 12р) была обнаружена доброкачественная гиперплазия предстательной железы, без признаков онкологического процесса. В связи с наличием ПХК в образце № 1 хирургом выполнено иссечение области прилегания сосудисто-нервного пучка слева. Препарат отправлен на плановое гистологическое исследование, где были обнаружены микрофокусы ацинарной аденокарциномы Gleason 7 (3 + 4).
Послеоперационный период протекал без особенностей. Проводилась противовоспалительная и симптоматическая терапия. Страховой дренаж удалён на 1-е сутки после операции. На 5-е сутки выполнена ретроградная цистография, признаков экстравазации контрастного препарата в области уретро-везикального анастомоза не выявлено, уретральный катетер удалён, самостоятельное мочеиспускание восстановлено. Достигнута полная континенция.
По данным окончательного гистологического заключения, в левой доле определяется ацинарная аденокарцинома Gleason 7 (3 + 4), занимающая около 35% от общего объёма доли, в правой доле — ацинарная аденокарцинома Gleason 6 (3 + 3), занимающая около 10% от общего объёма доли. Данных о наличии экстракапсулярной, периневральной, эндоваскулярной, эндолимфатической инвазии не получено. Хирургический край отрицательный. Окончательная гистологическая стадия по ТNM — pT2cN0M0R0 Gleason 7 (3 + 4), ISUP 2.
Обсуждение
В настоящее время опубликовано значительное количество работ, посвящённых исследованию свежезамороженных срезов при выполнении РПЭ [5 – 7]. В 2011 году А.В. Медведев и соавт. опубликовали работу, посвящённую интраоперационной иммуноморфологической оценке ХК при РПЭ [8]. В исследование были включены 65 пациентов, которым интраоперационно выполнено экспресс-ИГХ исследования криостатных срезов краёв резекции перепончатой уретры и шейки мочевого пузыря. После морфологического экспресс-исследования тканевых срезов производили ИГХ-окрашивание по методике U. Kammerer и P. Ruck в собственной модификации, позволяющей получить результат через 10 – 12 минут. Исследование показало целесообразность интраоперационного анализа оценки состояния ХК с целью повышения достоверности диагностики и раннего прогнозирования биохимического рецидива, но в данной работе проводилась оценка только апикальной и базальной поверхности предстательной железы.
Е.А. Соколов и соавт. (2019) опубликовали данные по интраоперационному исследованию свежезамороженных срезов участков, прилегающих к сосудисто-нервному пучку при выполнении робот-ассистированной РПЭ [9]. В основную группу вошли 10 пациентов. Несмотря на большую распространённость экстракапсулярной экстензии в группе исследования (30%), ни в одном случае при использовании методики срочного гистологического исследования вовремя нервосберегающей РПЭ не было выявлено положительного ХК, при этом во всех случаях последующее окончательное гистологическое исследование препарата подтвердило интраоперационные данные. Оценка результатов интраоперационного гистологического исследования замороженных срезов участков предстательной железы, прилегающих к сосудисто-нервному пучку, демонстрировала снижение частоты позитивных хирургических краёв и указывала на потенциальную целесообразность дальнейшего клинического применения методики.
Наиболее зарекомендованным методом в настоящий момент является техника NeuroSAFE (и её модификации), предложенная Т. Schlomm et al. в 2012 году [10]. Протокол исследования свежезамороженного участка, прилегающего к сосудисто-нервной структуре (NeuroSAFE), был разработан в The Martini-Klinik – Prostate Cancer Centre (Hamburg, Germany) и в последующем валидизирован собственной когортой пациентов. Авторы предоставили данные о 11 069 случаях открытых и робот-ассистированных простатэктомий, выполненных с использованием NeuroSAFE. Они сообщили об увеличении общего количества нервосберегающих простатэктомий с 81% до 97%. Число ПХК снизилось с 22% до 15% среди всех клинический стадий. Эта методика продемонстрировала высокую чувствительность и специфичность — 93,5% и 98,8% соответственно.
В опубликованных работах В. Beyer et al. (2014) и G. Mirmilstein et al. (2018) сообщается, что применение NeuroSAFE позволило снизить частоту ПХК (с 24% до 16% и с 17,8% до 9,2% соответственно). Помимо этого, методика позволила увеличить число нервосберегающих простатэктомий (с 81% до 97% и с 69,0% до 75,1% соответственно) [11][12].
Несмотря на поученные результаты, опубликован ряд работ, в которых показано, что достижение отрицательного ХК при использовании методов свежезамороженных срезов в проекции заднебоковой поверхности предстательной железы не оказывает существенного влияния на безрецидивную выживаемость [13]. Недостатком NeuroSAFE является необходимость параллельного использования большого количества дорогостоящего оборудования (5 криостатов), привлечения двух патологоанатомов и четырёх лаборантов что, несомненно, ведёт к увеличению финансовых затрат. Помимо этого, отсутствие критериев к отбору пациентов (место наиболее вероятной экстракапсулярной экстензии) также может привести к необоснованным временным и экономическим затратам.
Результаты нашего исследования во многом сопоставимы с общемировыми и демонстрируют целесообразность проведения таргетного (прицельного) cito-гистологического исследования во время выполнения РПЭ. Ограничением нашей работы является высокая гетерогенность группы пациентов. В первую очередь исследование было направлено на инициальную оценку чувствительности и специфичности метода. Так, только у 2 (3,3%) пациентов выявлена миграция статуса ХК из первично негативного в положительный. Это отражает высокую эффективность отбора пациентов на основании предоперационного исследования МРТ, FUSION биопсии, а также картирования предполагаемой зоны иссечения. У 2 (3,3%) пациентов выявлена миграция статуса ХК из первично положительного в негативный. Возможным объяснением этой находке является так называемый ятрогенный ХК и обусловлен диссекцией «по опухоли», либо недостаточным предоперационным обследованием. Несмотря на это специфичность и чувствительность методики составили 96,0% и 83,3% соответственно. Необходимо дальнейшее исследование с большей выборки пациентов, которым планируется выполнение РПЭ с использованием нервосберегающей техники. Основополагающей проблемой использования cito гистологического исследования является дискутабельные результаты в отношении отдалённых онкологических результатов. Разнородность подходов предложенных техник, отсутствие проспективных рандомизированных научных работ в настоящее время не позволяют достоверно ответить на этот вопрос о том, что подталкивает на дальнейшее изучение данной проблемы.
Заключение
Полученные первичные результаты использования таргетного исследования свежезамороженных срезов во время выполнения РПЭ указывают на её эффективность и целесообразность. Относительная лёгкость и экономическая доступность описанной методики позволяет использовать данный подход в большинстве онкоурологических центрах без привлечения дополнительных кадровых и финансовых затрат. Необходимы дальнейшие проспективные исследования для оценки отдалённых онкологических результатов.
Список литературы
1. Holmberg L, Bill-Axelson A, Steineck G, Garmo H, Palmgren J, Johansson E, Adami HO, Johansson JE. Results from the Scandinavian Prostate Cancer Group Trial Number 4: a randomized controlled trial of radical prostatectomy versus watchful waiting. J Natl Cancer Inst Monogr. 2012;2012(45):230-3. DOI: 10.1093/jncimonographs/lgs025
2. Рябов М.А., Котов С.В. Сравнительная оценка кривой обучения радикальной простатэктомии произведённой позадилонной, лапароскопической, промежностной и робот-ассистированной техниками. Вестник урологии. 2022;10(2):63-71. DOI: 10.21886/2308-6424-2022-10-2-63-71
3. Еременко С.Н., Михайличенко В.Ю., Еременко А.Н., Долгополов В.П., Козак А.А., Чернега В.С., Алиев М.А. Лапароскопическая радикальная простатэктомия с сохранением проксимального отдела простатической уретры. Вестник урологии. 2023;11(2):37-46. DOI:10.21886/2308-6424-2023-11-2-37-46
4. Бядретдинов И.Ш., Котов С.В. Современные методы определения положительного хирургического края во время выполнения радикальной простатэктомии. Урология. 2023;1(1):106-113. DOI: 10.18565/urology.2023.1.106-113
5. Eichelberg C, Erbersdobler A, Haese A, Schlomm T, Chun FK, Currlin E, Walz J, Steuber T, Graefen M, Huland H. Frozen section for the management of intraoperatively detected palpable tumor lesions during nerve-sparing scheduled radical prostatectomy. Eur Urol. 2006;49(6):1011-6; discussion 1016-8. DOI: 10.1016/j.eururo.2006.02.035
6. Bianchi R, Cozzi G, Petralia G, Alessi S, Renne G, Bottero D, Brescia A, Cioffi A, Cordima G, Ferro M, Matei DV, Mazzoleni F, Musi G, Mistretta FA, Serino A, Tringali VML, Coman I, De Cobelli O. Multiparametric magnetic resonance imaging and frozen-section analysis efficiently predict upgrading, upstaging, and extraprostatic extension in patients undergoing nerve-sparing robotic-assisted radical prostatectomy. Medicine (Baltimore). 2016;95(40):e4519. DOI: 10.1097/MD.0000000000004519
7. Preisser F, Coxilha G, Heinze A, Oh S, Chun FK, Sauter G, Pompe RS, Huland H, Graefen M, Tilki D. Impact of positive surgical margin length and Gleason grade at the margin on biochemical recurrence in patients with organ-confined prostate cancer. Prostate. 2019;79(16):1832-1836. DOI: 10.1002/pros.23908
8. Медведев А.В., Коган М.И., Медведева Л.А. Интраоперационная иммуноморфологическая оценка хирургических краев резекции при радикальной простатэктомии по поводу рака предстательной железы. Онкоурология. 2011;(2):60-64. eLIBRARY ID: 18762499; EDN: PUPBTT
9. Соколов Е.А., Велиев Е.И., Паклина О.В., Кнышинский Г.В. Интраоперационное гистологическое исследование замороженных срезов участков предстательной железы, прилегающих к сосудисто-нервному пучку: первичный опыт применения при робот-ассистированной радикальной простатэктомии. Вестник современной клинической медицины. 2019;12(6):66-71. DOI: 10.20969/VSKM.2019.12(6).66-71
10. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, Heinzer H, Hansen J, Budäus L, Steurer S, Wittmer C, Minner S, Haese A, Sauter G, Graefen M, Huland H. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) increases nerve-sparing frequency and reduces positive surgical margins in open and robot-assisted laparoscopic radical prostatectomy: experience after 11,069 consecutive patients. Eur Urol. 2012;62(2):333-40. DOI: 10.1016/j.eururo.2012.04.057
11. Beyer B, Schlomm T, Tennstedt P, Boehm K, Adam M, Schiffmann J, Sauter G, Wittmer C, Steuber T, Graefen M, Huland H, Haese A. A feasible and time-efficient adaptation of NeuroSAFE for da Vinci robot-assisted radical prostatectomy. Eur Urol. 2014;66(1):138-44. DOI: 10.1016/j.eururo.2013.12.014
12. Mirmilstein G, Rai BP, Gbolahan O, Srirangam V, Narula A, Agarwal S, Lane TM, Vasdev N, Adshead J. The neurovascular structure-adjacent frozen-section examination (NeuroSAFE) approach to nerve sparing in robot-assisted laparoscopic radical prostatectomy in a British setting - a prospective observational comparative study. BJU Int. 2018;121(6):854-862. DOI: 10.1111/bju.14078
13. Hatzichristodoulou G, Wagenpfeil S, Weirich G, Autenrieth M, Maurer T, Thalgott M, Horn T, Heck M, Herkommer K, Gschwend JE, Kübler H. Intraoperative frozen section monitoring during nerve-sparing radical prostatectomy: evaluation of partial secondary resection of neurovascular bundles and its effect on oncologic and functional outcome. World J Urol. 2016;34(2):229-36. DOI: 10.1007/s00345-015-1623-3
Об авторах
С. В. КотовРоссия
Сергей Владиславович Котов — д-р мед. наук, профессор; заведующий кафедрой урологии и андрологии; руководитель Университетской клиникой урологии, онкоурологии и андрологии; врач-уролог урологического отделения
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
И. Ш. Бядретдинов
Россия
Ильдар Шамилевич Бядретдинов — аспирант кафедры урологии и андрологии; врач-уролог 3-го хирургического отделения
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Р. И. Гуспанов
Россия
Ренат Иватуллаевич Гуспанов — канд. мед. наук; доцент кафедры урологии и андрологии; врач-уролог урологического отделения; врач-онколог 4-го онкологического отделения (онкоурологии)
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
С. А. Пульбере
Россия
Сергей Александрович Пульбере — д-р мед. наук, доцент; профессор кафедры урологии и андрологии; заведующий отделением урологии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Г. Юсуфов
Россия
Анвар Гаджиевич Юсуфов — канд. мед. наук; доцент кафедры урологии и андрологии; заведующий урологическим отделением
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Котов С.В., Бядретдинов И.Ш., Гуспанов Р.И., Пульбере С.А., Юсуфов А.Г. Таргетное исследование свежезамороженных срезов для определения статуса хирургического края при выполнении радикальной простатэктомии. Вестник урологии. 2023;11(3):44-53. https://doi.org/10.21886/2308-6424-2023-11-3-44-53
For citation:
Kotov S.V., Byadretdinov I.Sh., Guspanov R.I., Pulbere S.A., Yusufov A.G. Target urgent study of fresh frozen sections to define the surgical margin status during radical prostatectomy. Urology Herald. 2023;11(3):44-53. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-3-44-53













































