Перейти к:
Анализ влияния клинико-лабораторных показателей на выживаемость у больных метастатическим почечноклеточным раком с промежуточным прогнозом по IMDC (International mRCC Database Consortium)
https://doi.org/10.21886/2308-6424-2023-11-2-110-121
Аннотация
Введение. Большинство пациентов с метастатической почечно-клеточной карциномой (мПКР), получавших системную терапию, классифицируются в подгруппу промежуточного риска в соответствии с оценкой Международного консорциума (International mRCC Database Consortium — IMDC), однако выживаемость у больных с одним и двумя неблагоприятными факторами (НФ) риска значимо отличается.
Цель исследования. Оценить влияние клинико-лабораторных показателей на выживаемость больных мПКР промежуточного прогноза по IMDC в зависимости от количества факторов риска.
Материалы и методы. Проведён ретроспективный анализ данных 316 пациентов с мПКР группы промежуточного прогноза, получавших системную терапию. Сравнивали наличие и влияние на выживаемость следующих лабораторных показателей: гемоглобина крови, количества нейтрофилов, ЛДГ, количества тромбоцитов, щелочную фосфатазу, уровень кальция сыворотки крови, СОЭ. Также акцент был сделан на время возникновения метастазов. Оценивали общую выживаемость (ОВ), выживаемость после прогрессирования (ВПП), 3- и 5-летнюю выживаемости.
Результаты. Общая 3- и 5-летняя выживаемость в группе с одним НФ составила 85,2% ± 1,8% и 58,1 ± 1,6% (p < 0,001), в группе с двумя НФ — 79,1% ± 1,7% и 35,6 1,6% (p < 0,001). У пациентов с одним НФ 3- и 5-летняя ВПП составила 66,1% ± 1,6% и 21,8% ± 1,4% (p < 0,001), в группе с двумя НФ — 45,2% ± 1,5% и 12,2% ± 1,3% (p < 0,001). Медиана ОВ составила 61 и 51 месяц, ВПП — 50 и 32 месяца соответственно (p < 0,001). При сравнении частоты встречаемости градаций исследуемых лабораторных показателей, оказывающих предположительное влияние на прогноз, статистически значимых различий в зависимости от количества НФ не выявлено. Также не было выявлено значимых различий показателей выживаемости при отклонении лабораторных показателей от нормы, за исключением уровня гемоглобина: ОВ у пациентов с одним НФ значимо больше при гемоглобине в норме (p < 0,05). В дальнейшем, учитывая отсутствие влияния выбранных факторов на показатели выживаемости при их явных значимых различиях у пациентов с одним и двумя НФ, проанализировано влияние времени возникновения метастазов (синхронные / метахронные): все параметры выживаемости были значимо хуже у пациентов с синхронными метастазами. Кроме этого, показатели ОВ пациентов с метахронными метастазами с одинаковым безрецидивным периодом были значимо лучше случаях с одним НФ по IMDC.
Заключение. Наличие одного или двух прогностических факторов значимо влияет на показатели 3- и 5-летней общей выживаемости и выживаемости после прогрессирования у пациентов промежуточного прогноза мПКР, при этом выживаемость не зависит от лабораторных показателей, за исключением уровня гемоглобина.
Ключевые слова
Для цитирования:
Семенов Д.В., Орлова Р.В., Широкорад В.И., Кострицкий С.В., Глузман М.И., Григорьев С.Г., Корнева Ю.С. Анализ влияния клинико-лабораторных показателей на выживаемость у больных метастатическим почечноклеточным раком с промежуточным прогнозом по IMDC (International mRCC Database Consortium). Вестник урологии. 2023;11(2):110-121. https://doi.org/10.21886/2308-6424-2023-11-2-110-121
For citation:
Semenov D.V., Orlova R.V., Shirokorad V.I., Kostritsky S.V., Gluzman M.I., Grigoriev S.G., Korneva Yu.S. Analysis of the effect of clinical and laboratory parameters on survival in patients with metastatic renal cell cancer with intermediate prognosis according to IMDC (International mRCC Database Consortium). Urology Herald. 2023;11(2):110-121. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-2-110-121
Введение
Внедрение в клиническую практику таргетных препаратов и современной иммунотерапии существенно улучшило показатели выживаемости пациентов с метастатической почечно-клеточной карциномой (мПКР). В клинической практике для оценки прогноза при назначении таргетной терапии у ранее не леченных больных используется прогностическая модель International mRCC Database Consortium (IMDC) (D. Heng, 2010), представляющая собой дополненную модель Memorial Sloan Kettering Cancer Center (MSKCC) и включающая 6 факторов риска [1]. На её основании все пациенты делятся на три прогностические группы: благоприятного прогноза (при отсутствии факторов риска), промежуточного (1 или 2 фактора) и неблагоприятного прогноза (3 и более факторов) [2, 3], что существенно сказывается на общей выживаемости (ОВ): 43,3 месяца при благоприятном прогнозе и всего 8 месяцев при неблагоприятном [4]. Большинство пациентов с мПКР (42,2 – 78,8% пациентов по данным разных авторов) до начала терапии относят в группу промежуточного прогноза по IMDC [5][6] и проведённые исследования, сравнивающие выживаемость пациентов промежуточного прогноза с наличием одним и двумя неблагоприятных факторов (НФ), свидетельствуют о значимых различиях [7-9], в связи с чем возникает вопрос, правомочно ли объединять пациентов группы промежуточного прогноза с одним и двумя НФ в одну прогностическую группу.
Цель исследования. Оценить влияние клинико-лабораторных показателей на выживаемость больных мПКР промежуточного прогноза по IMDC в зависимости от количества факторов риска.
Материалы и методы
Ретроспективный анализ материалов историй болезни 934 пациентов с мПКР, получавших лечение в период с 2006 года по 2020 год на базе Городской онкологической больницы № 62 г. Москвы и Городского онкологического диспансера г. Санкт-Петербурга. Из них 316 больных имели промежуточный прогноз по IMDC: 154 (48,7%) с одним (группа 1) и 162 (51,2%) — с двумя НФ (группа 2).
Протокол динамического наблюдения включал лабораторные исследования (клинический и биохимический анализы крови) и методы лучевой диагностики (компьютерная томография лёгких, органов брюшной полости и малого таза).
Статистический анализ. Статистический анализ проводили с использованием пакетов программного обеспечения Statistica 10.0 («StatSoft Inc.», Tulsa, OK, USA). Частоту встречаемости фактора в выборке оценивали критерием Pearson χ2 и точным критерием Fisher. Сравнение времени жизни двух групп пациентов выполнено посредством построения кривых Kaplan-Meier и таблиц дожития. Для оценки влияния на выживаемость исследуемых факторов использовали регрессию Cox, или модель пропорциональных рисков в форме отношения шансов (ОШ) и его 95% доверительных интервалов (95% ДИ). Пороговым значением уровня значимости статистических критериев принято значение p < 0,05.
Результаты
Характеристики пациентов и их распределение представлены в таблице 1. При сравнении характеристик пациентов промежуточного прогноза по IMDC было выявлено, что в группе с одним НФ чаще встречались высокодифференцированные опухоли, метастазы в головной мозг, а ECOG-статус (ECOG, Eastern Cooperative Oncology Group — Восточная кооперативная группа по онкологии) был лучше, чем у пациентов с двумя НФ. Соответственно лучшая выживаемость была достигнута у пациентов с одним НФ, а продолжительность лечения была значимо больше (табл. 1).
Терапию ингибиторами тирозинкиназы (ТКИ) получили 132 (85,7%) больных с одним НФ и 141 (87%) больных с двумя НФ, лечение ингибиторами контрольных точек иммунного ответа (ИКТ) — 10 (6,5%) и 12 (7,4%), комбинацию ТКИ + ИКТ — 12 (7,8%) и 9 (5,6%) пациентов соответственно. Значимых различий в частоте назначения групп препаратов выявлено не было (табл. 1).
Таблица 1. Сравнительная характеристика исходных показателей больных промежуточного прогноза мПКР с одним и двумя неблагоприятными факторами
Table 1. Comparison of baseline performance of mRCC patients with intermediate prognosis in one and two unfavourable prognostic risk factors
Характеристика больных Characteristics of patients | 1 фактор | 1 factor (n = 154), n (%) | 2 фактора | 2 factors (n = 162), n (%) | χ2 p |
Мужчины Male | 111 (72,1) | 111 (68,5) | χ2 = 0,48 р = 0,49 |
Женщины Female | 43 (27,9) | 51 (31,5) | |
Медиана возраста, лет Age median, years | 60,1 (33 – 83) | 62,3 (32 – 84) | р = 0,34 |
Предшествовавшая системной терапии нефрэктомия или резекция почки: Nephrectomy or kidney resection prior to systemic therapy: | |||
Да | Yes | 150 (97,4) | 154 (95,1) | χ2 = 1,09 р = 0,91 |
Нет | No | 4 (2,6) | 8 (4,9) | |
Индекс Karnofsky: Karnofsky's index: | |||
0 – 1 | 82 (53,2) | 68 (42,0) | χ2 = 4,0 р = 0,04 |
2 – 4 | 72 (46,8) | 94 (58,0) | |
Клиническая стадия: Clinical stage: | |||
T1 – T2 | 56 (36,7) | 64 (39,5) | χ2 = 0,33 р = 0,56 |
T3 – T4 | 98 (63,6) | 98 (60,5) | |
No | 125 (81,2) | 131 (80,9) | χ2 = 0,005 р = 0,94 |
N1 | 29 (18,8) | 31 (19,1) | |
Дифференцировка опухоли по Fuhrman: Tumor differentiation according to Fuhrman: |
|
|
|
G1 | 23 (14,9) | 11 (6,8) | χ2 = 6,0 р = 0,05 |
G2 | 76 (49,4) | 94 (58,0) | |
G3 | 55 (35,7) | 57 (35,2) | |
Число поражённых мтс органов на момент лечения: Number of mts-affected organs at the time of treatment: | |||
1 | 74 (48,0) | 69 (42,6) | χ2 = 2,7 р = 0,26 |
2 | 42 (27,3) | 58 (35,8) | |
≥ 3 | 38 (24,7) | 35 (21,6) | |
Время до начала терапии: Time before the start of therapy: |
|
|
|
< 1 года | < 1 year | 65 (42,2) | 71 (46,9) | χ2 = 0,08 р = 0,77 |
> 1 года | > 1 year | 89 (57,8) | 91 (53,1) | |
Варианты терапии первой линии: Therapy options first-line therapy: | |||
ТКИ | TKIs | 132 (85,7) | 141 (87) | χ2 = 1,53 р = 0,22 |
ИКТ | ICIs | 10 (6,5) | 12 (7,4) | |
Комбинации | Combinations | 12 (7,8) | 9 (5,6) | |
Продолжительность системной терапии первой линии, мес (M ± m) Duration of first-line systemic therapy, months (M ± m) | 13,7 ± 1,05 | 12,1 ± 1,03 | р = 0,015 |
Продолжительность лечения, мес (M ± m) Treatment duration, months (M ± m) | 67,6 ± 3,8 | 54,1 ± 2,7 | р = 0,008 |
Время возникновения метастазов: Time of occurrence metastases: | |||
Синхронные | Synchronous | 44 (28,6) | 43 (26,5) | р = 0,18 |
Метахронные | Metachronous | 110 (71,4) | 119 (73,5) | |
Локализация метастазов: Localization of metastases: | |||
Лёгкие | Lung | 106 (68,8) | 105 (64,8) | р = 0,45 |
Кости | Bone | 50 (32,5) | 55 (33,9) | р = 0,71 |
Л/у | Lymph nodes | 46 (29,9) | 50 (33,9) | р = 0,45 |
Печень | Liver | 15 (9,7) | 20 (12,3) | р = 0,57 |
Надпочечник | Adrenal | 20 (13,0) | 13 (8,0) | р = 0,15 |
Почка | Renal | 11 (7,1) | 8 (4,9) | р = 0,72 |
Головной мозг | Brain | 12 (7,8) | 3 (1,8) | р = 0,01 |
Время до появления метахронных мтс: Time to occurrence of metachronous mts: | |||
< 1 года | < 1 year | 37 (29,4) | 47 (38,2) | р = 0,53 |
1 – 3 года | 1 – 3 years | 55 (43,6) | 53 (43,1) | р = 0,98 |
3 – 5 лет | 3 – 5 years | 15 (11,9) | 13 (10,6) | р = 0,73 |
> 5 лет | > 5 years | 19 (15,1) | 10 (8,1) | р = 0,83 |
Примечание. ТКИ — тирозинкиназы ингибиторы; ИКТ — ингибиторы контрольных точек; Л\у —лимфатические узлы Note. TKIs — tyrosine kinase inhibitors; ICIs — immune checkpoint inhibitors | |||
Общая 3- и 5-летняя выживаемость для группы с одним НФ составила 85,2% ± 1,8% и 58,1 ± 1,6%¸ а с двуми НФ 79,1% ± 1,7% и 35,6 ± 1,4% соответственно (p < 0,001). Общая 3- и 5-летняя ВБП для обеих групп составила 66,1% ± 1,6% и 21,8% ± 1,4%; 45,2% ± 1,5% и 12,2% ± 1,3% соответственно (p < 0,001). Медиана ОВ для групп с одним и двумя НФ составила 61 и 51 месяц и ВБП 50 и 32 месяца соотвественно (p < 0,001) (рис. 1). Таким образом, при наличии одного НФ все показатели выживаемости значимо выше, чем при наличии двух НФ.
При сравнении частоты встречаемости градаций исследуемых лабораторных показателей, оказывающих предположительное влияние на прогноз, статистически значимых различий между группами пациентов промежуточного прогноза не выявлено (табл. 2). Также не было выявлено значимых различий выживаемости в исследуемых группах при отклонении лабораторных показателей от нормы, за исключением уровня гемоглобина: ОВ у пациентов с одним фактором риска значимо больше при нормальном уровне гемоглобина (p < 0,05). Общая 3-летняя и 5-летняя выживаемость при гемоглобине в норме больных при наличии одного НФ составила 90,1 ± 1,7% и 63,9 ± 1,6%, а при двух НФ 75,2 ± 1,5% и 31,2 ± 1,9% соответственно. Медиана ОВ при гемоглобине в норме в двух группах составила 51 и 12 месяцев соответственно. 3-летняя и 5-летняя ОВ при анемии больных с наличием одного НФ составила 63,8 ± 1,6% и 52,5 ± 1,8%, а при наличии двух НФ 60,8 ± 1,5% и 16,8±1,9% соответственно. Медиана ОВ в двух группах составила 50 и 44 месяцев соответственно (p < 0,05). При одно- и многофакторном анализе модели пропорциональных рисков по Коксу ОВ и ВБП не выявлены статистически значимые прогностические факторы из числа исследуемых в группе промежуточного риска по IMDC (р > 0,05).
Таблица 2. Сравнение исходных лабораторных показателей больных промежуточного прогноза мПКР с одним и двумя неблагоприятными факторами
Table 2. Comparison of baseline laboratory ratios of mRCC patients with intermediate prognosis in one and two unfavourable prognostic risk factors
Характеристика больных Characteristics of patients | 1 фактор |1 factor (N = 154), n (%) | 2 фактора | 2 factors (N = 162), n (%) | χ2 p | |
Гемоглобин Hemoglobin | Норма | Normal | 117 (76,0) | 124 (76,5) | χ2 = 0,01 р = 0,9 |
Анемия | Anemia | 37 (24,0) | 38 (23,5) | ||
Нейтрофилы Neutrophils | Норма | Normal | 121 (78,6) | 132 (81,5) | χ2 = 0,52 р = 0,77 |
< НГН | LLN | 20 (13,0) | 17 (10,5) | ||
> ВГН | ULN | 13 (8,4) | 13 (8,0) | ||
Тромбоциты Platelets | Норма | Normal | 110 (71,4) | 125 (77,2) | χ2 = 1,41 р = 0,49 |
< НГН | LLN | 26 (16,9) | 21 (12,9) | ||
> ВГН | ULN | 18 (11,7) | 16 (9,9) | ||
ЛДГ LDH | Норма | Normal | 118 (76,6) | 129 (79,6) | χ2 = 0,42 р = 0,52 |
> ВГН | ULN | 36 (23,4) | 33 (20,4) | ||
ЩФ ALP | Норма |Normal | 102 (66,2) | 112 (69,1) | χ2 = 0,30 р = 0,58 |
> ВГН | ULN | 52 (33,8) | 50 (30,9) | ||
Кальций Calcium | Норма | Normal | 45 (29,2) | 56 (34,6) | χ2 = 0,22 р = 0,37 |
> ВГН | ULN | 24 (15,6) | 18 (11,1) | ||
Неизвестно | Unknown | 85 (55,2) | 88 (54,3) | ||
СОЭ ESR | Норма | Normal | 66 (42,9)
| 71 (43,8)
| χ2 = 0,03 р = 0,86 |
> ВГН | ULN | 88 (57,1) | 91 (56,2) |
| |
Примечание. ЛДГ — лактатдегидрогеназа; ЩФ — щелочная фосфатаза; СОЭ — скорость оседания эритроцитов; ВГН — верхняя граница нормы; НГН — нижняя граница нормы Note. LDH — lactate dehydrogenase; ALP — alkaline phosphatase; ESR — erythrocyte sedimentation rate; ULN — upper limit of normal; LLN — lower limit of normal | ||||
Отсутствие различий при оценке влияния на выживаемость вышеперечисленных лабораторных показателей, в том числе включённых в шкалу IMDC, побудило обратиться к таким характеристикам метастатического процесса как время возникновения метастазов (рис. 2) и сроки безрецидивного периода (рис. 3).
Общая 3- и 5-летняя выживаемость для подгруппы с одним НФ при синхронных и метахронных метастазах составила 87,6 ± 1,8% и 68,1 ± 1,6%; 74,7 ± 1,7% и 31,6 ± 1,6% соответственно (p < 0,001). Медиана ОВ для пациентов с одним НФ составила 73 и 49 месяцев. Общая 3- и 5-летняя ОВ для подгруппы с двумя НФ при синхронных и метахронных метастазах составила 79,6 ± 1,7% и 39,8 ± 1,5%; 48,4 ± 1,5% и 20,7 ± 1,4% соответственно (p < 0,001). Медиана ОВ для больных с двумя НФ составила 57 и 38 месяцев соответственно (p < 0,001).
При попарном сравнении ОВ пациентов промежуточного прогноза с метахронными метастазами в зависимости от количества факторов риска и продолжительности безрецидивного периода были получены следующие результаты:
- 3- и 5-летняя ОВ больных при безрецидивном периоде до 1 года составила 80,7 ±1,8% и 73,5 ± 1,7; 39,5 ± 1,5% и 23,6 ± 1,4% месяцев соответственно. Медиана ОВ 51 и 42 месяца соответственно (р = 0,001).
- 3- и 5-летняя ОВ больных при безрецидивном периоде 1 – 3 года составила 81,8 ±1,8% и 75,2 ± 1,7; 52,4 ± 1,5% и 19,8 ± 1,3% месяцев соответственно. Медиана ОВ 58 и 48 месяцев соответственно (p = 0,001).
- 3- и 5-летняя ОВ больных при безрецидивном периоде 3 – 5 лет составила 88,7 ±1,8% и 63,6 ± 1,6; 42,3 ± 1,5% и 24,6 ± 1,4% месяцев соответственно. Медиана ОВ 56 и 40 месяцев соответственно (p = 0,006).
- 3- и 5-летняя ОВ больных при безрецидивном периоде более 5 лет составила 82,4 ±1,8% и 60,8 ± 1,6; 44,8 ± 1,5% и 37,9 ± 1,4% месяцев соответственно. Медиана ОВ 54 и 47 месяцев соответственно (p = 0,001) (рис. 3).
Таким образом, отмечены лучшие показатели ОВ у пациентов мПКР промежуточного прогноза по IMDC с одним прогностическим фактором для всех безрецидивных периодов.
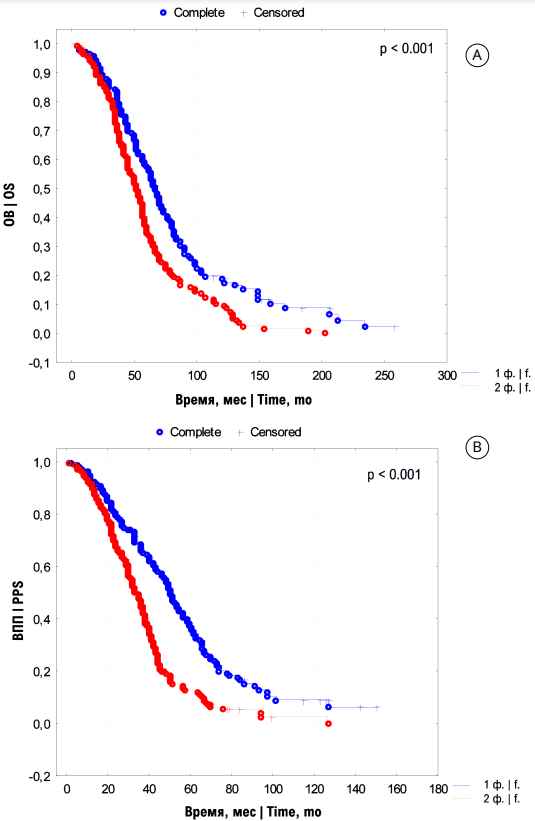
Рисунок 1. Кривые Kaplan-Meier [А] общей выживаемости (ОВ) и [В] выживаемости после прогрессирования (ВПП) больных мПКР промежуточного прогноза по IMDC с одним и двумя прогностическими факторами (ф.)
Figure 1. Kaplan-Meier [А] overall survival (OS) and [В] post-progression survival (PPS) curves of mRCC patients with intermediate prognosis according to IMDC in one and two unfavourable prognostic risk factors (f.)
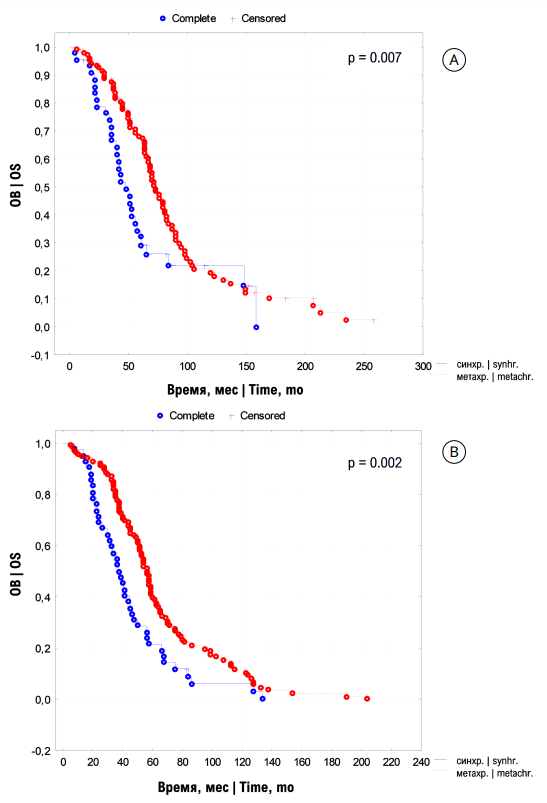
Рисунок 2. Кривые Kaplan-Meier общей выживаемости (ОВ) больных мПКР промежуточного прогноза по IMDC с одним [A] и двумя [B] прогностическими факторами при синхронных (синхр.) и метахронных (метахр.) метастазах
Figure 2. Kaplan-Meier overall survival (OS) curves of mRCC patients with intermediate prognosis according to IMDC in one [A] or two [B] unfavourable prognostic risk factors in synchronous (synhr.) and metachronous (metachr.) metastases
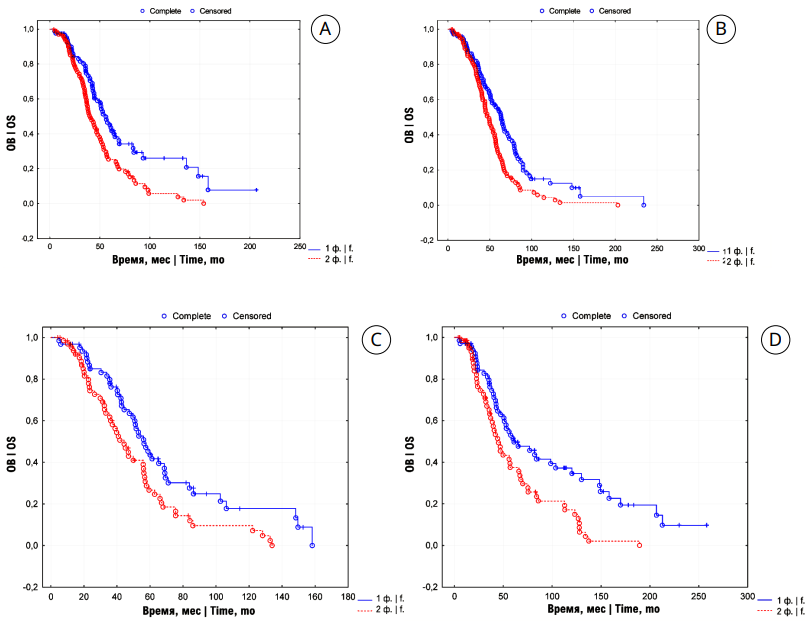
Рисунок 3. Кривые Kaplan-Meier общей выживаемости (ОВ) больных мПКР промежуточного прогноза по IMDC с одним и двумя прогностическими факторами (ф.) при безрецидивном периоде: A — < 1 года; B — 1 – 3 года; C — 3 – 5 лет; D — > 5 лет
Figure 3. Kaplan-Meier overall survival (OS) curves of mRCC patients with intermediate prognosis according to IMDC in one or two unfavourable prognostic risk factors (f.) for a relapse-free period: A — < 1 year; B — 1 – 3 years; C — 3 – 5 years; D — > 5 years
Обсуждение
Классификация MSKCC была создана для пациентов мПКР в эру лечения цитокинами; шкала IMDC была предложена в 2009 году для пациентов с мПКР перед назначением таргетной терапии. В настоящее время при использовании ИКТ не удалось усовершенствовать шкалу IMDC, поэтому продолжается поиск прогностических критериев для улучшения эффективности лечения. До настоящего времени было проведено несколько исследований по изучению перспектив пациентов группы промежуточного прогноза мПКР. A. Sella et al. сообщили о ретроспективном анализе 6 рандомизированных клинических исследований, показавшем, что количество прогностических факторов (один против двух) и статус ECOG значительно влияют на выживаемость у больных мПКР с промежуточным прогнозом: медиана ОВ составила 27,8 месяцев против 15 месяцев; наиболее часто встречающимися прогностическими факторами были уровень гемоглобина и время начала терапии после диагноза [8]. В нашем исследовании медиана ОВ составила 61 и 49 месяцев и ВБП 39 и 15 месяцев соотвественно. R. Iacovelli et al. также считают необходимым делить пациентов с мПКР группы промежуточного прогноза в зависимости от количества НФ, так как это значимо сказывается на выживаемости при лечении сунитинибом (ОВ 32,8 месяца при наличии 1 фактора по сравнению с 20 месяцами при наличии 2-х факторов) [9]. S. Tamada et al. изучили потенциальные прогностические факторы в группе промежуточного риска, показав, что соматический статус и уровень гемоглобина были наиболее часто встречающимися в группе промежуточного прогноза, при этом нет значимых различий в ОВ в группе неблагоприятного прогноза и промежуточного прогноза с 2 прогностическими факторами, в то время как группа благоприятного прогноза имеет значимо более высокие показатели выживаемости в сравнении с промежуточным прогнозом с 1 НФ. Однако большее влияние на выживаемость в группе промежуточного прогноза оказывает количество органов, пораженных метастазами, и их локализация [10]. В отличие от исследования A. Guida et al. в нашем исследовании количество тромбоцитов не влияло на выживаемость, однако учитывая значимость уровня гемоглобина для прогноза, авторы предлагают оценивать эти факторы в совокупности [11]. В нашем исследовании уровень гемоглобина также оказывал значимое влияние в исследуемых группах промежуточного прогноза на ОВ. S.H. Kim et al. ретроспективно проанализированы популяции промежуточного и неблагоприятного прогнозов с упором на прогностическую роль времени до появления метастазов. Они установили, что появление метахронных метастазов по сравнению с синхронными связано с лучшим исходом [12], что также было отмечено в нашем исследовании.
Заключение
Наличие одного или двух прогностических факторов значительно влияет на показатели 3- и 5-летней общей выживаемости и выживаемости после прогрессирования у пациентов промежуточного прогноза мПКР, при этом изученные лабораторные показатели не влияют на выживаемость, за исключением уровня гемоглобина. При этом все показатели выживаемости были значимо хуже у пациентов с синхронными метастазами. Кроме этого, показатели ОВ у пациентов с метахронными метастазами с одинаковым безрецидивным периодом были значимо лучше у больных с одним НФ по IMDC.
Учитывая динамичность развития подходов системного лечения мПКР, одна из наиболее важных проблем заключается в прогностической стратификации пациентов для выбора терапии первой линии. Для оптимального дизайна клинических исследований необходимо дополнительно охарактеризовать и проанализировать гетерогенную группу пациентов промежуточного прогноза IMDC. Вероятно, в ближайшем будущем предстоит пересмотреть и дополнить факторы шкалы IMDC, добавив показатели, влияющие на прогноз именно в этой когорте пациентов, включающие также молекулярно-генетические характеристики опухолевых клеток. Способность онкологов разделять промежуточную популяцию на подгруппы, вероятно, будет оказывать влияние на то, какую системную терапию выбрать для персонализированного лечения.
Список литературы
1. Волкова М.И., Алексеев Б.Я., Гладков О.А., Матвеев В.Б., Носов Д.А. Практические рекомендации по лекарственному лечению почечноклеточного рака. Злокачественные опухоли. 2022;12(3s2-1):579-588. DOI: 10.18027/2224-5057-2022-12-3s2-579-588
2. Heng DY, Xie W, Regan MM, Warren MA, Golshayan AR, Sahi C, Eigl BJ, Ruether JD, Cheng T, North S, Venner P, Knox JJ, Chi KN, Kollmannsberger C, McDermott DF, Oh WK, Atkins MB, Bukowski RM, Rini BI, Choueiri TK. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol. 2009;27(34):5794-9. DOI: 10.1200/JCO.2008.21.4809
3. Heng DY, Xie W, Regan MM, Harshman LC, Bjarnason GA, Vaishampayan UN, Mackenzie M, Wood L, Donskov F, Tan MH, Rha SY, Agarwal N, Kollmannsberger C, Rini BI, Choueiri TK. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol. 2013;14(2):141-8. DOI: 10.1016/S1470-2045(12)70559-4
4. Motzer RJ, Tannir NM, McDermott DF, Arén Frontera O, Melichar B, Choueiri TK, Plimack ER, Barthélémy P, Porta C, George S, Powles T, Donskov F, Neiman V, Kollmannsberger CK, Salman P, Gurney H, Hawkins R, Ravaud A, Grimm MO, Bracarda S, Barrios CH, Tomita Y, Castellano D, Rini BI, Chen AC, Mekan S, McHenry MB, Wind-Rotolo M, Doan J, Sharma P, Hammers HJ, Escudier B; CheckMate 214 Investigators. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med. 2018;378(14):1277-1290. DOI: 10.1056/NEJMoa1712126
5. Choueiri TK, Halabi S, Sanford BL, Hahn O, Michaelson MD, Walsh MK, Feldman DR, Olencki T, Picus J, Small EJ, Dakhil S, George DJ, Morris MJ. Cabozantinib Versus Sunitinib As Initial Targeted Therapy for Patients With Metastatic Renal Cell Carcinoma of Poor or Intermediate Risk: The Alliance A031203 CABOSUN Trial. J Clin Oncol. 2017;35(6):591-597. Erratum in: J Clin Oncol. 2017;35(32):3736. Erratum in: J Clin Oncol. 2018;36(5):521. PMID: 28199818; PMCID: PMC5455807. DOI: 10.1200/JCO.2016.70.7398
6. Méjean A, Ravaud A, Thezenas S, Colas S, Beauval JB, Bensalah K, Geoffrois L, Thiery-Vuillemin A, Cormier L, Lang H, Guy L, Gravis G, Rolland F, Linassier C, Lechevallier E, Beisland C, Aitchison M, Oudard S, Patard JJ, Theodore C, Chevreau C, Laguerre B, Hubert J, Gross-Goupil M, Bernhard JC, Albiges L, Timsit MO, Lebret T, Escudier B. Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. N Engl J Med. 2018;379(5):417-427. DOI: 10.1056/NEJMoa1803675
7. Hudes G, Carducci M, Tomczak P, Dutcher J, Figlin R, Kapoor A, Staroslawska E, Sosman J, McDermott D, Bodrogi I, Kovacevic Z, Lesovoy V, Schmidt-Wolf IG, Barbarash O, Gokmen E, O'Toole T, Lustgarten S, Moore L, Motzer RJ; Global ARCC Trial. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med. 2007;356(22):2271-81. DOI: 10.1056/NEJMoa066838
8. Sella A, Michaelson MD, Matczak E, Simantov R, Lin X, Figlin RA. Heterogeneity of Patients With Intermediate-Prognosis Metastatic Renal Cell Carcinoma Treated With Sunitinib. Clin Genitourin Cancer. 2017;15(2):291-299.e1. DOI: 10.1016/j.clgc.2016.08.013
9. Iacovelli R, De Giorgi U, Galli L, Zucali P, Nolè F, Sabbatini R, Fraccon AP, Basso U, Mosca A, Atzori F, Santini D, Facchini G, Fornarini G, Pasini F, Masini C, Massari F, Buti S, Sava T, Sacco C, Ricotta R, Sperduti I, Tortora G, Porta C. Is It Possible to Improve Prognostic Classification in Patients Affected by Metastatic Renal Cell Carcinoma With an Intermediate or Poor Prognosis? Clin Genitourin Cancer. 2018;16(5):355-359.e1. DOI: 10.1016/j.clgc.2018.04.007
10. Tamada S, Iguchi T, Yasuda S, Kato M, Yamasaki T, Nakatani T. The difference in the survival rate of patients with metastatic renal cell carcinoma in the intermediate-risk group of the Memorial Sloan Kettering Cancer Center criteria. Oncotarget. 2018;9(45):27752-27759. DOI: 10.18632/oncotarget.25554
11. Guida A, Le Teuff G, Alves C, Colomba E, Di Nunno V, Derosa L, Flippot R, Escudier B, Albiges L. Identification of international metastatic renal cell carcinoma database consortium (IMDC) intermediate-risk subgroups in patients with metastatic clear-cell renal cell carcinoma. Oncotarget. 2020;11(49):4582-4592. DOI: 10.18632/oncotarget.27762
12. Kim SH, Suh YS, Lee DE, Park B, Joo J, Joung JY, Seo HK, Lee KH, Chung J. A retrospective comparative study of progression-free survival and overall survival between metachronous and synchronous metastatic renal cell carcinoma in intermediate- or poor-risk patients treated with VEGF-targeted therapy. Oncotarget. 2017;8(55):93633-93643. DOI: 10.18632/oncotarget.20674
13. Joshi A, Ramaswamy A, Noronha V, Patil VM, Chandrasekharan A, Goel A, Sahu A, Sable N, Agrawal A, Menon S, Prabhash K. Efficacy and safety of sorafenib in advanced renal cell cancer and validation of Heng criteria. Indian J Cancer. 2016;53(3):423-428. DOI: 10.4103/0019-509X.200662
Об авторах
Д. В. СеменовРоссия
Дмитрий Владимирович Семенов — кандидат медицинских наук; доцент кафедры онкологии медицинского факультета ФГБОУ ВО СПБГУ; врач отделения онкоурологии СПб ГБУЗ «ГКОД».
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Р. В. Орлова
Россия
Рашида Вахидовна Орлова — доктор медицинских наук, профессор; заведующая кафедрой онкологии медицинского факультета ФГБОУ ВО СПбГУ; главный специалист по клинической онкологии СПб ГБУЗ «ГКОД».
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. И. Широкорад
Россия
Валерий Иванович Широкорад — доктор медицинских наук; заведующий онкоурологическим отделением ГБУЗ «МГОБ № 62 ДЗМ».
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
С. В. Кострицкий
Россия
Станислав Викторович Кострицкий — врач онкоурологического отделения ГБУЗ «МГОБ № 62 ДЗМ».
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. И. Глузман
Россия
Марк Игоревич Глузман — кандидат медицинских наук; доцент кафедры онкологии медицинского факультета ФГБОУ ВО СПБГУ; заведующий отделением противооопухолевой лекарственной терапии СПб ГБУЗ «ГКОД».
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
С. Г. Григорьев
Россия
Степан Григорьевич Григорьев — доктор медицинских наук, профессор; старший научный сотрудник НИО медицинских информационных технологий НИЦ ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Ю. С. Корнева
Россия
Юлия Сергеевна Корнева — кандидат медицинских наук; доцент кафедры патологической анатомии ФГБОУ ВО СГМУ Минздрава России; доцент кафедры патологической анатомии ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России; врач патологоанатомического отделения СПб ГБУЗ «Городская больница № 26».
Смоленск, Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Семенов Д.В., Орлова Р.В., Широкорад В.И., Кострицкий С.В., Глузман М.И., Григорьев С.Г., Корнева Ю.С. Анализ влияния клинико-лабораторных показателей на выживаемость у больных метастатическим почечноклеточным раком с промежуточным прогнозом по IMDC (International mRCC Database Consortium). Вестник урологии. 2023;11(2):110-121. https://doi.org/10.21886/2308-6424-2023-11-2-110-121
For citation:
Semenov D.V., Orlova R.V., Shirokorad V.I., Kostritsky S.V., Gluzman M.I., Grigoriev S.G., Korneva Yu.S. Analysis of the effect of clinical and laboratory parameters on survival in patients with metastatic renal cell cancer with intermediate prognosis according to IMDC (International mRCC Database Consortium). Urology Herald. 2023;11(2):110-121. (In Russ.) https://doi.org/10.21886/2308-6424-2023-11-2-110-121













































