Перейти к:
Варианты кровоснабжения простаты при выполнении суперселективной эмболизации простатических артерий
https://doi.org/10.21886/2308-6424-2021-9-3-32-43
Аннотация
Введение. Артерии малого таза могут иметь сложную анатомию, разные варианты отхождения, а также анастомозы с другими ветвями внутренней подвздошной артерии (ВПА). Этим обусловлена техническая сложность идентификации и катетеризации простатических артерий (ПА), а также возможность развития осложнений, связанных с нецелевой эмболизацией анастомозов простатических артерий.
Цель исследования. Провести анализ наиболее распространённых вариантов кровоснабжения простаты и оценить эффективность способов идентификации простатических артерий.
Материалы и методы. В исследование включено 168 пациентов. Для катетеризации простатических артерий применяли микропроводники 4 – 5 Fr и микрокатетеры 2 – 2,8 Fr, для эмболизации – гидрогелевые микросферы диаметром 100 – 300 µm и 300 – 500 µm, а также микрочастицы ПВА диаметром от 100 до 500 µm. На предоперационном этапе для определения типа ангиоархитектоники простаты выполняли МСКТ-ангиографию органов малого таза.
Результаты. Применение предоперационной МСКТ-ангиографии в сочетании с интраоперационной цифровой субтракционной ангиографией позволило определить варианты отхождения простатической артерии и идентифицировать их анастомозы у 100% пациентов (336 тазовых сторон). Одна простатическая артерия выявлена в 91,4% (307) тазовых сторон, две независимые ПА в 8,6% (29) случаев. Симметричный вариант отхождения простатических артерий с обеих сторон выявлен у 14,3% (24) пациентов, у остальных 85,7% (144) пациентов выявлена асимметричность с двух сторон. Отсутствие анастомозов простатических артерий выявлено в 75,5% (254) тазовых сторон, в 24,4% (82) тазовых сторон были выявлены анастомозы. Междолевые внутрипростатические анастомозы найдены в 10,1% (34) тазовых сторон, сообщение с a. dorsalis penis выявлено в 8% (27) случаев, с ректальными артериями – в 5,3% (18) тазовых сторон и с артериями мочевого пузыря в 3,6% (12) случаев. На основе анализа ангиоархитектоники малого таза у 168 пациентов предложена анатомическая классификация отхождения простатических артерий.
Заключение. Суперселективная эмболизация артерий предстательной железы – это малоинвазивный способ лечения гиперплазии простаты, обладающий высоким профилем безопасности. Артерии малого таза имеют крайне сложную анатомию, разные варианты отхождения, а также анастомозы с другими ветвями внутренней подвздошной артерии, что осложняет выполнение суперселективной эмболизации простатических артерий. Сочетание предоперационной МСКТ и интраоперационной цифровой субтракционной ангиографии позволяет идентифицировать простатическую артерию и её анастомозы в большинстве случаев.
Ключевые слова
Для цитирования:
Капранов С.А., Златовратский А.Г., Карпов В.К., Шапаров Б.М., Камалов А.А. Варианты кровоснабжения простаты при выполнении суперселективной эмболизации простатических артерий. Вестник урологии. 2021;9(3):32-43. https://doi.org/10.21886/2308-6424-2021-9-3-32-43
For citation:
Kapranov S.A., Zlatovratskiy A.G., Karpov V.K., Shaparov B.M., Kamalov A.A. Types of the prostate blood supply during super-selective embolization of prostatic arteries. Urology Herald. 2021;9(3):32-43. (In Russ.) https://doi.org/10.21886/2308-6424-2021-9-3-32-43
Введение
Гиперплазия простаты (Доброкачественная гиперплазия предстательной железы; ДГПЖ) – это широко распространённое социально значимое заболевание, которым страдают около 50% мужчин в возрасте 60 лет и почти 90% в возрасте 85 лет. Суперселективная эмболизация артерий предстательной железы (эмболизация артерий простаты; ЭАП) – эффективный и безопасный рентгенэндоваскулярный метод лечения гиперплазии простаты. Данная методика описана в клинических рекомендациях Министерства здравоохранения РФ по лечению ДГПЖ и рекомендована к применению в США и Европе [1][2][3][4].
Артерии малого таза могут иметь сложную анатомию, разные варианты отхождения, а также анастомозы с другими ветвями внутренней подвздошной артерии (ВПА). Этим обусловлена техническая сложность идентификации и катетеризации простатических артерий (ПА), а также возможность развития осложнений, связанных с нецелевой эмболизацией анастомозов простатических артерий и избыточной лучевой нагрузкой.
На основании своего опыта использования данного метода лечения у 168 пациентов, мы поставили своей целью провести анализ наиболее распространённых вариантов кровоснабжения простаты и оценить эффективность способов идентификации простатических артерий.
Материалы и методы
За период с 2013 по 2020 годы ЭАП была выполнена 168 пациентам с гиперплазией простаты. Все операции были выполнены одной опытной хирургической бригадой. Для катетеризации простатических артерий применялись микропроводники 4 – 5 Fr и микрокатетеры 2 – 2,8 Fr. Для эмболизации использовали гидрогелевые микросферы диаметром 100 – 300 µm и 300 – 500 µm, а также микрочастицы ПВА диаметром от 100 до 500 µm.
Алгоритм предоперационного обследования включал в себя ТРУЗИ простаты, УЗИ мочевого пузыря с определением объёма остаточной мочи, определение уровня ПСА крови, урофлоуметрию, применение опросников I-PSS и QoL.
На предоперационном этапе для определения типа ангиоархитектоники простаты выполнялась МСКТ-ангиография органов малого таза. Конусно-лучевая КТ не применялась. На этапе освоения методики использовали алгоритм PROVISO и установку ориентировочного уретрального катетера. При необходимости применялось внутриартериальное введение микродоз вазодилататоров и разобщение анастомозов с помощью микроспирали.
Противопоказаниями к применению ЭАП были лекарственная непереносимость рентгенконтрастного препарата, а также выраженный атеросклероз и сосудистые аномалии развития в области бифуркации аорты, наружной и внутренней подвздошных артерий. Методы статистического анализа. Полученные результаты вносили в электронную базу данных в программе MS Excel. Использованы методы расчёта описательных статистик: частоты для качественных показателей, среднее, стандартное отклонение, минимальное и максимальное значения для количественных показателей. Статистическую обработку данных выполняли в программе IBM SPSS Statistics 25.
Результаты
Применение предоперационной МСКТангиографии в сочетании с интраоперационной цифровой субтракционной ангиографией позволило определить варианты отхождения простатической артерии у всех пациентов (168 пациентов, 336 сторон мужского таза). Одна простатическая артерия выявлена в 91,4% (307) тазовых сторон, две независимые ПА в 8,6% (29) случаев. Симметричный вариант отхождения простатических артерий с обеих сторон выявлен у 14,3% (24) пациентов, у остальных 85,7% (144) пациентов выявлена асимметричность с двух сторон.
Наиболее частым вариантом отхождения ПА была внутренняя срамная артерия (30,9%), за которой следовали передняя порция внутренней подвздошной артерии (27,9), нижняя ягодичная артерия (17,2%) и запирательная артерия (14,3%). Более редкими анатомическими вариантами была средняя прямокишечная артерия (5,4%) и верхняя пузырная артерия (2,3%) и др. (табл. 1).
Таблица 1. Варианты отхождения простатических артерий по С.А. Капранову [5]
Table 1. Variants of the prostatic artery discharge according to S.A. Kapranov [5]

Применение предоперационной МСКТангиографии в сочетании с интраоперационной цифровой субтракционной ангиографией позволило идентифицировать анастомозы простатической артерии с другими артериями малого таза у всех пациентов (168 пациентов, 336 сторон мужского таза). Отсутствие анастомозов простатических артерий выявлено в 75,5% (254) тазовых сторон, в 24,4% (82) тазовых сторон были выявлены анастомозы. Междолевые внутрипростатические анастомозы найдены в 10,1% (34) тазовых сторон, сообщение с a. dorsalis penis выявлено в 8% (27) случаев, с ректальными артериями – в 5,3% (18) тазовых сторон и с артериями мочевого пузыря – в 3,6% (12) случаев.
Билатеральная эмболизация простатических артерий была успешно выполнена в 146 (86,9%) случаях, у 22 (13,1%) больных в связи с анатомическими особенностями была выполнена унилатеральная ЭАП. Селективная эмболизация простатических артерий была применена в 17 случаях (10,1%), классическая суперселективная ЭАП выполнена в 67 случаях (39,9%), PErFecTEDэмболизация была успешно выполнена 84 пациентам (50%).
Наиболее частым осложнением ЭАП в раннем послеоперационном периоде была острая задержка мочи (ОЗМ): 28 (16,6%) пациентов, из которых 11 (6,5%) потребовалось выполнение троакарной цистостомии, а у 17 (10,2%) ОЗМ была разрешена на фоне консервативной терапии. В 23 (14,2%) случаях были выявлены осложнения, ассоциированные с непреднамеренной эмболизацией анастомозов простатических артерий, такие как боль в прямой кишке и / или появление прожилок крови в стуле (у 19 (11,3%) пациентов) и появление трофических язв на головке полового члена (5 (2,8%) пациентов).
Обсуждение
Ангиоархитектоника малого таза. Для улучшения эффективности и снижения количества осложнений суперселективной эмболизации артерий предстательной железы необходимо детальное понимание ангиоархитектоники малого таза. Органы малого таза кровоснабжаются ветвями внутренней подвздошной артерии (ВПА). Обычно это короткая (около 3 – 4 см в длину) артерия, которая разветвляется на два больших ствола – передний и задний, – дальнейшее разветвление которых очень вариабельно. Как правило, задний ствол даёт начало верхней ягодичной (a. glutea superior), подвздошно-поясничной (a. iliolumbalis) и боковым крестцовым артериям (a. sacralis lateralis). От переднего ствола отходят верхняя (a. vesicalis superior) и нижняя (НПА, a. vesicalis inferior) пузырные артерии, запирательная артерия (a. obturatorius), средняя прямокишечная (a. rectalis media), нижняя ягодичная (a. glutea inferior) и внутренняя половая (a. pudenda interna) артерии. Простатические артерии (ПА, a. prostatica) могут иметь множество вариантов отхождения, различаться по своему количеству и особенностям строения [6].
По данным T. Bilhim et al. [7] при изучении анатомии простатических артерий в группе из 75 пациентов наиболее частым вариантом отхождения a. prostatica было отхождение общим стволом с a. vesicalis inferior (везикопростатический ствол, tr. vesicoprostatici) от средней трети a. pudenda interna (34,1%). Далее по частоте встречаемости расположились отхождение общим стволом с a. vesicalis superior (20,1%), отхождение от общего ягодично-полового ствола (17,8%), от a. obturatorius (12,6%) и отхождение общим стволом с a. rectalis media (8,4%). Редким вариантом были нижняя ягодичная артерия (3,7%), добавочная половая артерия (1,9%) и верхняя ягодичная артерия (1,4%).
На основе анализа ангиоархитектоники малого таза у 173 пациентов A.M. de Assis et al. [8] под руководством F.C. Carnevale предложили анатомическую классификацию отхождения простатических артерий (табл. 2).
Таблица 2. Анатомическая классификация отхождения простатических артерий по F.C. Carnevale [8]
Table 2. Anatomical classification of the prostatic artery discharge according to F.C. Carnevale [8]

D. Maclean et al. [9] при анализе КТ-ангиографий малого таза у 110 пациентов сообщили о том, что только 48,2% (53/110) из них имели одинаковую конфигурацию артерий простаты с обеих сторон. Анализ ангиоархитектоники малого таза показал применимость классификации по Carnevale в клинической практике (табл. 3; рис. 1).
Таблица 3. Частота встречаемости анатомических типов простатической артерии по F.C. Carnevale [9]
Table 3. Occurrence frequency of the prostatic artery anatomical types according to F.C. Carnevale [9]

С.А. Капранов и соавт. [5] выделили 7 типов отхождения простатических артерий. Тип I: ПА берет своё начало от передней порции внутренней подвздошной артерии; Тип II: ПА отходит от запирательной артерии; Тип III: ПA отходит от ягодичной артерии; Тип IV: ПA берет своё начало от внутренней срамной артерии; Тип V: ПА отходит от средней прямокишечной артерии. Другие варианты отхождения простатической артерии были объединены в тип VI – VII (рис. 2). Состоятельность этой классификации была подтверждена практическими наблюдениями [10][11][12].
Кровоснабжение простаты обычно осуществляется двумя основными артериальными ветвями, а именно переднемедиальной или краниальной ветвью, которая питает центральную часть железы, включая среднюю долю, и заднебоковой или каудальной ветвью, которая кровоснабжает периферическую зону и верхушку (рис. 3). В большинстве случаев эти две ветви происходят из общего ствола, однако они могут возникнуть из независимых источников, что имеет важные технические последствия. T. Bilhim et al. [7] в своём наблюдении выявили одну простатическую артерию в 57% случаев и две независимых простатических артерий в остальных 43%.
Сами простатические артерии могут иметь выраженную извитость, а также быть поражены атеросклеротическими бляшками (рис. 4). G.F. Enderlein et al. [13] при анализе предоперационных КТ-ангиограмм и результатов ЭАП у 104 пациентов с гиперплазией простаты сообщили об увеличении потребности в рентгенконтрастном препарате и большем времени рентгеноскопии в группе пациентов с выраженной извитостью артерий малого таза. Также авторы отметили ухудшение технических результатов в группе пациентов с атеросклеротическим поражением устьев простатических артерий.
Анастомозы простатических артерий. Простатические артерии имеют анастомозы с другими артериями органов малого таза в 57% случаев [6]. Большинство из этих анастомозов характеризуются низкой текучестью и идентифицируются на ангиограмме только при инъекции рентгенконтрастного препарата под давлением. Однако некоторые из анастомозов могут быть клинически значимыми ввиду гемодинамической проходимости и сообщения с пузырными артериями, прямокишечными артериями, артериями полового члена и концевыми разветвлениями внутренней половой и запирательной артерии. Также возможно наличие внутрипростатических междолевых артериальных анастомозов [14] (рис. 5 – 8).
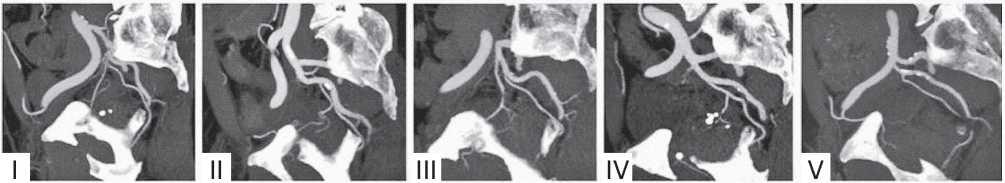
Рисунок 1. Анатомические варианты происхождения простатической артерии по F.C. Carnevale – типы I – V. Тип V в рассматриваемом случае – отхождение простатической артерии от запирательной артерии, исходящей из наружной подвздошной артерии [9]
Figure 1. Anatomical variants of the prostatic artery origin according to F.C. Carnevale, types I – V. Type V in this case – the a. prostatica arises from the a. obturatoria, which emanaties from the a. iliaca externa [9]

Рисунок 2. Варианты анатомии простатических артерий: 1) a. prostatica от a. pudenda interna, 2) a. prostatica от a. vesicalis inferior, 3) a. prostatica от a. glutea inferior, 4) a. prostatica от a. rectalis media, 5) a. prostatica от a. obturatoria, 6) a. prostatica от a. glutea superior, 7) a. prostatica от a. vesicalis superior [5]
Figure 2. Variants of the prostatic arteries anatomy: 1) a. prostatica from a. pudenda interna, 2) a. prostatica from a. vesicalis inferior, 3) a. prostatica from a. glutea inferior, 4) a. prostatica from a. rectalis media, 5) a. prostatica from a. obturatoria, 6) a. prostatica from a. glutea superior, 7) a. prostatica from a. vesicalis superior [5]
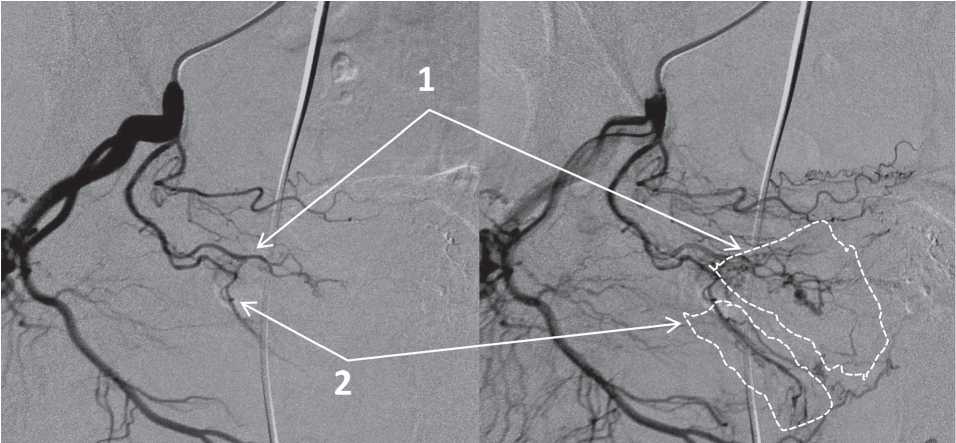
Рисунок 3. Краниальный простатический ствол (1) и каудальный простатический ствол (2), зоны их кровоснабжения
Figure 3. The cranial prostatic trunk (1) and the caudal prostatic trunk (2), areas of their blood supply
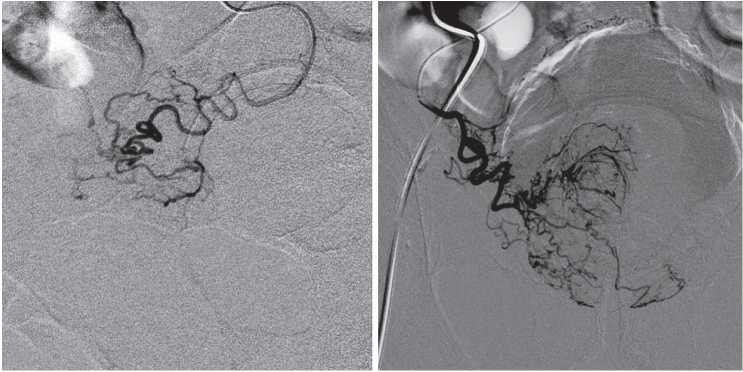
Рисунок 4. Выраженная извитость простатических артерий
Figure 4. The severe tortuosity of the prostatic arteries
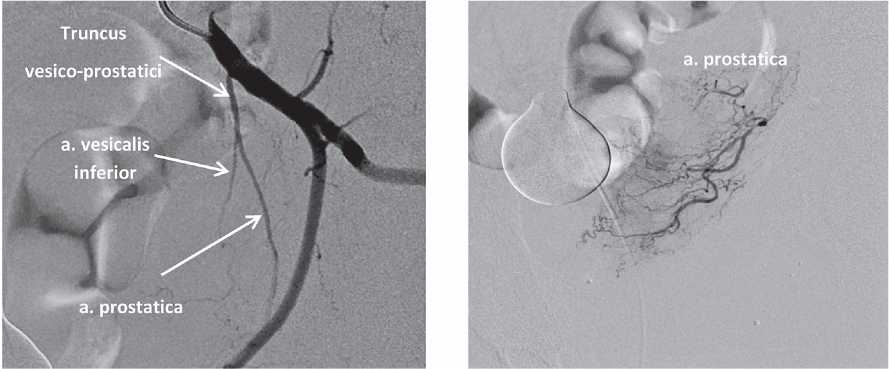
Рисунок 5. Анастомозирование простатической артерии с нижней пузырной артерией. Суперселективная катетеризация ПА
Figure 5. Anastomosis of the prostatic artery with the inferior vesical artery. The super-selective catheterization of the prostatic artery

Рисунок 6. Анастомозирование простатической артерии с прямокишечными артериями
Figure 6. Anastomosis of the prostatic artery with the rectal arteries

Рисунок 7. Анастомозирование простатической артерии с a. dorsalis penis
Figure 7. Anastomosis of the prostatic artery with the dorsal penile artery

Рисунок 8. Внутрипростатический междолевой анастомоз (А) и анастомоз a. prostatica с ветвями a. pudenda interna (В)
Figure 8. The intraprostatic interlobar anastomosis (А) and anastomosis of the prostatic artery with branches internal pudendal artery (В)
Нецелевая миграция эмболизационного препарата через эти анастомозы, а также ретроградный сброс эмболизационных частиц обусловливают клинические проявления данной группы осложнений.
Правильная предоперационная подготовка, планирование этапов операции и рациональная интраоперационная тактика позволяют улучшить результаты выполнения суперселективной эмболизации простатических артерий, а также избежать возможных осложнений.
Методы визуализации и навигации. Чрезвычайно сложная ангиоархитектоника малого таза, вариабельность отхождения простатических артерий, а также наличие анастомозов с другими артериями значительно затрудняют выполнение суперселективной эмболизации артерий предстательной железы. Поэтому для повышения эффективности и безопасности ЭАП большое значение имеет применение методов пред- и интраоперационной визуализации.
Для облегчения интраоперационной рентгеннавигации может быть применён алгоритм идентификации простатических артерий PROVISO (a. pudenda interna – внутренняя срамная артерия, a. rectalis media – средняя прямокишечная артерия, a. obturatoria – запирательная артерия, a. vesicalis Inferior – нижняя пузырная артерия, a. vesicalis superior – верхняя пузырная артерия и obligue view – косая проекция). На этапе освоения ЭАП также может использоваться установка ориентировочного уретрального катетера, баллон которого раздут разведённым рентгенконтрастным препаратом [9][15] (рис. 9).
Предоперационная визуализация с помощью МСКТ- и МРТ-ангиографии малого таза позволяет сократить длительность операции и время флюороскопии. D. Maclean et al. [8] сообщают об опыте сопоставления МСКТ-ангиографии с интраоперационной цифровой субтракционной ангиографией в группе из 110 пациентов. Простатическая артерия была успешно идентифицирована в 97,3% случаев. В отношении идентификации анастомозов МСКТ-ангиография продемонстрировала чувствительность в 59,0% и специфичность – в 94,2%. По данным A.Y. Kim et al. [16] с помощью МРТ-ангиографии удалось идентифицировать ПА в 79,4% случаев, в 87% случаев из них удалось правильно определить вариант отхождения простатической артерии.
Интраоперационное применение плоскодетекторной (ПДКТ) и конусно-лучевой компьютерной томографии увеличивает лучевую нагрузку на пациента, но позволяет более эффективно визуализировать анастомозы простатической артерии за счёт комбинирования КТ и таргетного контрастирования (рис. 10). В исследовании M.Q. Wang et al. [17] с участием 148 пациентов применение конусно-лучевой КТ позволило идентифицировать отхождение простатической артерии в 94,7% случаев и выявить её анастомозы у 97,0% пациентов. Конусно-лучевая КТ позволила получить клинически значимую информацию, которая не была доступна при цифровой субтракционной ангиографии у 90 из 148 (60,8%) пациентов. С.Г. Винцковский и соавт. [18] сообщили об успешном выполнении ЭАП в группе из 47 пациентов, у 19-ти из которых интраоперационно применяли плоскодетекторную компьютерную томографию. На фоне увеличения эффективной дозы излучения в группе ПДКТ было отмечено улучшение интраоперационной рентгеннавигации, сокращение времени флюороскопии, а также повышение функциональных результатов.

Рисунок 9. Идентификация простатических артерий по алгоритму PROVISO
Figure 9. Identification of the prostatic arteries using the PROVISO algorithm
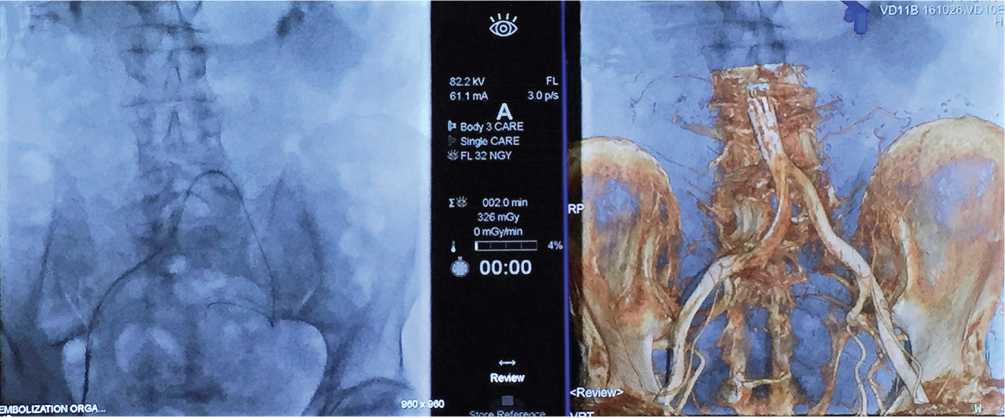
Рисунок 10. Параллельное интраоперационное применение рентгеноскопии и конусно-лучевой КТ с трёхмерным моделированием для визуализации ангиоархитектоники малого таза
Figure 10. The parallel intraoperative application of fluoroscopy and cone-beam computed tomography with 3D-modeling for visualization of pelvic angioarchitectonics
Заключение
Суперселективная эмболизация артерий предстательной железы – это малоинвазивный способ гиперплазии терапии простаты, обладающий высоким профилем безопасности. Артерии малого таза имеют крайне сложную анатомию, разные варианты отхождения, а также анастомозы с другими ветвями внутренней подвздошной артерии, что осложняет выполнение суперселективной эмболизации простатических артерий. Сочетание предоперационной МСКТ и интраоперационной цифровой субтракционной ангиографии позволяет идентифицировать простатическую артерию и её анастомозы в большинстве случаев.
Список литературы
1. Раснер П.И., Сивков А.В., Харчилава Р.Р. Доброкачественная гиперплазия предстательной железы: клинические рекомендации (утв. Минздравом России). М.: Российское общество урологов; 2020. Доступно по: https://cr.minzdrav.gov.ru/recomend/6_1 Ссылка активна на 13.07.2021.
2. EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam 2020. ISBN 978-94-92671-07-3
3. NICE Guidance – Prostate artery embolisation for lower urinary tract symptoms caused by benign prostatic hyperplasia: © NICE (2018) Prostate artery embolisation for lower urinary tract symptoms caused by benign prostatic hyperplasia. BJU Int. 2018;122(1):11-12. DOI: 10.1111/bju.14404
4. Неймарк А.И., Тачалов М.А., Неймарк Б.А., Торбик Д.В., Арзамасцев Д.Д. Интервенционная хирургия в лечении пациентов с доброкачественной гиперплазией и раком предстательной железы. Вестник урологии. 2015;(3):54-67. DOI: 10.21886/2308-6424-2015-0-3-54-67
5. Капранов С.А., Камалов А.А., Карпов В.К., Бобров Б.Ю., Златовратский А.Г., Хачатуров А.А. Эндоваскулярные вмешательства при доброкачественной гиперплазии предстательной железы. В кн.; Национальное руководство: в 3т. Рентгенэндоваскулярная хирургия. Под редакцией Б.Г. Алекяна. Москва: ООО "Издательство "Литтера", 2017.
6. Carnevale FC, Soares GR, de Assis AM, Moreira AM, Harward SH, Cerri GG. Anatomical Variants in Prostate Artery Embolization: A Pictorial Essay. Cardiovasc Intervent Radiol. 2017;40(9):1321-37. DOI: 10.1007/s00270-017-1687-0
7. Bilhim T, Pisco JM, Rio Tinto H, Fernandes L, Pinheiro LC, Furtado A, Casal D, Duarte M, Pereira J, Oliveira AG, O’Neil JE. Prostatic arterial supply: anatomic and imaging findings relevant for selective arterial embolization. J Vasc Interv Radiol. 2012;23:1403-15. DOI: 10.1016/j.jvir.2012.07.028
8. de Assis AM, Moreira AM, de Paula Rodrigues VC, Harward SH, Antunes AA, Srougi M, Carnevale FC. Pelvic Arterial Anatomy Relevant to Prostatic Artery Embolisation and Proposal for Angiographic Classification. Cardiovasc Intervent Radiol. 2015;38(4):855-61. DOI: 10.1007/s00270-015-1114-3
9. Maclean D, Maher B, Harris M, Dyer J, Modi S, Hacking N, Bryant T. Planning Prostate Artery Embolisation: Is it Essential to Perform a Pre-procedural CTA? Cardiovasc Intervent Radiol. 2018;41(4):628-32. DOI: 10.1007/s00270-017-1842-7
10. Kamalov A, Kapranov S, Neymark A, Kurbatov D, Neymark B, Karpov V, Shaparov B. Prostatic Artery Embolization for Benign Prostatic Hyperplasia Treatment: A Russian Multicenter Study in More Than 1,000 Treated Patients. Am J Mens Health. 2020;14(3):1557988320923910. DOI: 10.1177/1557988320923910
11. Карпов В.К., Капранов С.А., Шапаров Б.М., Осмоловский Б.Е., Камалов Д.М., Камалов А.А. Суперселективная эмболизация артерий предстательной железы в лечении ДГПЖ. Урология. 2019;3(3):134-41. DOI: 10.18565/urology.2019.3.134-141
12. Камалов А.А., Капранов С.А., Неймарк А.И., Курбатов Д.Г., Неймарк Б.А., Карпов В.К., Сорокин Н.И., Охоботов Д.А., Камалов Д.М., Шапаров Б.М. Суперселективная эмболизация артерий предстательной железы в лечении ДГПЖ. Москва, 2020.
13. Enderlein GF, Lehmann T, von Rundstedt FC, Aschenbach R, Grimm MO, Teichgräber U, Franiel T. Prostatic Artery Embolization-Anatomic Predictors of Technical Outcomes. J Vasc Interv Radiol. 2020;31(3):378-87. DOI: 10.1016/j.jvir.2019.09.005
14. Garcia-Monaco R, Garategui L, Kizilevsky N, Peralta O, Rodriguez P, Palacios-Jaraquemada J. Human cadaveric specimen study of the prostatic arterial anatomy: implications for arterial embolization. J Vasc Interv Radiol. 2014;25(2):315-22. DOI: 10.1016/j.jvir.2013.10.026
15. Carnevale FC, Antunes AA. Prostatic artery embolization for enlarged prostates due to benign prostatic hyperplasia. How I do it. Cardiovasc Intervent Radiol. 2013;36(6):1452-63. DOI: 10.1007/s00270-013-0680-5
16. Kim AY, Field DH, DeMulder D, Spies J, Krishnan P. Utility of MR Angiography in the Identification of Prostatic Artery Origin Prior to Prostatic Artery Embolization. J Vasc Interv Radiol. 2018;29(3):307-10.e1. DOI: 10.1016/j.jvir.2017.11.001
17. Wang MQ, Duan F, Yuan K, Zhang GD, Yan J, Wang Y. Benign Prostatic Hyperplasia: Cone-Beam CT in Conjunction with DSA for Identifying Prostatic Arterial Anatomy. Radiology. 2017;282(1):271-80. DOI: 10.1148/radiol.2016152415
18. Винцковский С.Г., Хотченков М.В., Учваткин Г.В. Безопасная и точная эмболизация. Использование плоскодетекторной компьютерной томографии при эмболизации артерий простаты. Материалы 5-й научно-практической конференции урологов Северо-Западного федерального округа РФ. 18–19 апреля 2019 года, Санкт-Петербург.
Об авторах
С. А. КапрановРоссия
Сергей Анатольевич Капранов - д.м.н., профессор
117997, г. Москва, ул. Островитянова, д. 1
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Г. Златовратский
Россия
Антон Григорьевич Златовратский – к.м.н.; заведующий отделением рентгенохирургических методов диагностики и лечения
119415, г. Москва, ул. Лобачевского, д. 42
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. К. Карпов
Россия
Валерий Кузьмич Карпов – к.м.н., доцент; доцент кафедры урологии и андрологии факультета фундаментальной медицины
119991, г. Москва, Ленинские горы, д. 1
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Б. М. Шапаров
Россия
Борис Мурадинович Шапаров – аспирант кафедры урологии и андрологии факультета фундаментальной медицины, врач-уролог медицинского научно-образовательного центра
119991, г. Москва, Ленинские горы, д. 1
тел.: +7 (925) 371-91-07
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. А. Камалов
Россия
Армаис Альбертович Камалов – академик РАН, д.м.н., профессор; заведующий кафедрой урологии и андрологии факультета фундаментальной медицины, директор медицинского научно-образовательного центра
119991, г. Москва, Ленинские горы, д. 1
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Капранов С.А., Златовратский А.Г., Карпов В.К., Шапаров Б.М., Камалов А.А. Варианты кровоснабжения простаты при выполнении суперселективной эмболизации простатических артерий. Вестник урологии. 2021;9(3):32-43. https://doi.org/10.21886/2308-6424-2021-9-3-32-43
For citation:
Kapranov S.A., Zlatovratskiy A.G., Karpov V.K., Shaparov B.M., Kamalov A.A. Types of the prostate blood supply during super-selective embolization of prostatic arteries. Urology Herald. 2021;9(3):32-43. (In Russ.) https://doi.org/10.21886/2308-6424-2021-9-3-32-43













































