Перейти к:
Уровень эпидермального фактора роста и его связь с лейкоцитами и тучными клетками при экспериментальном интерстициальном цистите/синдроме болезненного мочевого пузыря
https://doi.org/10.21886/2308-6424-2019-7-4-20-28
Аннотация
Введение. Причины и механизмы интерстициального цистита/синдрома болезненного мочевого пузыря (ИЦ/СБМП) остаются недостаточно изученными, патогенез заболевания все ещё не ясен, и этиология чётко не определена. Большой интерес вызывает роль эпидермального фактора роста (ЭФР). В связи со сложностью патофизиологии ИЦ/СБМП используются ряд моделей на животных, чтобы лучше понять механизмы этого заболевания.
Цель исследования. Определить уровень эпидермального фактора роста и его ассоциации с лейкоцитами и тучными клетками в тканях мочевого пузыря у животных с экспериментальными моделями интерстициального цистита/синдрома болезненного мочевого пузыря.
Материалы и методы. Моделирование ИЦ/СБМП проведено на 29 белых новозеландских кроликах-самках, которых разделили на 4 группы. ЭФР определяли в крови и моче методом иммуноферментного анализа (ИФА). Клеточные изменения в тканях определяли гистологическим методом.
Результаты. Высокий уровень ЭФР в моче выявлялся в 1 и 2 группе, превышающий показатель интактной группы на 33,3% (р<0,05) и 34,6% (р<0,05) соответственно. В 1 группе спустя 14 дней ЭФР снизился в крови на 16,2%, в моче ‒ на 35,5% (р<0,05). Во 2 группе уровень ЭФР повысился в крови (на 61,2%, р<0,01), в моче (на 28,7%). Наибольшее количество лимфоцитов выявлено у животных 2 группы (р<0,001). Тучные клетки определялись лишь в 1 и 2 группах, причем в последней их число было больше (р<0,001), чем в 1 группе. Сильная корреляционная взаимосвязь выявлена между значением ЭФР в крови и тучными клетками, а также между уровнем ЭФР в моче и эозинофилами в 1 группе. Во 2 группе отмечалась прямая слабая связь между концентрацией ЭФР в моче и количеством лимфоцитов и тучными клетками.
Выводы. Получено статистически значимое повышение ЭФР в крови и моче у животных с моделированным ИЦ/СБМП путем введения мочи в стенку мочевого пузыря. Этот вариант моделирования способствовал активизации тучных клеток в тканях мочевого пузыря. Выявлена ассоциация ЭФР с тучными клетками. Изменения уровней ЭФР могут быть связаны с ИЦ/СБМП.
Исследование не имело спонсорской поддержки. Автор заявляет об отсутствии конфликта интересов.
Ключевые слова
Для цитирования:
Шолан Р.Ф. Уровень эпидермального фактора роста и его связь с лейкоцитами и тучными клетками при экспериментальном интерстициальном цистите/синдроме болезненного мочевого пузыря. Вестник урологии. 2019;7(4):20-28. https://doi.org/10.21886/2308-6424-2019-7-4-20-28
For citation:
Sholan R.F. The Level of Epidermal Growth Factor and Its Relationship with Leukocytes and Mast Cells in Experimental Interstitial Cystitis / Painful Bladder Syndrome. Urology Herald. 2019;7(4):20-28. (In Russ.) https://doi.org/10.21886/2308-6424-2019-7-4-20-28
Введение
Интерстициальный цистит или синдром болезненного мочевого пузыря является одним из распространённых урологических заболеваний, характеризующийся частотой и императивностью мочеиспускания, хронической болью в мочевом пузыре и истончением или изъязвлением слизистой мочевого пузыря [1-3]. Патофизиология интерстициального цистита/синдрома болезненного мочевого пузыря может включать хроническое воспаление, повышенный апоптоз, дисфункцию уротелия и сенсибилизацию центральной нервной системы [4, 5]. Однако, несмотря на многочисленные исследования интерстициального цистита/синдрома болезненного мочевого пузыря, его причины и механизмы остаются недостаточно изученными. Патогенез заболевания все ещё не ясен, и этиология чётко не определена [2, 6, 7].
К сожалению, диагноз интерстициального цистита/синдрома болезненного мочевого пузыря ставится на основе оценки симптомов пациента. Однако вызывает большой интерес роль биомаркеров мочи в оценке интерстициального цистита/синдрома болезненного мочевого пузыря, одним из которых является эпидермальный фактор роста [8]. Высокие концентрации эпидермального фактора роста могут быть обнаружены в моче. На основании экспериментов in vitro было высказано предположение, что мочевой эпидермальный фактор роста происходит из ультрафильтрата. Однако in vivo у крыс и людей было показано, что мочевой эпидермальный фактор роста в основном вырабатывается почками. Полагают, что экскреция эпидермального фактора роста с мочой отражает продукцию его почками [8]. Снижение концентрации этого фактора в моче наблюдали при диабетической нефропатии, IgA-нефропатии, поликистозных заболеваниях почек у взрослых и у детей с хронической почечной недостаточностью, у детей с неблагоприятным течением хронического пиелонефрита [9, 10]. Считается, что концентрация эпидермального фактора роста в моче может служить суррогатным маркёром регенерации почечных канальцев, отражая их способность реагировать на будущие острые или хронические повреждения [9]. По результатам немногочисленных исследований концентрация эпидермального фактора роста в моче снижается с возрастом [9].
В связи со сложностью патофизиологии интерстициального цистита/синдрома болезненного мочевого пузыря используются ряд моделей на животных, чтобы лучше понять механизмы, лежащие в основе этого заболевания. Моделирование часто создаётся путём внутрипузырной инстилляции протамина сульфата, введением циклофосфамида и др. [11]. На протяжении более двух десятилетий в исследованиях интерстициального цистита/синдрома болезненного мочевого пузыря активно использовались модели животных с аутоиммунным воспалением мочевого пузыря [12, 13]. Исследования на животных показали, что за воспаление мочевого пузыря и боль в различных моделях ответственны тучные клетки [12]. Однако, несмотря на эти исследования, роль тучных клеток, связанных с циститом, не была идентифицирована.
Данные гистопатологии мочевого пузыря выявили роль клеточно-опосредованных иммунных механизмов в интерстициальном цистите/синдроме болезненного мочевого пузыря, что не исключают того, что аутоиммунное воспаление, вероятно, является компонентом патофизиологии в подгруппах пациентов с этим заболеванием [14].
Таким образом, хотя эпидермальный фактор роста, как один из трёх биомаркеров выявлен в моче пациентов с интерстициальным циститом/ синдромом болезненного мочевого пузыря, но клиническая значимость различий в уровнях эпидермального фактора роста в настоящее время неясна.
Цель исследования - определение уровня эпидермального фактора роста и его ассоциации с лейкоцитами и тучными клетками в тканях мочевого пузыря у животных с экспериментальными моделями интерстициального цистита/синдрома болезненного мочевого пузыря.
Материалы и методы
Моделирование ИЦ/СБМП проведено на 29 белых новозеландских кроликах-самках массой 1500-2000 г. При содержании животных и проведении экспериментальных исследований соблюдали правила по уходу и использования лабораторных животных (NIH Guide for the Care and Use of Laboratory Animals) [15].
Моделирование ИЦ/СБМП на кроликах было создано несколькими путями, в связи с чем животных разделили на 4 группы (табл. 1).
Таблица 1. Группы кроликов с моделированным ИЦ/СБМП
Table 1. Groups of rabbits with simulated IC/ BPS
№ группы исследования Study Group No. | Количество животных, n The number of animals, n | Моделирование ИЦ/СБМП Modeling IC/ BPS |
|---|---|---|
1 группа Group 1 | 5 | введение протамина сульфата в полость мочевого пузыря administration of protamine sulfate into the bladder cavity |
2 группа Group 2 | 10 | введение в стенку мочевого пузыря мочи, взятой из мочевого пузыря животного administration of urine taken from the animal's bladder into the bladder wall |
3 группа Group 3 | 7 | введение 0,9% раствора NaCl в стенку мочевого пузыря administration of sol. NaCl 0.9% into the bladder wall |
4 группа Group 4 | 7 | ничего не введено without administration |
Животных подвергали воздействию протамина сульфата, мочи, физ. раствора (NaCl). У животных 1 группы интерстициальный цистит/синдром болезненного мочевого пузыря был вызван внутрипузырной инстилляцией протамин сульфата (10 мг). У животных 2 группы модель этого заболевания создана на основе одной из этиологических теорий интерстициального цистита, согласно которой к поражению гликозаминогликанового слоя приводит мочевая токсичность [16]. Кроликам был сделан надлобковый разрез, после чего взятая из мочевого пузыря моча шприцем с иглой 30-го калибра в объёме 0,5 см3 введена под слизистый слой мочевого пузыря. Животным 3 группы в стенку мочевого пузыря вводили 10 мл NaCl. После введения мочи в стенку мочевого пузыря через 14 дней у кроликов отмечалась вялость, об интерстициальном цистите судили по цистоскопической картине, полученной при проведении цистоскопии.
Эпидермальный фактор роста определяли в крови и моче твердофазным иммуноферментным методом (ELISA) с помощью набора EGF (Cusabio Biotech Co., Ltd., Китай). Измерения проводили через 1 и 14 дней после создания экспериментальной модели.
Для оценки клеток в тканях, животных после 14 дней умерщвляли пентобарбиталом в дозе по 200 мг/ кг. После этого их рассекали с помощью трансабдоминального разреза по средней линии и выполняли цистэктомию. Взятые образцы ткани мочевого пузыря заключали в парафин; с помощью микротома готовили срезы толщиной 4 мкм. Затем образцы окрашивали гематоксилин-эозином для оценки количества лейкоцитов и толуидиновым синим для оценки тучных клеток. Для просмотра микропрепаратов использовали световой микроскоп Olympus Bx 50 и систему камер Olympus PM10SP. Каждое поперечное сечение было разделено на 10 участков, лейкоциты и инфильтрация тучных клеток оценивали в каждом из 10 участков с помощью следующей шкалы: 0 - нет экстраваскулярных лейкоцитов и тучных клеток; 1 - менее 20 лейкоцитов и тучных клеток; 2 - 20-45 лейкоцитов и тучных клеток; 3: - более 45 лейкоцитов и тучных клеток. Баллы всех 10 срезов складывали, делили на 30 (максимально возможный балл) и умножали на 100. Баллы по лейкоцитам и тучным клеткам для каждого мочевого пузыря были средними из 3 исследованных сечений. Подсчёт лейкоцитов и тучных клеток проводили при оптическом увеличении х 200 [17, 18].
Статистическая обработка полученных данных проведена с помощью программ «Statistica for Windows 8.0» и «Microsoft Excel». Рассчитаны среднее значение (average), стандартное отклонение среднего (Standard Deviation). Различия считали достоверными при значении p<0,05. Корреляционную зависимость между показателями рассчитывали по коэффициенту корреляции Пирсона.
Результаты
Результаты исследования уровня эпидермального фактора роста в экспериментальных группах представлены в таблице 2.
Таблица 2. Уровень эпидермального фактора роста в крови и моче в группах обследования в течение эксперимента
Table 2. The level of epidermal growth factor in the blood and urine in the survey groups during the experiment
Группы Groups | 1 сутки / day 1 | 14 сутки / day 14 | ||
|---|---|---|---|---|
Кровь, пг/мл Blood, pg / ml M ± m, [LQ; UQ] | Моча, пг/мл Urine, pg / ml M ± m, [LQ; UQ] | Кровь, пг/мл Blood, pg / ml M ± m, [LQ; UQ] | Моча, пг/мл Urine, pg / ml M ± m, [LQ; UQ] | |
1 (n=5) | 29,1±8,0 | 19,96±3,61* | 24,38±4,46 | 12,88±0,78** |
| [15,4; 43,2] | [13,8; 23,4] | [17,2; 35,0] | [11,6;14,1] |
2 (n=10) | 30,08±11,56 | 20,35±4,47* | 77,48±62,26*,** | 26,2±2,78* |
| [8,7; 56,2] | [11,6; 33,0] | [37,9; 388,8] | [20,8;33,0] |
3 (n=7) | 27,67±12,06 | 12,76±2,42 | 11,06±1,62*,** | 11,36±2,47 |
| [9,2; 44,2] | [6,7; 16,5] | [8,7; 15,4] | [6,7;14,7] |
4 (n=7) | 28,63±13,24 | 13,31±5,59 |
|
|
| [4,6; 41,5] | [5,6; 24,5] |
|
|
Примечание: * - статистическая значимость различий с 4 (контрольной) группой; ** - значимость различий между сроками исследования (р<0,05-0,001)
Notes: * - statistical significance of differences with group 4 (control); ** - significance of differences between the study periods (p <0.05-0.001)
Согласно данным исследования, через день после моделирования уровень эпидермального фактора роста в крови в экспериментальных группах относительно интактной группы существенно не различался. Значительных различий этого фактора в крови между моделями интерстициального цистита/синдрома болезненного мочевого пузыря также не отмечалось. Сравнительно высокий уровень эпидермального фактора роста в моче выявлялся у кроликов 1 и 2 группы, который превышал показатель интактной группы на 33,3% (р<0,05) и 34,6% (р<0,05) соответственно. У животных 3 группы концентрация этого показателя в моче в сравнении с интактной группой была незначительно снижена. Спустя 14 дней наиболее высокий уровень эпидермального фактора роста в крови и в моче определялся у животных 2 группы. У кроликов этой группы содержание эпидермального фактора роста в крови в сравнении с интактными животными было выше на 63,1% (р<0,01), в 3 группе уровень ЭФР был ниже на 61,3% (р<0,01). В данный срок наблюдения значение эпидермального фактора роста в моче в 1 и 3 группах было незначительно ниже интактной группы, а во 2 группе, напротив, выше на 49,2% (р<0,05). Сравнительный анализ уровня эпидермального фактора роста в группах через 1 и 14 дней показал снижение его концентрации в крови и в моче в 1 группе спустя 14 дней соответственно на 16,2% и 35,5% (р<0,05). Во 2 группе уровень эпидермального фактора роста повысился, причём, как в крови (на 61,2%, р<0,01), так и в моче (на 28,7%). В 3 группе динамика значения эпидермального фактора роста показала снижение в крови (на 50,2%, р<0,05) и в моче (на 12,3%).
При определении коэффициента корреляции в экспериментальных моделях между величинами эпидермального фактора роста в крови и моче выявлены положительные связи (рис. 1).
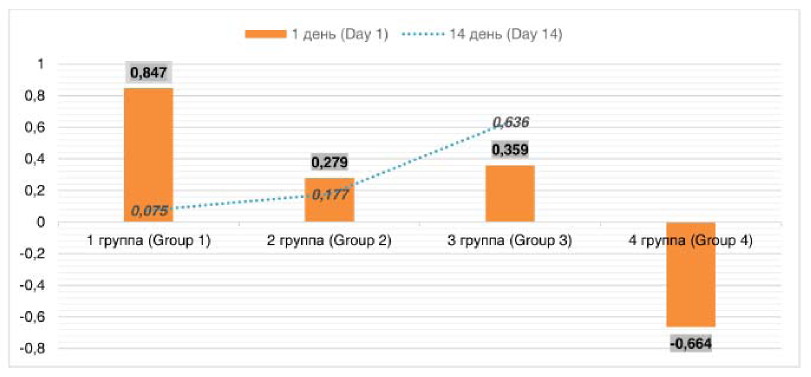
Рисунок 1. Коэффициент корреляции (r) между показателями эпидермального фактора роста в крови и моче в группах исследования
Figure 1. Correlation coefficient (r) between values of epidermal growth factor in blood and urine in study groups
Исследование в динамике свидетельствовало о снижении высокой прямой корреляции в 1 группе, наблюдаемой через день после моделирования, до очень слабой после 14 дней; во 2 группе корреляционная связь также ослаблялась, тогда как в 3 группе отмечалось усиление взаимосвязи от умеренной до заметной. В группе интактных животных показатели эпидермального фактора роста в крови и моче коррелировали обратной умеренной связью.
Исследование уровня типов лейкоцитов показало, что наибольшее количество нейтрофилов и эозинофилов определялось в ткани мочевого пузыря у животных 1 группы (табл. 3).
Таблица 3. Среднее количество лейкоцитов и тучных клеток в группах
Table 3. The average number of leukocytes and mast cells in study groups
Группы Groups | Типы клеток / Cell type | |||
|---|---|---|---|---|
Нейтрофилы Neutrophils M ± m, [LQ; UQ] | Лимфоциты Lymphocytes M ± m, [LQ; UQ] | Эозинофилы Eosinophils M ± m, [LQ; UQ] | Тучные клетки Mast cells M ± m, [LQ; UQ] | |
1 (n=5) | 50,625±11,147** [38; 69] | 16,875±5,330* [9; 25] | 5,625±3,777*,** [0; 11] | 0,25±0,707 [0; 2] |
2 (n=10) | 0,866±1,884 [0; 6] | 29,866±10,183*,** [12; 49] | 0,333±0,899 [0; 3] | 14,200±5,796** [3; 26] |
3 (n=7) | 1,428±2,699 [0; 7] | 2,285±3,728* [0; 10] | 0,142±0,377 [0; 1] | 0 |
4 (n=7) | 0 | 0,375±1,060 [0; 3] | 0,375±0,744 [0; 2] | 0 |
Примечание: * - статистическая значимость различий с 4 (контрольной) группой; ** - значимость различий между сроками исследования (р<0,05-0,001)
Notes: * - statistical significance of differences with group 4 (control); ** - significance of differences between the study periods (p <0.050.001)
Среднее число нейтрофилов и эозинофилов в этой группе статистически значимо превышало таковой во 2 и 3 группе, а также в 4 группе (р<0,001). Наибольшее количество лимфоцитов выявлено у животных 2 группы, что статистически значимо (р<0,001) выше, чем в остальных группах. Тучные клетки определялись лишь в 1 и 2 группах, причем в последней их число статистически значимо было больше (р<0,001), чем в 1 группе.
В 1 группе отмечалась положительная корреляция уровня эпидермального фактора роста в крови, в моче - отрицательная корреляция со всеми типами лейкоцитов и тучными клетками (табл.4). При этом сильная корреляционная взаимосвязь выявлена между значением эпи- дермаольного фактора роста в крови и тучными клетками, а также между его уровнем в моче и эозинофилами. Во 2 группе исследования умеренная отрицательная связь обнаруживалась между концентрацией эпидермального фактора роста в моче и количеством нейтрофилов. У животных этой группы отмечалась прямая слабая связь между концентрацией эпидермального фактора роста в моче и количеством лимфоцитов и тучными клетками. В 3 группе уровень эпидермального фактора роста в крови практически не коррелировал с лейкоцитами, лишь умеренная положительная связь отмечалась между его содержанием в моче и эозинофилами. У контактных кроликов определялась положительная умеренная корреляция эпидермального фактора роста с лимфоцитами и эозинофилами, причём с одинаковым значением в крови и моче.
Таблица 4. Коэффициент корреляции (r) эпидермального фактора роста с лейкоцитами и тучными клетками после 14 дней
Table 4. Correlation coefficient (r) of epidermal growth factor with white blood cells and mast cells after 14 days
Группы Groups | Типы клеток / Cell type | |||
|---|---|---|---|---|
Нейтрофилы кровь/моча Neutrophils blood / urine | Лимфоциты кровь/моча Lymphocytes blood / urine | Эозинофилы кровь/моча Eosinophils blood / urine | Тучные клетки кровь/моча Mast cells blood / urine | |
1 (n=5) | +0,391/-0,123 | +0,255/-0,424 | +0,459/-0,706 | +0,928/-0,250 |
2 (n=10) | -0,127 /-0,456 | -0,150/+0.242 | -0,166/ -0,168 | +0,002/+0,266 |
3 (n=7) | -/+0,010 | +0,029/+0,119 | -/+0,488 | - |
4 (n=7) | - | +0,434/-0,194 | +0,434/-0,194 | - |
Обсуждение
Таким образом, наиболее выраженные изменения уровня эпидермального фактора роста в крови и моче выявлены в группе модели интерстициального цистита/синдрома болезненного мочевого пузыря, созданной путём введения мочи из мочевого пузыря в его стенку. Нужно отметить, что эпидермальный фактор роста относится к группе факторов роста (цитокины) и представляет собой полипептид с молекулярной массой 6000, был впервые выделен в 1975 году [19]. Установлено, что эпидермальный фактор роста стимулирует рост, пролиферацию и дифференцировку клеток путём связывания со своим рецептором [9]. Показано, что эпидермальный фактор роста - это мощный митоген, стимулирует синтез мРНК, ДНК и белков эпителиальных клеток. Он локально продуцируется в нескольких тканях, таких как петля Генле и дистальные извитые канальцы в почках. В почках эпидермальный фактор роста участвует в восстановлении почечных тканей [9]. На модели острой почечной недостаточности на животных он оказался мощным стимулятором роста, регенерируя почечные канальцевые клетки и ускоряя восстановление нормальной функции почек [9]. Эпидермальный фактор роста защищает слизистую оболочку от повреждений, вызванных стрессом или различными некротизирующими агентами, такими как этанол [14].
Учитывая, что эпидермальный фактор роста является митогеном уротелиальных и гладкомышечных клеток и усиливают пролиферацию, а также является продуктом многих эпителиальных клеток [8], можно предположить, что повреждение глюкозаминогликанового слоя мочевого пузыря, который имел место при создании модели путём введения мочи в стенку мочевого пузыря, способствует повышению уровня эпидермального фактора роста, который стимулирует клеточную пролиферацию. Длительность такого состояния мочевого пузыря ещё более усиливает корреляционную связь между уровнем этого фактора в крови и моче, о чем свидетельствует коэффициент корреляции во 2 варианте экспериментальной модели после 14 дней исследования. У животных этой экспериментальной группы отмечалась высокая инфильтрация тучных клеток в ткани. В модели интерстициальный цистит/синдром болезненного мочевого пузыря, созданной путём введения в полость мочевого пузыря протамин сульфата, активация тучных клеток была незначительной.
Известно, что тучные клетки развивают фундаментальную защитную и иммунорегулятор- ную функцию, особенно на границе слизистой оболочки, способствуют врожденному и приобретенному иммунитету и являются важными эффекторными клетками в защите хозяина. Активация тучных клеток вызывает дегрануляцию и высвобождение медиаторов воспаления, включая, цитокины [14]. Универсальность тучных клеток подразумевает, что они могут быть активированы различными механизмами. Считается, что тучные клетки играют важную роль в интерстициальном цистите/синдроме болезненного мочевого пузыря, поскольку во многих случаях наблюдается увеличение количества тучных клеток в мочевом пузыре [14]. Исследования на животных показали, что тучные клетки незаменимы для развития воспаления мочевого пузыря и боли, наблюдаемой при интерстициальном цистите/синдроме болезненного мочевого пузыря [12].
В данном исследовании мы моделировали интерстициальный цистит/синдром мочевого пузыря введением в мочевой пузырь протамин сульфата, в стенку мочевого пузыря мочи и NaCl. Согласно нашим данным, тучные клетки в ткани мочевого пузыря существенно активизировались под воздействием мочевой токсичности.
Заключение
Настоящее исследование демонстрирует статистически значимое повышение эпидермального фактора роста в крови и моче у животных с моделированным интерстициальным циститом/синдромом болезненного мочевого пузыря путём введения мочи в стенку мочевого пузыря. Этот вариант моделирования способствовал активизации тучных клеток ткани мочевого пузыря. Выявлена ассоциация эпидермального фактора роста с тучными клетками при интерстициальном цистите/синдроме болезненного мочевого пузыря. Полученные данные показывают, что изменения уровней эпидермального факторов роста могут быть связаны с интерстициальным циститом/синдромом мочевого пузыря. Мы считаем, что выявленные корреляционные взаимосвязи указывают на причинно-следственные связи
Список литературы
1. Клиническая онкоурология. Под ред. Матвеева Б.П. М.: Kim SR, Moon YJ, Kim SK, Bai SW. NGF and HB-EGF: potenTIal biomarkers that reflect the effects of fesoterodine in paTIents with overacTIve bladder syndrome. Yonsei Med J. 2015;56(1):204-211. DOI: 10.3349/ymj.2015.56.1.204
2. Hanno PM, Erickson D, Moldwin R, Faraday MM; American Urological Association. Diagnosis and treatment of interstitial cystitis/bladder pain syndrome: AUA guideline amendment. J Urol. 2015;193(5):1545-1553. DOI: 10.1016/j. juro.2015.01.086
3. Gupta P, Gaines N, Sirls LT, Peters KM. A multidisciplinary approach to the evaluation and management of interstitial cystitis/bladder pain syndrome: an ideal model of care. Transl Androl Urol. 2015;4(6):611-619. DOI: 10.3978/j. issn.2223-4683.2015.10.10
4. Mullins C, Bavendam T, Kirkali Z, Kusek JW. Novel research approaches for interstitial cystitis/bladder pain syndrome: thinking beyond the bladder. Transl Androl Urol. 2015;4(5):524-533. DOI: 10.3978/j.issn.2223- 4683.2015.08.01
5. Jhang JF, Kuo HC. Pathomechanism of IntersTITIal CysTITIs/ Bladder Pain Syndrome and Mapping the Heterogeneity of Disease. Int Neurourol J. 2016;20(Suppl 2):S95-104. DOI: 10.5213/inj.1632712.356
6. Birder LA. Pathophysiology of intersTITIal cysTITIs. InternaTIonal Journal of Urology. 2019;26(Is1):12-15. DOI: 10.1111/ iju.13985
7. Lamb LE, Janicki JJ, Bartolone SN, Peters KM, Chancellor MB. Development of an intersTITIal cysTITIs risk score for bladder permeability. PLoS One. 2017;12(10):e0185686. DOI: 10.1371/journal.pone.0185686
8. Keay SK, Zhang CO, Shoenfelt J, Erickson DR, Whitmore K, Warren JW, Marvel R, Chai T. SensiTIvity and specifi city of anTIproliferaTIve factor, heparin-binding epidermal growth factor-like growth factor, and epidermal growth factor as urine markers for intersTITIal cysTITIs. Urology. 2001;57(6 Suppl 1):9-14. DOI: 10.1016/s0090-4295(01)01127-x
9. Meybosch S, De Monie A, Anné C, Bruyndonckx L, Jürgens A, De Winter BY, Trouet D, Ledeganck KJ. Epidermal growth factor and its infl uencing variables in healthy children and adults. PLoS One. 2019;14(1):e0211212. DOI: 10.1371/journal.pone.0211212
10. Каладзе Н.Н., Слободян Е.И., Говдалюк А.Л., Губка Л.И. Клиническое значение определения эпидермального фактора роста в крови и моче при пиелонефрите у детей. Российский вестник перинатологии и педиатрии. 2015;60(5):96-102. eLIBRARY ID: 24639730
11. Buffington T, Ruggieri MR, Klumpp D. IntersTITIal cysTITIs: Animal models. In Bladder Pain Syndrome ‒ An EvoluTIon. Springer InternaTIonal Publishing. 2017:33-36. DOI: 10.1007/978-3-319-61449-6_6
12. Bicer F, Altuntas CZ, Izgi K, Ozer A, Kavran M, Tuohy VK, Daneshgari F. Chronic pelvic allodynia is mediated by CCL2 through mast cells in an experimental autoimmune cysTITIs model. Am J Physiol Renal Physiol. 2015;308(2):F103-113. DOI: 10.1152/ajprenal.00202.2014
13. Altuntas CZ, Daneshgari F, Sakalar C, Goksoy E, Gulen MF, Kavran M, Qin J, Li X, Tuohy VK. Autoimmunity to uroplakin II causes cysTITIs in mice: a novel model of intersTITIal cysTITIs. Eur Urol. 2012;61(1):193-200. DOI: 10.1016/j.eururo.2011.06.028
14. Wang X, Liu W, O’Donnell M, Lutgendorf S, Bradley C, Schrepf A, Liu L, Kreder K, Luo Y. Evidence for the Role of Mast Cells in CysTITIs-Associated Lower Urinary Tract DysfuncTIon: A MulTIdisciplinary Approach to the Study of Chronic Pelvic Pain Research Network Animal Model Study. PLoS One. 2016;11(12):e0168772. DOI: 10.1371/journal.pone.0168772
15. Руководство по содержанию и использованию лабораторных животных. Пер. с англ. под ред. И.В. Белозерцевой, Д.В. Блинова, М.С. Красильщиковой. Москва: ИРБИС; 2017.
16. Sand PK. Proposed pathogenesis of painful bladder syndrome/interstitial cystitis. J Reprod Med. 2006;51(3 Suppl):234-240. PMID: 16676918
17. Bjorling DE, Jerde TJ, Zine MJ, Busser BW, Saban MR, Saban R. Mast cells mediate the severity of experimental cystitis in mice. J Urol. 1999;162:231-236. DOI: 10.1097/00005392-199907000-00073
18. Bayrak O, Seckiner I, Solakhan M, Karakok M, Erturhan SM, Yagci F. Effects of intravesical dexpanthenol use on lipid peroxidaTIon and bladder histology in a chemical cysTITIs animal model. Urology. 2012;79:1023-1026. DOI: 10.1016/j.urology.2012.01.025
19. Cohen S, Carpenter G. Human epidermal growth factor: isolaTIon and chemical and biological properTIes. Proc Natl Acad Sci USA. 1975;72(4):1317-1321. DOI: 10.1073/ pnas.72.4.1317
Об авторе
Р. Ф. ШоланАзербайджан
Рашад Фархад оглы Шолан ‒ доктор медицины, доктор философии по медицине; заведующий отделением «Почечные болезни и трансплантология»
тел.: +9 (94557) 740-8-14
Рецензия
Для цитирования:
Шолан Р.Ф. Уровень эпидермального фактора роста и его связь с лейкоцитами и тучными клетками при экспериментальном интерстициальном цистите/синдроме болезненного мочевого пузыря. Вестник урологии. 2019;7(4):20-28. https://doi.org/10.21886/2308-6424-2019-7-4-20-28
For citation:
Sholan R.F. The Level of Epidermal Growth Factor and Its Relationship with Leukocytes and Mast Cells in Experimental Interstitial Cystitis / Painful Bladder Syndrome. Urology Herald. 2019;7(4):20-28. (In Russ.) https://doi.org/10.21886/2308-6424-2019-7-4-20-28













































