Перейти к:
Инкрустирующий цистит, вызванный Corynebacterium urealyticum
https://doi.org/10.21886/2308-6424-2025-13-1-88-98
Аннотация
Инкрустирующий цистит представляет собой крайне редкую форму хронического воспаления мочевого пузыря, характеризующуюся кальцификацией стенки и ассоциированную с уреазопродуцирующими микроорганизмами, чаще всего с Corynebacterium urealyticum. Фермент уреаза запускает каскад расщепления мочевины на углекислый газ и аммиак, приводя тем самым к гипераммониурии и алкализации мочи уже в первые 24 часа. В таких условиях происходит гиперсатурация, благоприятная для формирования кристаллов струвитов и апатитов, инкрустирующих стенку мочевого пузыря. Наиболее значимыми предрасполагающими условиями и факторами риска для развития инкрустирующего цистита являются инородные тела в органах мочевыводящей системы, такие как уретральный катетер, нефростома, внутренние мочеточниковые стенты. Помимо этого, особое значение имеют эндоскопические операции на органах мочевыводящей системы в анамнезе. В данной статье мы представляем собственный клинический случай успешного лечения инкрустирующего цистита у мужчины после трансуретральной резекции предстательной железы.
Для цитирования:
Нестерова О.Ю., Дзитиев В.К., Сорокин Н.И., Стригунов А.А., Жестков И.А., Коробова А.Г., Кадрев А.В., Горбунов Р.М., Филатова Д.А., Камалов А.А. Инкрустирующий цистит, вызванный Corynebacterium urealyticum. Вестник урологии. 2025;13(1):88-98. https://doi.org/10.21886/2308-6424-2025-13-1-88-98
For citation:
Nesterova O.Yu., Dzitiev V.K., Sorokin N.I., Strigunov A.A., Zhestkov I.A., Korobova A.G., Kadrev A.V., Gorbunov R.M., Filatova D.A., Kamalov A.A. Encrusting cystitis caused by Corynebacterium urealyticum. Urology Herald. 2025;13(1):88-98. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-1-88-98
Введение
Инкрустирующий цистит представляет собой крайне редкую форму хронического воспаления мочевого пузыря, характеризующуюся кальцификацией стенки и ассоциированную с уреазопродуцирующими микроорганизмами [1]. Наличие уреазной активности у микроорганизма запускает процесс расщепления мочевины мочи на углекислый газ и аммиак, что заканчивается защелачиванием мочи и образованием кристаллов струвитов и апатитов, отложение которых приводит к инкрустации уротелия и язвенно-некротическому воспалению окружающих тканей [2]. Подобные изменения в мочевом пузыре ассоциированы с клинической манифестацией инкрустирующего цистита, которая чаще всего проявляется неспецифическими симптомами, такими как дизурия, боль в проекции мочевого пузыря, макрогематурия, обильная примесь слизи и мелких камней в моче [3].
Инкрустирующий цистит был впервые описан в 1914 году [4], в то время как предположение о возможной роли уреазопродуцирующих бактерий было высказано позднее, в 1925 году [5]. В последующем инкрустирующий цистит неоднократно описывался как «щелочной», однако длительное время микроорганизм, приводящий к развитию данного состояния, оставался неизвестным. Только спустя 70 лет после описания инкрустирующего цистита в 1985 году F. Soriano et al. удалось выделить как из мочи, так и из камней уреазопродуцирующий микроорганизм, названный Corynebacterium группы D2, а позднее — Corynebacterium urealyticum [6].
C. urealyticum представляет собой грамположительную мультирезистентную палочку, выявляемую на коже у 12% здоровых людей и у 30% госпитализированных пациентов, причём колонизация кожи более характерна для женщин [1], в то время как колонизация мочи — для мужчин. Патогенность C. urealyticumассоциирована с её высокой уреазной активностью, запускающей каскад расщепления мочевины на углекислый газ и аммиак, приводя тем самым к гипераммониурии и алкализации мочи уже в первые 24 часа. В таких условиях происходит гиперсатурация, благоприятная для формирования кристаллов струвитов и апатитов, инкрустирующих стенку мочевого пузыря [6][7].
Распространённость инкрустирующего цистита у реципиентов после трансплантации почки составляет 0,61% [8], в то время как аналогичные данные в общей популяции неизвестны в связи с редкостью данного заболевания. Крупнейшая работа, посвящённая эпидемиологии C. urealyticum, была выпущена в 1994 году. Исследователи выполнили микробиологическое исследование 20766 образцов мочи амбулаторных и стационарных пациентов, в 67 из которых (0,32%) определялась C. urealyticum. При этом только у 4 пациентов был выявлен инкрустирующий цистит, в то время как у 36 были обнаружены симптомы нижних мочевых путей [9].
Наиболее значимыми предрасполагающими условиями и факторами риска для развития инкрустирующего цистита являются инородные тела в органах мочевыводящей системы, такие как уретральный катетер, нефростома, внутренние мочеточниковые стенты. Помимо этого, особое внимание уделяется наличию эндоскопических операций на органах мочевыводящей системы в анамнезе. С учётом роста эндоскопических вмешательств преимущественно за последние 20 лет отмечается синхронный рост количества отдельных клинических случаев и серий наблюдений пациентов с инкрустирующим циститом [1].
Цель исследования. В данной статье мы представляем клинический случай инкрустирующего цистита у мужчины после трансуретральной резекции предстательной железы.
Клиническое наблюдение
Пациент Х, 69 лет. Жалобы на боли в нижних отделах живота, обильную примесь крови, слизи и камней в моче, учащённое мочеиспускание малыми порциями в дневное и ночное время (за ночь до 8 раз).
Летом 2021 года острая задержка мочи, установлен уретральный катетер, через 5 дней удалён, мочеиспускание восстановлено. Спустя полгода отмечено появление крови в моче, учащённое мочеиспускание малыми порциями, боли в нижних отделах живота. Госпитализирован по скорой медицинской помощи, выполнена трансуретральная резекция простаты, контактная цистолитотрипсия (гистологически: доброкачественная гиперплазия простаты). После операции жалобы на затруднённое мочеиспускание регрессировали, макрогематурия сохранялась. Через 1 месяц — рецидив затруднённого мочеиспускания. При УЗИ мочевого пузыря обнаружены конкременты, принимал Блемарен (лимонная кислота безводная — 1197,0 мг + калия гидрокарбонат — 967,5 мг + натрия цитрат безводный — 835,5 мг) — без эффекта. Летом 2022 года — макрогематурия, интенсивные боли в нижних отделах живота. По результатам УЗИ, конкременты мочевого пузыря, в левой почке конкременты до 1,6 см. Выполнена трансуретральная цистолитотрипсия, внутренняя оптическая уретротомия (интраоперационно выявлена стриктура мембранозного отдела уретры). Через месяц повторный эпизод острой задержки мочеиспускания, выявлены конкременты мочевого пузыря, вновь выполнена цистолитотрипсия. При неоднократном выполнении микробиологического исследования мочи на стандартных средах роста микроорганизмов не получено. С 2021 года пациент принимал ципрофлоксацин, левофлоксацин, норфлоксацин, фурагин, фосфомицин, цефтриаксон, цефуроксим, амоксициллин, в том числе с клавулановой кислотой.
В сентябре 2022 года пациент обратился в Университетскую клинику Медицинского научно-образовательного института (МНОИ) МГУ им. М.В. Ломоносова. По результатам УЗИ, простата — 20 см3, в левой почке множественные конкременты до 25 мм. В просвете мочевого пузыря в области шейки и в зоне клиновидного дефекта простаты определяются множественные гиперэхогенные включения, дающие акустическую тень (по типу кальциноза, общей протяжённостью около 40 мм). При перемене положения тела гиперэхогенные структуры не смещаются (рис. 1).
19.10.2022 выполнена уретроцистоскопия: визуализированы увеличенные боковые доли предстательной железы, в области шейки мочевого пузыря определяются плотно спаянные со слизистой мочевого пузыря конкременты до 50 мм в длину, рубцовая деформация шейки мочевого пузыря. Выполнена трансуретральная резекция (ТУР) гиперплазии простаты, цистолитотрипсия, инцизия шейки мочевого пузыря (рис. 2).
Через 2 недели после операции — макрогематурия, дискомфорт при мочеиспускании, учащённое мочеиспускание в дневное и ночное время. По результатам УЗИ мочевого пузыря определены аналогичные множественные гиперэхогенные включения по типу кальциноза размером до 40 мм в области шейки и клиновидного дефекта простаты. При ежедневной рН-метрии мочи — рН 8 – 9. При микробиологическом исследовании мочи на кровяном агаре выявлен рост C. urealyticum 105 КОЕ/мл, чувствительность представлена на рисунке 3.
Проведено лечение линезолидом в дозе 600 мг 2 раза в сутки внутривенно — 2 недели. Параллельно внутрипузырное закисление мочи раствором с рН 4, состоящим из лимонной кислоты (32,3 г), натрия гидрокарбоната (4,4 г), магния оксида (3,8 г) и очищенной воды до 1000 мл. Внутрипузырные инстилляции проводили ежедневно в течение двух недель: на 1 введение — 100 – 120 мл раствора. Через 2 недели терапии пациент отметил полный регресс симптомов. При ежедневной рН метрии мочи — рН 5 – 6. При УЗИ мочевого пузыря отмечено уменьшение размеров инкрустаций до 25 мм. В дальнейшем — пероральный приём линезолида 600 мг 2 раза в сутки в течение 1 месяца. Внутрипузырные инстилляции проводили 1 раз в 3 дня — 1 месяц. Кислотность мочи сохранялась в пределах 5 – 6. При повторном микробиологическом исследовании мочи на кровяной агар роста микроорганизмов не получено. Принято решение о завершении терапии.
Через 1 месяц после окончания фармакотерапии пациент отметил дискомфорт при мочеиспускании, появление слизи в моче, за помощью не обращался. При самостоятельном измерении рН наблюдал увеличение кислотности до 7 – 8. До апреля 2023 года жалобы прогрессировали. 01.04.2023 выполнена компьютерная томография (КТ) органов брюшной полости, забрюшинного пространства и малого таза. В полости пузыря визуализирована группа конкрементов размерами до 1 см плотностью около 600 HU (рис. 4).
В левой почке определяется коралловидный конкремент размером 32 × 16 мм плотностью около 500 HU, во всех чашечках определяются конкременты размером 3 – 8 мм плотностью около 500 – 550 HU (рис. 5). Чашечно-лоханочная система почек и мочеточники не расширены. Накопление и выведение контрастного препарата почками своевременное, равномерное.
При повторном микробиологическом исследовании мочи на кровяном агаре получен рост C. urealyticum 105 КОЕ/мл. При микроскопии окрашенных по Граму мазков, приготовленных из биоматериала и из колоний, выросших на плотных питательных средах, были обнаружены мелкие грамположительные палочки с характерным расположением под углом друг к другу в виде латинских букв V, Y, L или «китайских иероглифов», а также в виде «частокола» (рис. 6A). Культура C. urealyticum была получена только на питательных средах с добавлением бараньей крови. Через 48 часов культивирования выявлен пылевидный рост бактерий, для получения хорошо различимых точечных беловато-матовых гладких колоний диаметром 0,5 – 0,8 мм без гемолиза инкубация была продлена до 72 часов (рис. 6B). Выявлена устойчивость изолята C. urealyticum к бета-лактамным антибиотикам и ципрофлоксацину и чувствительность к клиндамицину, ванкомицину и линезолиду.
За 24 часа до очередной цистоскопии начата внутривенная инфузия линезолидом 600 мг каждые 12 часов. При цистоскопии в области шейки мочевого пузыря определены плотно спаянные со слизистой мочевого пузыря конкременты до 3 см в длину, выполнена цистолитотрипсия, произведено отделение конкрементов от слизистой. Микробиологическое исследование камней выявило бактерии в титре более 105 КОЕ/мл, аналогичные определённым в моче.
Уретральный катетер был удалён в первые сутки после операции. Учитывая нормализацию рН (рН 6 – 7), принято решение не выполнять внутрипузырное закисление мочи. С учётом чувствительности C. urealyticum к гентамицину проводили ежедневные внутрипузырные инстилляции 240 мг гентамицина в 100 мл физиологического раствора в течение 7 дней. При УЗИ мочевого пузыря через 7 дней в просвете мочевого пузыря в области шейки и в зоне клиновидного дефекта простаты определяются единичные мелкие гиперэхогенные включения, без выраженной акустической тени по типу мелких участков кальциноза. Конкрементов на момент осмотра в полости мочевого пузыря не выявлено (рис. 7).
На амбулаторном этапе продолжена терапия линезолидом перорально 600 мг 2 раза в сутки — 1 месяц, а также внутрипузырные инстилляции гентамицином 1 раз в неделю — 10 недель.
Через 3 недели пациенту была выполнена перкутанная нефролитотрипсия, интраоперационно были визуализированы рыхлые конкременты, не спаянные со слизистой лоханки. При посеве камня на кровяной агар роста микроорганизмов не получено.
Через 9 месяцев после перкутанной нефролитотрипсии, по данным УЗИ, в области шейки мочевого пузыря и в зоне клиновидного дефекта простаты определяются гиперэхогенные включения со слабой дистальной акустической тенью по типу участков фиброза. Данных об инкрустациях нет (рис. 8). Пациент находится в ремиссии на протяжении 12 месяцев после проведённого лечения.
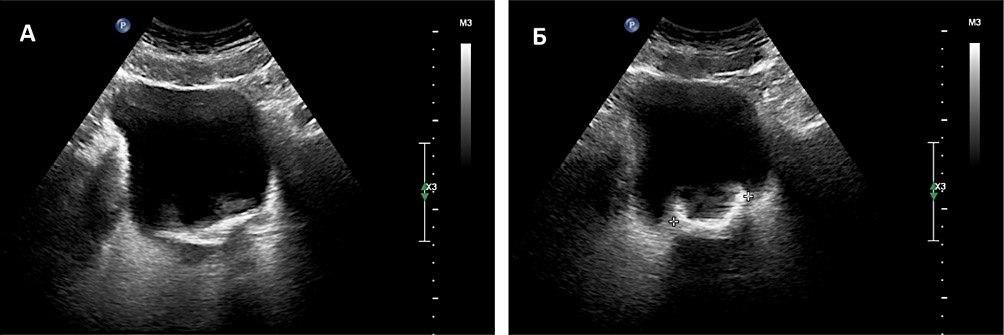
Рисунок 1. УЗИ мочевого пузыря: плотно спаянные со слизистой гиперэхогенные включения с акустической тенью в разных проекциях (А и В)
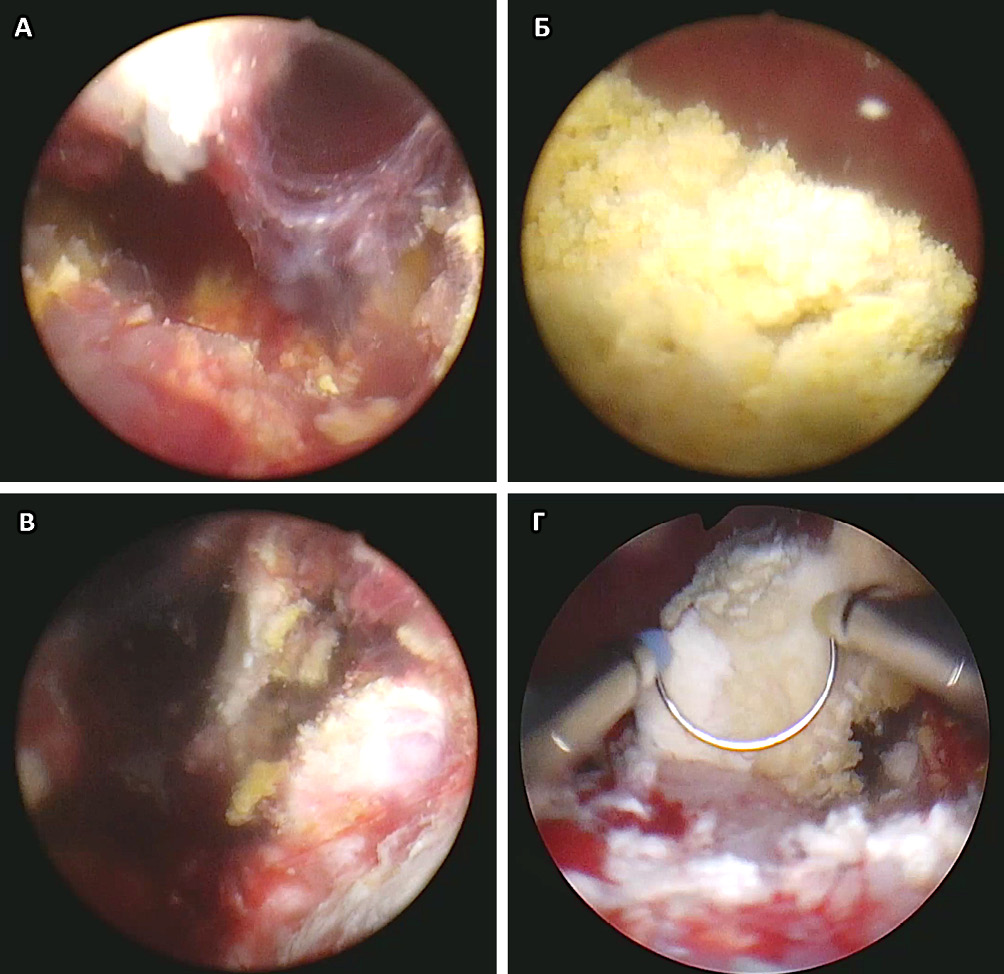
Рисунок 2. Трансуретральная резекция стенки мочевого пузыря с инкрустациями: А, C — плотно спаянные со слизистой мочевого пузыря инкрустации, покрытые слизью; В — общий вид инкрустаций; D — отделение инкрустаций от слизистой

Рисунок 3. Результаты микробиологического исследования мочи
Примечание: В текущих российских рекомендациях «Определение чувствительности микроорганизмов к антимикробным препаратам (версия 2024-02)» интерпретация результатов чувствительности Corynebacterium spp. к гентамицину и нитрофурантоину отсутствует
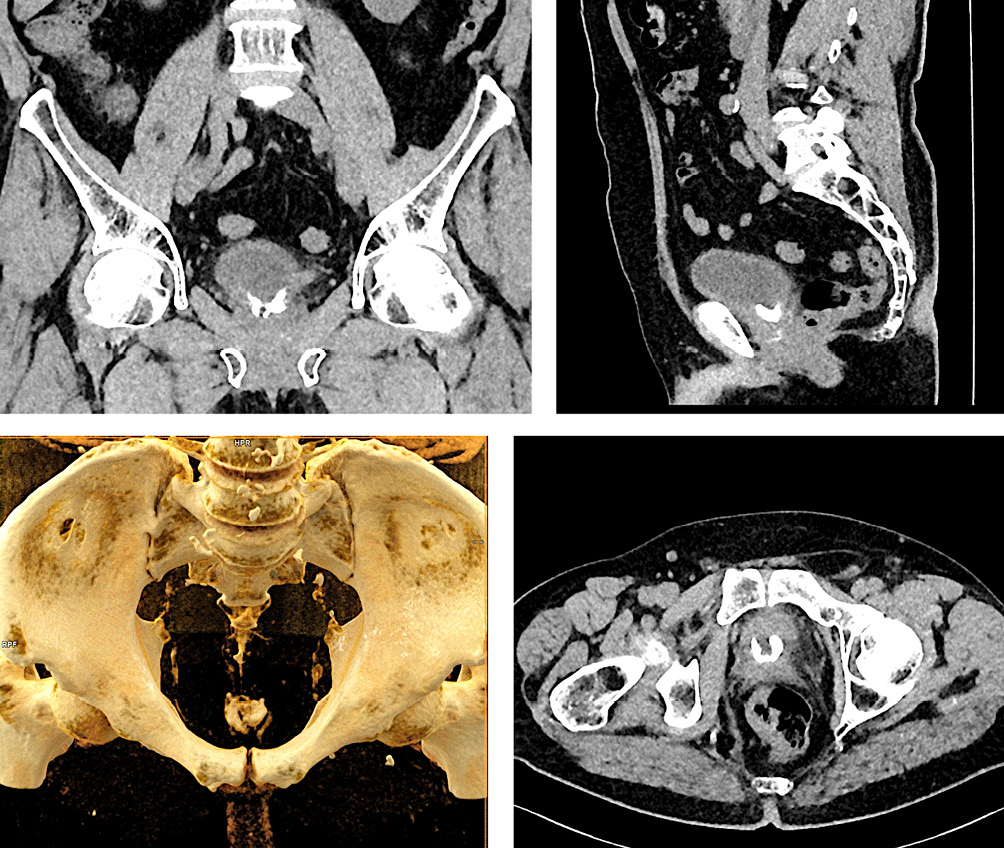
Рисунок 4. Компьютерная томография органов малого таза с наличием инкрустаций в мочевом пузыре: А — фронтальный скан; B — сагиттальный скан; C — 3D-реконструкция; D — аксиальный скан
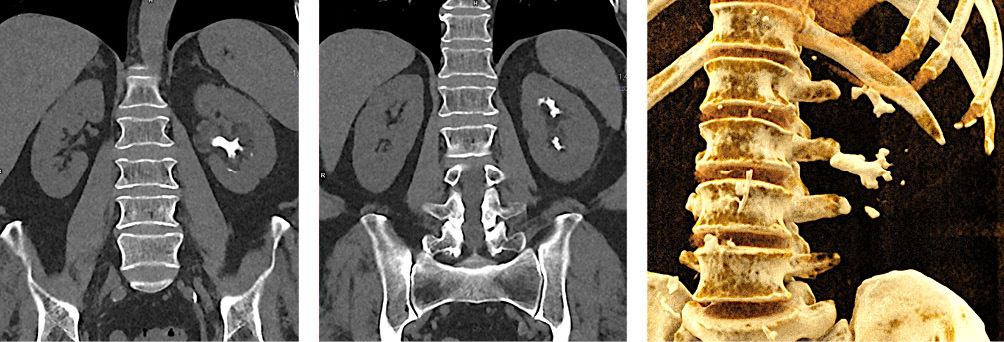
Рисунок 5. Компьютерная томография органов брюшной полости: А и В — камни левой почки, фронтальная реконструкция; С — камни левой почки, 3D-реконструкция
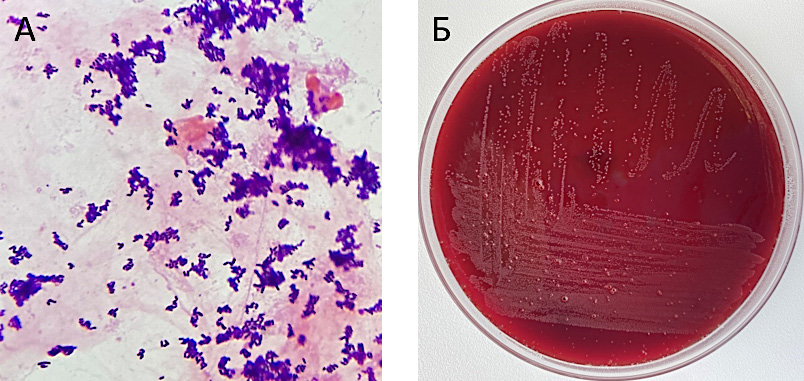
Рисунок 6. C. urealyticum: A — микроскопия биоматериала с окраской по Грам; В — рост на колумбийском агаре с добавлением бараньей крови после 72 часов инкубации в микроаэрофильных условиях при температуре 35°С
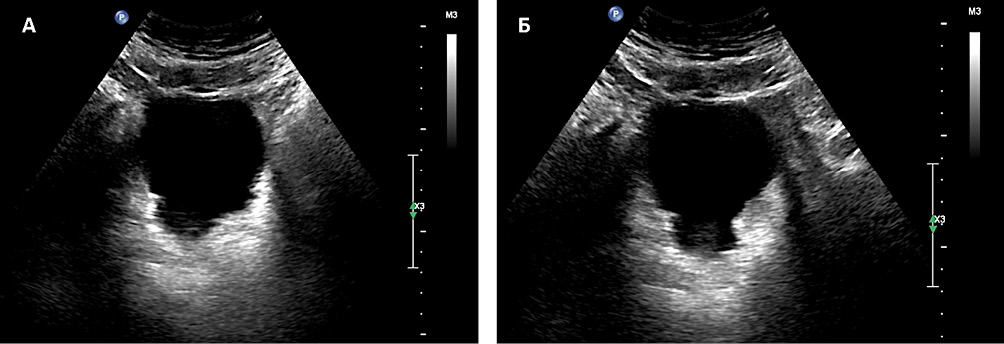
Рисунок 7. УЗИ мочевого пузыря с зоной клиновидного дефекта без инкрустаций через 7 дней после операции в разных проекциях (А и В)
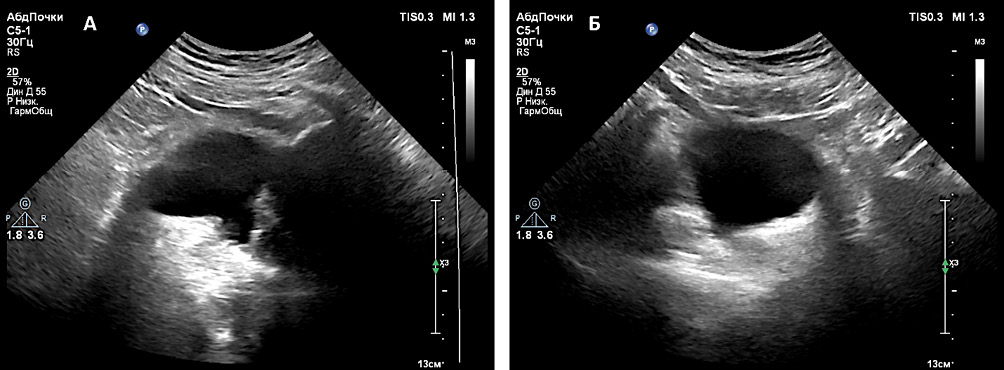
Рисунок 8. УЗИ мочевого пузыря с зоной клиновидного дефекта без инкрустаций через 9 месяцев после операции в разных проекциях (А и В)
Обсуждение
В большинстве случаев для инкрустирующего цистита патогномоничной является C. urealyticum, обладающая выраженной уреазной активностью в отличие от других представителей рода Corynebacterium, что было подтверждено результатами микробиологического исследования мочи и камней у пациента в настоящем клиническом наблюдении. C. urealyticum является медленно растущей грамположительной неспорообразующей палочкой, условно патогенной, и облигатно-аэробным микроорганизмом. Согласно данным F. Soriano et al. (1985, 1986), уже через 24 часа после совместной инкубации C. urealyticum с мочой экспериментальных животных после ятрогенного повреждения мочевого пузыря происходит формирование кристаллов струвитов и апатитов, увеличение концентрации аммония и повышение рН мочи [6][7].
Считается, что чаще всего C. urealyticum поражает иммунокомпрометированных пациентов, пациентов с хроническими заболеваниями или пациентов с большим количеством оперативных вмешательств в анамнезе [1], что было характерно и для нашего пациента: инкрустирующий цистит сформировался после трансуретральной резекции гиперплазии простаты. Возникающие при этом ишемия или некроз уротелия ассоциированы со снижением общего иммунитета слизистой оболочки мочевого пузыря, которая становится высокочувствительной к C. urealyticum, а формирующийся в последующем рубец может восприниматься организмом как инородное тело с отсутствием барьерных свойств [10].
Клиническая симптоматика инкрустирующего цистита в большинстве случаев является неспецифической. Чаще всего у пациентов отмечается учащённое мочеиспускание, ургентность, макрогематурия, боль над лоном, выделение песчинок и слизи с мочой [11]. Патогномоничным для инкрустирующего цистита является резкий аммиачный запах мочи и выраженное повышение рН вплоть до 9, в результате чего данное заболевание называют также щелочным циститом [12][13]. Характерные клинические симптомы имели место и у нашего пациента, а диагноз был подтверждён данными УЗИ мочевого пузыря, КТ органов малого таза и цистоскопической картиной, где выявлялись плотно спаянные со слизистой кальцификации.
Этиопатогенетическое лечение инкрустирующего цистита начинается чаще всего гораздо позже появления первых симптомов, что связано с трудностью выделения данного микроорганизма [3]. При рутинном микробиологическом исследовании мочи, ориентированном на выделение быстрорастущих неприхотливых уропатогенов, C. urealyticum обнаруживается крайне редко. Для увеличения частоты выявления данного возбудителя при наличии факторов риска и клинических проявлений инкрустирующего цистита у пациента нужно проводить прицельный поиск, который предполагает использование обогащённых питательных сред, создание микроаэрофильных условий инкубации и удлинение периода инкубации до 72 часов. В настоящей работе C. urealyticum высеивалась как в камнях, так и в моче при культивировании на кровяном агаре, что позволило назначить адекватную антибактериальную терапию.
Лечение инкрустирующего цистита должно состоять из трёх основных элементов: антибактериальной терапии, закисления мочи и удаления инкрустаций, содержащих биоплёнки возбудителя [11][14]. Выбор антибактериального препарата является одним из наиболее ответственных элементов лечения, что связывают с широким распространением резистентности среди изолятов C. urealyticum к исходно активным антимикробным препаратам. Согласно проспективному когортному исследованию F. López-Medrano et al. (2008), 5,3% штаммов C. urealyticum оказалось резистентно к рифампицину, 39,5% — к тетрациклину, 44,7% — к кларитромицину. Более 50% выделенных C. urealyticum было нечувствительно к пенициллину (76,3%), цефотаксиму (71,1%), норфлоксацину (84,2%), ципрофлоксацину (79%), азитромицину (65,8%), клиндамицину (86,4%), хлорамфениколу (76,3%), гентамицину (57,9%). При этом ни один из 38 выделенных штаммов C. urealyticum не был устойчив к ванкомицину и тейкопланину [15]. В большинстве описанных исследований препаратами выбора для лечения C. urealyticum являются гликопептиды, преимущественно ванкомицин и тейкопланин, эффективность которых не зависит от рН мочи [16]. В настоящем исследовании в качестве препарата выбора был использован линезолид в дозе 600 мг 2 раза в сутки (не обладающий нефротоксичностью в отличие от гликопептидов) и последующими внутрипузырными инстилляциями гентамицина, что позволило достичь стойкой ремиссии на протяжении 12 месяцев наблюдения за пациентом. Линезолид был успешно использован в составе комплексной терапии инкрустирующего цистита в отдельных клинических наблюдениях [17][18]. Инстилляции с гентамицином также описаны в качестве варианта лечения пациентов с инкрустирующим циститом [19][20].
Закисление мочи проводится как внутрипузырно, так и перорально. Для перорального закисления мочи может использоваться ацетогидроксаминовая кислота в дозе 15 мг/кг/сутки, ингибирующая активность уреазы и уменьшающая тем самым расщепление мочевины [11][21], или L-метионин в дозе 500 мг 2 раза в сутки [17]. Описаны случаи успешного длительного применения витамина С в качестве закисляющей терапии при инкрустирующем цистите, ассоциированном с C. urealyticum [22].
В качестве препаратов для внутрипузырного закисления мочи за рубежом чаще всего используются инстилляции закисляющими растворами, такими как растворы Thomas (глюконат натрия 27 г, лимонная кислота 27 г, яблочная кислота 27 г, дистиллированная вода 1000 мл), Suby G (лимонная кислота 32,3 г, карбонат натрия 4,4 г, магния оксид 3,8 г, дистиллированная вода 1000 мл), SOLITA T4 (хлорид натрия 0,585 г, лактат натрия 0,56 г, вода 500 мл) [17][23]. Эффективность использования данных растворов определяется их низкой кислотностью, составляющей около 4, что обеспечивает высокую растворимость кристаллов струвитов и апатитов, разрушающихся при рН < 5,5 [1]. Помимо этого описаны случаи успешного применения раствора Solita T1, состоящего из натрия, хлора, L-лактата и глюкозы с рН 3,5 – 6,5 [24], а также чистого раствора гидрокарбоната натрия [25].
Одним из наиболее важных этапов лечения является эндоскопическое удаление инкрустаций, содержащих биопленки C. urealyticum [1]. Однако в случае отсутствия необходимого периоперационного ведения пациентам часто требуются повторные трансуретральные резекции в связи с быстрым формированием кристаллов, образующихся в первые 24 часа инкубации C. urealyticum с мочой. В случае своевременной диагностики и патогенетически обоснованного лечения длительность комплексной терапии продолжается до полного исчезновения инкрустаций, нормализации кислотности мочи и получения отрицательного результата микробиологического исследования мочи при культивировании на питательных средах, содержащих баранью кровь [11], что и было проведено в рамках настоящей работы и позволило добиться стойкой ремиссии у пациента, которая на сегодняшний день продолжается на протяжении 12 месяцев без поддерживающей терапии.
Заключение
Таким образом, инкрустирующий цистит представляет собой крайне редкую форму хронического воспаления мочевого пузыря, характеризующуюся кальцификацией его стенки, наиболее частым возбудителем которого является Corynebacterium urealyticum — грамположительная мультирезистентная палочка. Патогенность C. urealyticum ассоциирована с её высокой уреазной активностью, запускающей каскад расщепления мочевины на углекислый газ и аммиак, что приводит к гипераммониурии и алкализации мочи уже в первые 24 часа. Предположение относительно наличия C. urealyticum в моче должно возникать в случае стерильной мочи по результатам микробиологического исследования с использованием стандартных сред, высоком рН мочи (как правило, до 9), кристаллурии, обнаружении инкрустаций по результатам визуализирующих методов диагностики. Выделение C. urealyticum требует культивирования в течения 48 – 72 часов при 37 °C на среде, обогащённой кровью или углекислым газом, однако описаны случаи обнаружения данного возбудителя только спустя 90 часов культивирования. Лечение инкрустирующего цистита должно быть комплексным и состоять из трёх основных элементов: антибактериальной терапии, закисления мочи и удаления инкрустаций, содержащих биоплёнки возбудителя.
Список литературы
1. Van de Perre E, Reichman G, De Geyter D, Geers C, Wissing KM, Letavernier E. Encrusted Uropathy: A Comprehensive Overview-To the Bottom of the Crust. Front Med (Lausanne). 2021;7:609024. DOI: 10.3389/fmed.2020.609024
2. Sakhi H, Join-Lambert O, Goujon A, Culty T, Loubet P, Dang J, Drouot S, de Bayser H, Michaud C, Ghislain L, Stehlé T, Legendre C, Joly D, Meria P, Zaidan M. Encrusted Urinary Tract Infections Due to Corynebacteria Species. Kidney Int Rep. 2020;6(1):179-186. DOI: 10.1016/j.ekir.2020.10.034
3. Loghmari A, Bouassida K, Belkacem O, Othmane MB, Hmida W, Jaidane M. The importance of surgical treatment in encrusted cystitis and pyelitis: A case report. Int J Surg Case Rep. 2020;77:392-396. DOI: 10.1016/j.ijscr.2020.11.003
4. François J. La cystite incrustée. J Urol Méd Chir. 1914;5:35-52.
5. Hager BH, Magath TB. The etiology of incrusted cystitis with alkaline urine. JAMA. 1925;85(18):1352-1355. DOI:10.1001/jama.1925.02670180008002
6. Soriano F, Ponte C, Santamaria M, Aguado JM, Wilhelmi I, Vela R, Delatte LC. Corynebacterium group D2 as a cause of alkaline-encrusted cystitis: report of four cases and characterization of the organisms. J Clin Microbiol. 1985;21(5):788-792. DOI: 10.1128/jcm.21.5.788-792.1985
7. Soriano F, Ponte C, Santamaría M, Castilla C, Fernández Roblas R. In vitro and in vivo study of stone formation by Corynebacterium group D2 (Corynebacterium urealyticum). J Clin Microbiol. 1986;23(4):691-694. DOI: 10.1128/jcm.23.4.691-694.1986
8. Aguado JM, Morales JM, Salto E, Lumbreras C, Lizasoain M, DiazGonzalez R, Martinez MA, Andres A, Praga M, Noriega AR. Encrusted pyelitis and cystitis by Corynebacterium urealyticum (CDC group D2): a new and threatening complication following renal transplant. Transplantation. 1993;56(3):617-622. DOI: 10.1097/00007890-199309000-00023
9. Nebreda-Mayoral T, Muñoz-Bellido JL, Garcia-Rodríguez JA. Incidence and characteristics of urinary tract infections caused by Corynebacterium urealyticum (Corynebacterium group D2). Eur J Clin Microbiol Infect Dis. 1994;13(7):600-604. DOI: 10.1007/BF01971313
10. Pollack HM, Banner MP, Martinez LO, Hodson CJ. Diagnostic considerations in urinary bladder wall calcification. AJR Am J Roentgenol. 1981;136(4):791-797. DOI: 10.2214/ajr.136.4.791
11. Fu JG, Xie KJ. Successful treatment of encrusted cystitis: A case report and review of literature. World J Clin Cases. 2020;8(18):4234-4244. DOI: 10.12998/wjcc.v8.i18.4234
12. Khan FR, Katmawi-Sabbagh S, England R, Al-Sudani M, Khan SZ. Alkaline cystitis - a delayed presentation post transurethral resection of prostate. A case discussion and literature review. Cent European J Urol. 2012;65(1):43-44. DOI: 10.5173/ceju.2012.01.art14
13. Zheng J, Wang G, He W, Jiang N, Jiang H. Imaging characteristics of alkaline-encrusted cystitis. Urol Int. 2010;85(3):364-367. DOI: 10.1159/000316552
14. Curry CR, Saluja K, Das S, Thakral B, Dangle P, Keeler TC, Watkin WG. Encrusted Cystitis Secondary to Corynebacterium glucuronolyticum in a 57-Year-Old Man Without Predisposing Factors. Lab Med. 2015;46(2):136-139. DOI: 10.1309/LMXQP557EINXBXIF
15. López-Medrano F, García-Bravo M, Morales JM, Andrés A, San Juan R, Lizasoain M, Aguado JM. Urinary tract infection due to Corynebacterium urealyticum in kidney transplant recipients: an underdiagnosed etiology for obstructive uropathy and graft dysfunction-results of a prospective cohort study. Clin Infect Dis. 2008;46(6):825-830. DOI: 10.1086/528713
16. Soriano F, Rodriguez-Tudela JL, Castilla C, Avilés P. Treatment of encrusted cystitis caused by Corynebacterium group D2 with norfloxacin, ciprofloxacin, and teicoplanin in an experimental model in rats. Antimicrob Agents Chemother. 1991;35(12):2587-2590. DOI: 10.1128/AAC.35.12.2587
17. Sabiote L, Emiliani E, Kanashiro AK, Balañà J, Mosquera L, SánchezMartín FM, Millán F, Alonso C, Palou J, Angerri O. Oral Acidification with l-Methionine as a Noninvasive Treatment for Encrusted Uropathy. J Endourol Case Rep. 2020;6(3):143-146. DOI: 10.1089/cren.2019.0164
18. Perrucci E, Lancellotta V, Benedetto MD, Palumbo I, Matrone F, Chiodi M, Lombi R, Marcantonini M, Mariucci C, Aristei C. Encrusted cystitis after definitive radiotherapy for cervical cancer: a case report. J Contemp Brachytherapy. 2016;8(6):541-543. DOI: 10.5114/jcb.2016.62958
19. Peiffer RF, Iulo C, LeCuyer T, Bolton T. Vasovagal reaction secondary to bladder overdistension in a dog undergoing a unique timeline of medical and surgical treatment for Corynebacterium urealyticum encrusting cystitis: a case report. BMC Vet Res. 2021;17(1):317. DOI: 10.1186/s12917-021-03028-z
20. Raab O, Béraud R, Tefft KM, Muckle CA. Successful treatment of Corynebacterium urealyticum encrusting cystitis with systemic and intravesical antimicrobial therapy. Can Vet J. 2015;56(5):471-5. PMID: 25969578; PMCID: PMC4399731.
21. Cappuccino L, Bottino P, Torricella A, Pontremoli R. Nephrolithiasis by Corynebacterium urealyticum infection: literature review and case report. J Nephrol. 2014;27(2):117-125. DOI: 10.1007/s40620-014-0064-1
22. González Guerrero JL, Mohedano Molano JM, García Martín L, Fernández Martín MA. Tratamiento conservador en un caso de cistitis incrustante [Conservative treatment in a case of encrusted cystitis]. Rev Esp Geriatr Gerontol. 2016;51(5):296-297. (In Spanish). DOI: 10.1016/j.regg.2015.11.004
23. Tanaka T, Yamashita S, Mitsuzuka K, Yamada S, Kaiho Y, Nakagawa H, Arai Y. Encrusted cystitis causing postrenal failure. J Infect Chemother. 2013;19(6):1193-1195. DOI: 10.1007/s10156-013-0603-z
24. Ito K, Takahashi T, Kanno T, Okada T, Higashi Y, Yamada H. Renal failure due to encrusted cystitis and pyelitis. IJU Case Rep. 2020;3(3):112-115. DOI: 10.1002/iju5.12158
25. Lansalot-Matras P, Dubourdieu B, Bosc R, Crenn G, Berthod N, Loriette M, Marchou B. Cystite incrustante à Corynebacterium urealyticum [Encrusted cystitis by Corynebacterium urealyticum]. Med Mal Infect. 2017;47(2):167-170. (In French). DOI: 10.1016/j.medmal.2016.11.004
Об авторах
О. Ю. НестероваРоссия
Ольга Юрьевна Нестерова — канд. мед. наук
Москва
В. К. Дзитиев
Россия
Виталий Казиханович Дзитиев — канд. мед. наук
Москва
Н. И. Сорокин
Россия
Николай Иванович Сорокин — д-р мед. наук
Москва
А. А. Стригунов
Россия
Андрей Алексеевич Стригунов — канд. мед. наук
Москва
И. А. Жестков
Россия
Жестков Иван Алексеевич
Москва
А. Г. Коробова
Россия
Анна Геннадьевна Коробова — канд. мед. наук
А. В. Кадрев
Россия
Алексей Викторович Кадрев — канд. мед. наук
Москва
Р. М. Горбунов
Россия
Роман Михайлович Горбунов
Москва
Д. А. Филатова
Россия
Филатова Дарья Андреевна
Москва
А. А. Камалов
Россия
Армаис Альбертович Камалов — д-р мед. наук, профессор, академик РАН
Москва
Рецензия
Для цитирования:
Нестерова О.Ю., Дзитиев В.К., Сорокин Н.И., Стригунов А.А., Жестков И.А., Коробова А.Г., Кадрев А.В., Горбунов Р.М., Филатова Д.А., Камалов А.А. Инкрустирующий цистит, вызванный Corynebacterium urealyticum. Вестник урологии. 2025;13(1):88-98. https://doi.org/10.21886/2308-6424-2025-13-1-88-98
For citation:
Nesterova O.Yu., Dzitiev V.K., Sorokin N.I., Strigunov A.A., Zhestkov I.A., Korobova A.G., Kadrev A.V., Gorbunov R.M., Filatova D.A., Kamalov A.A. Encrusting cystitis caused by Corynebacterium urealyticum. Urology Herald. 2025;13(1):88-98. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-1-88-98













































