Перейти к:
Микробиота мочепузырной мочи у детей с пузырномочеточниковым рефлюксом перед его оперативным лечением
https://doi.org/10.21886/2308-6424-2025-13-1-27-38
Аннотация
Введение. Инфекции мочевых путей (ИМП) часто встречаются у детей, особенно при анатомических аномалиях, таких как пузырно-мочеточниковый рефлюкс (ПМР). Диагностика ПМР обычно следует за эпизодом ИМП, что подчёркивает важность раннего выявления ПМР при ИМП для предотвращения почечных осложнений. Вопрос тактики ведения первой фебрильной ИМП остаётся спорным: педиатры рекомендуют диагностику после повторных ИМП, тогда как урологи настаивают на ранней визуализации и профилактике. Антибиотикопрофилактика (АБП) перед операцией помогает снизить риск рецидивов ИМП, но вызывает резистентность и изменяет микробиоту.
Цель исследования. Оценить микробиоту мочепузырной мочи у детей перед операцией по поводу ПМР.
Материалы и методы. В исследование включены 40 детей (12 мальчиков — группа 1, 28 девочек —группа 2), у которых ПМР выявлен после манифестной инфекции мочевых путей. Контрольные группы — 18 здоровых мальчиков (группа 3) и 16 здоровых девочек (группа 4). Сбор мочи и её культуральное исследование осуществляли с использованием расширенного набора питательных сред (10 – 12) для культивирования аэробных и анаэробных таксонов микробиоты.
Результаты. Медианный возраст пациентов с ПМР в исследуемых группах 3,6 года, причём среди них было больше девочек (p < 0,001). Моча детей с ПМР была нестерильной, в ней были обнаружены 27 таксонов микроорганизмов, из которых 16 — аэробы и 11 — анаэробы. Доминирующие таксоны различались по группам: у мальчиков с ПМР преобладали Enterobacterales, Peptococcus spp. и Anaerococcus spp., у девочек с ПМР — коагулазонегативные стафилококки, Corynebacterium spp. и Peptococcus spp. Большинство микроорганизмов обнаруживалось в ассоциациях. Медиана уровня бактериурии в основном составила 10² КОЕ/мл. В целом у здоровых детей и у пациентов с ПМР выявлено 29 таксонов микробиоты с доминированием аэробноанаэробных взаимосвязей. У пациентов с ПМР достоверных корреляционных связей между различными таксонами микробиоты мочи было больше, чем у здоровых детей.
Заключение. Мочепузырная моча у детей с ПМР содержит аэробные и анаэробные бактерии. Повышают ли ассоциации бактерий при бактериурии 10² КОЕ/мл риск ИМП при хирургии ПМР, ещё предстоит выяснить, однако дисбиоз мочепузырной мочи следует исследовать как возможный фактор риска ИМП. Необходимы дальнейшие исследования для обоснования целесообразности и подбора селективной АБП в лечении ПМР.
Ключевые слова
Для цитирования:
Набока Ю.Л., Сизонов В.В., Котиева Е.М., Глухова В.В., Гудима И.А., Кудря Е.В., Анопко А.И., Родина Р.А., Коган М.И. Микробиота мочепузырной мочи у детей с пузырномочеточниковым рефлюксом перед его оперативным лечением. Вестник урологии. 2025;13(1):27-38. https://doi.org/10.21886/2308-6424-2025-13-1-27-38
For citation:
Naboka Yu.L., Sizonov V.V., Kotieva E.M., Glukhova V.V., Gudima I.A., Kudryya E.V., Anopko A.I., Rodina R.A., Kogan M.I. Bladder urine microbiota in children with vesicoureteral reflux: preoperative values. Urology Herald. 2025;13(1):27-38. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-1-27-38
Введение
Инфекции мочевых путей (ИМП) являются одной из наиболее частых форм бактериального воспаления у детей, особенно в сочетании с анатомическими аномалиями мочевыводящих путей, в том числе с пузырно-мочеточниковым рефлюксом (ПМР) [1][2]. Микробиологическая оценка мочи у детей, страдающих ИМП, выявляет широкий спектр патогенов с преобладанием Escherichia coli, Proteus mirabilis, Klebsiella spp., Enterococcus spp. [1][3].
Одним из ключевых аспектов проблемы является то, что ПМР чаще всего диагностируется после эпизода(ов) ИМП, что указывает на тесную связь между этими состояниями, поэтому выявление ПМР на ранних этапах ИМП имеет важное клиническое значение, так как запоздалая диагностика сопряжена с высоким риском развития хронических почечных осложнений, включая рубцевание почек, артериальную гипертензию и в тяжёлых случаях — хроническую почечную недостаточность и рефлюкс-нефропатию [1][4][5].
Тактика ведения пациентов с неосложнённой первой фебрильной ИМП на сегодняшний день является предметом дискуссии [1][6]. Зачастую мнение педиатров, считающих необходимым проводить обширное обследование только после второй фебрильной ИМП, коренным образом расходится с таковым детских урологов, склоняющихся к незамедлительной визуализации и антибиотикопрофилактике (АБП) и / или хирургической коррекции в случае выявления ПМР [6].
АБП является важным компонентом тактики ведения детей с ПМР, особенно в периоде перед хирургической коррекцией ПМР. Она направлена на предотвращение ИМП и последующих инфекционных осложнений, которые могут ухудшить состояние пациента и повлиять на исход операции [6]. Однако эффективность длительной АБП остаётся вопросом открытым, как, впрочем, и сроки рациональной АБП [7][8]. В некоторых исследованиях подчёркивается неоспоримый вклад АБП в снижение частоты рецидивов ИМП у пациентов с ПМР [9], в то время как другие исследователи указывают на развитие устойчивости микроорганизмов к антибактериальным препаратам, что снижает эффективность лечения и увеличивает риск возникновения осложнений [10][11]. Ранее было отмечено, что даже кратковременное воздействие антибиотиков изменяет состав кишечной микробиоты, увеличивая относительное обилие условно-патогенных микроорганизмов и уменьшая долю таксонов, способствующих укреплению здоровья, что в итоге может быть сопряжено с потенциальными долгосрочными клиническими рисками [12]. Поэтому закономерно возникает вопрос о поисках альтернативы непрерывной АБП в виде более безвредных подходов.
Микробиологическая оценка мочи перед хирургической коррекцией ПМР является обязательным этапом для определения наличия активного инфекционного процесса и назначения соответствующего лечения [3][5]. Уровень бактериурии 10⁵ КОЕ/мл и более считается лабораторным подтверждением диагноза ИМП [5]. Но так ли это, если принять во внимание современные представления о микробиоте / микробиоме мочи у человека?
В этой связи цель настоящего исследования заключается в оценке микробиоты мочепузырной мочи перед операцией по поводу ПМР у детей.
Материалы и методы
В исследование включены 40 детей (12 мальчиков — группа 1, 28 девочек — группа 2), у которых ПМР выявлен после манифестной инфекции мочевых путей (одного или нескольких эпизодов).
Антенатально гидронефроз с двух сторон был выявлен у двух (5%) пациентов. Диагноз ПМР был поставлен пациентам в интервале от 1 до 147 месяцев. Медиана возраста — 28 [ 12; 72,5] месяцев. Двухсторонний рефлюкс был у 22 (55%) детей, левосторонний — у 13 (32,5%), правосторонний — у 5 (12,5%) пациентов. Рефлюкс I ст. диагностирован в 2 почечные единицы (ПЕ), II ст. — в 4 ПЕ, III — в 46 ПЕ, IV ст. — в 9 ПЕ. Активный ПМР выявлен в 16 ПЕ (17,5%), пассивный — в 2 ПЕ (5%), смешанный — в 42 ПЕ (77,5%). Всем пациентам было выполнено эндоскопическое лечение рефлюкса с использованием в качестве объём-образующих препаратов стабильных имплантов (рефлюксин — 26, DAM + — 9, вантрис — 5 детей). Возраст хирургического лечения 10 – 149 месяцев. Медиана возраста хирургического лечения — 60 [ 24; 91] месяцев.
В качестве контрольных групп послужили 18 здоровых мальчиков (группа 3) и 16 здоровых девочек (группа 4).
Критерии включения в исследование для групп 1 и 2: ПМР с неэффективной антибиотикопрофилактикой и повторением эпизодов ИМП и признаками прогрессии рефлюкс-нефропатии.
Критерии исключения для групп 1 и 2: ранее выполнявшиеся оперативные вмешательства на мочевых путях, пациенты, находящиеся на пролонгированном постоянном дренировании мочевого пузыря (эпицистостома, уретральный катетер) и периодической стерильной катетеризации мочевого пузыря.
Критерии включения в исследование для групп 3 и 4: первая группа здоровья, отсутствие структурных аномалий мочевой системы, отсутствие приёма каких-либо препаратов, в том числе антимикробных, в течение трёх месяцев до включения. Критерии исключения: текущая или рецидивирующая ИМП, дневное недержание мочи и / или ночной энурез, дисфункция кишечника.
Пациентам групп 1 и 2 забор мочи для бактериологического исследования осуществляли в операционной после обработки наружных половых органов растворами антисептиков путём введения в мочевой пузырь катетера Nelaton 8 Ch. Лейкоцитурия перед операцией имела место только у двух пациентов. Детям 3 и 4 групп производили забор средней порции утренней мочи. Сбор мочи и её культуральное исследование осуществляли в соответствии с клиническими рекомендациями РФ [13]. Помимо стандартных питательных сред были дополнительно использованы 10 – 12 питательных сред для аэробных и анаэробных таксонов микробиоты, соответственно, в аэробных и анаэробных условиях культивирования с последующей идентификацией [14].
Статистический анализ. Статистические расчёты проводили с применением статистического пакета IBM SPSS Statistics v.23.0 (SPSS: An IBM Company, IBM SPSS Corp., Armonk, NY, USA). Для микроорганизмов, выделенных из мочи, рассчитаны показатели и частоты обнаружения — абсолютное количество (n), доли в процентах (%). Степени обсеменённости (бактериурия) не подчиняются нормальному распределению (согласно критериям Колмогорова-Смирнова с коррекцией значимости Lilliefors и Shapiro-Wilk) и представлены значениями медианы (Ме) и квартилей [нижнего (LQ) – верхнего (UQ)]. Сравнение данных показателей выполнено с использованием непараметрического критерия Mann-Whitney. Для сравнения частот обнаружения микроорганизмов использован критерий хи-квадрат Pearson и точный критерий Fisher. Корреляционный анализ представлен коэффициентами взаимной сопряжённости Pearson для частот обнаружения микроорганизмов (с проверкой значимости по критерию хи-квадрат). Для принятия решений использованы уровни значимости p <0,01 и <0,05.
Результаты
Медианный возраст пациентов групп 1 и 2 составил 3,6 [ 1,9 – 7,11] года, мальчиков — 2,15 [ 1,53 – 8,38] года, девочек — 5,6 [ 2,11 – 7,11] года. По возрасту исследуемые группы достоверно не различались (p = 0,323), но по гендерному признаку девочек было достоверно больше, чем мальчиков (p < 0,001). Медианный возраст обследуемых групп 3 и 4 достоверно не отличался от аналогичных показателей групп 1 и 2 — 3,9 [ 2,2 – 8,42].
Моча пациентов групп 1 и 2 во всех случаях была нестерильна (табл. 1). В ней было обнаружено 27 таксонов микроорганизмов: 16 — аэробных и 11 — анаэробных. В группе 1 спектр микробиоты оказался уже (19), чем в группе 2 (25). Причём данный факт касался как аэробного, так и анаэробного кластеров микроорганизмов. Достоверных отличий частот обнаружения микроорганизмов в моче пациентов групп 1 и 2 не обнаружено, однако отмечены различия в доминировании таксонов в аэробном звене микробиоты. Так, в группе 1 преобладали представители порядка Enterobacterales (41,7%), в группе 2 — коагулазонегативные стафилококки (CNS) (53,6%) и Corynebacterium spp. (46,4%). В анаэробном кластере микроорганизмов в обеих группах доминировали Peptococcus spp. (по 41,7%), а в группе 1 с такой же частотой из мочи выделяли Anaerococcus spp. Медиана уровня бактериурии для большинства таксонов в исследуемых группах составила 10² КОЕ/мл, за исключением E.coli и Klebsiella spp., уровни которых были достоверно выше — 10² КОЕ/мл.
В моче пациентов групп 1 и 2 в большинстве случаев (75% и 96,4% соответственно) микроорганизмы присутствовали в составе бактериальных ассоциаций (рис. 1). Моноварианты выделены из мочи у трёх (25,0%) пациентов группы 1 и одного пациента (3,6%) группы 2. Причём в этих четырёх случаях в моче обнаруживали только Anaerococcus spp.
Логично предположить, что когда микроорганизмы в подавляющем большинстве случаев выделяются из мочи в составе различных вариантов многокомпонентных ассоциаций, то между ними бесспорно существуют эволюционно сложившиеся взаимосвязи. Так, в моче пациентов групп 1 и 2 было обнаружено 38 вариантов значимых коэффициентов взаимной сопряжённости Pearson (Кп) (из них 17 — в группе 1; и 21 — в группе 2), показывающих прямые прочные связи между различными таксонами микробиоты (табл. 2).
Достоверно чаще (p < 0,05) в моче пациентов обеих групп обнаруживаются корреляции между аэробными и анаэробными таксонами микробиоты (63,2%), значимо реже — между аэробными (29,0%) и только в группе 1 выявлены корреляции между отдельными таксонами анаэробной микробиоты (7,8%).
Частоты обнаружения различных таксонов микробиоты, верифицированных в моче пациентов с ПМР (группы 1 и 2) по сравнению с аналогичными показателями у здоровых детей (группы 3 и 4), представлены в таблице 3.
У пациентов группы 1 в сравнении со здоровыми мальчиками (группа 3) имеет место снижение частот присутствия в моче CoNS, энтерококков, коринебактерий на фоне достоверного повышения представителей порядка Enterobacterales и разнонаправленного изменения частот присутствия всех анаэробных бактерий.
У пациенток группы 2 в сравнении со здоровыми девочками (группа 4) отмечены разнонаправленные изменения частот присутствия в моче различных видов CNS, анаэробных бактерий при снижении частот обнаружения энтерококков, коринебактерий, E. coli.
У мальчиков достоверность изменений частот присутствия тех или иных бактерий в моче при ПМР в отличие от здоровых встречается чаще, чем у девочек.
Уровни бактериурии в группах 1 – 4 представлены в таблице 4.
Медиана уровней бактериурии для большинства таксонов мочи была 10² КОЕ/мл. Установлено равное количество таксонов мочи у здоровых мальчиков и при ПМР (по 20 видов бактерий), в то время как у девочек с ПМР выявлено 26 таксонов мочи в сравнении с 18 у здоровых за счёт расширения спектра как аэробных, так и анаэробных бактерий.
Достоверные различия для мальчиков и девочек зафиксированы для представителей Enterobacterales, уровни которых были повышены при ПМР. Кроме того, у девочек с ПМР были недостоверно снижены уровни лактобацилл в моче и незначительно повышены уровни Peptostreptococcus spp.
В целом из мочи детей 1 – 4 групп выделено 29 таксонов микробиоты: 17 — аэробных, 12 — анаэробных.
Наличие в моче широкого паттерна микроорганизмов в различных ассоциациях у здоровых детей и имеющих ПМР позволило обнаружить варианты достоверной взаимосвязи между ними (табл. 5).
В моче здоровых детей (группы 3, 4) обнаружены 29 статистически значимых корреляционных связей между микроорганизмами, из них 17 — в группе 3, 12 — в группе 4. В этих группах преобладали аэробно-анаэробные взаимосвязи (58,6%): 37,9% — в группе 3, 20,7% — в группе 4. Аэробно-аэробные достоверные корреляции обнаружены в обеих группах в 31,1% наблюдений, а анаэробно-анаэробные взаимосвязи — только в моче обследуемых группы 3 (10,3%).
В моче пациентов с ПМР (группы 1 и 2) обнаружено существенно больше (38) достоверных корреляционных связей, из них 44,7% — в группе 1, 55,3% — в группе 2 (табл. 2). Как и в моче здоровых детей, наблюдается доминирование аэробно-анаэробных (63,2%) взаимосвязей (группа 1 — 23,7%, группа 2 — 39,5%). Аэробно-аэробные корреляционные связи имели место в 29,0% случаев: группа 1 — 13,1%, группа 2 — 15,9%. Анаэробно-анаэробные (7,8%) были зарегистрированы в моче только пациентов группы 1.
Таким образом, у пациентов с ПМР достоверных корреляционных связей между различными таксонами микробиоты мочи больше, чем у здоровых детей, при доминировании аэробно-анаэробных взаимосвязей. Выявленные корреляционные взаимосвязи между микроорганизмами мочи здоровых детей и пациентов с ПМР являются уникальными. Как у здоровых детей, так и у детей с ПМР отсутствуют, как правило, достоверные связи между аналогичными таксонами. В моче здоровых детей и у пациентов с ПМР обнаружено только по одной достоверной взаимосвязи между аналогичными таксонами.
При анализе индивидуальных бактериограмм дисбиоз мочепузырной мочи выявлен в 65,0% случаев. Среди них в 40,0% наблюдений имели место изменения со стороны спектра микробов, то есть появление в моче микроорганизмов, не свойственных здоровым детям. А у 25,0% детей обнаружены повышенные относительно нормы уровни бактериурии. Дисбиоз оказался более характерен для девочек (61,5%), чем для мальчиков (38,5%).
Таблица 1. Частоты присутствия бактерий в моче и уровни бактериурии
Table 1. Frequencies of bacterial identification in urine and levels of bacteriuria
Микроорганизмы Microorganisms | Частота обнаружения (%) Detection frequency (%) | Уровень бактериурии (Me [LQ; UQ], КОЕ/мл) Bacteriuria level (Me [LQ; UQ], CFU/ml) | ||||
группа 1 group 1 | группа 2 group 2 | P* | группа 1 group 1 | группа 2 group 2 | U Манна-Уитни (р) U Mann-Whitney (p) | |
Corynebacterium spp. | 25,0 | 46,4 | 0,205 | 2 [ 2; 2] | 2 [ 2; 2] | 18,0 (0,631) |
CoNS | 25,0 | 53,6 | 0,096 | 2 [ 2; 2] | 2 [ 2; 2] | 21,0 (0,655) |
S. haemolyticus | 16,7 | 17,9 | 0,928 | 2 [ 2; 2] | 2 [ 2; 2,5] | 4,0 (0,527) |
S. saprophyticus | 8,3 | 10,7 | 0,818 | 2 [ 2; 2] | 2 [ 2; 2] | 1,5 (0,999) |
S. lentus | 8,3 | 25,0 | 0,227 | 2 [ 2; 2] | 2 [ 2; 2] | 3,5 (0,999) |
S. warneri | 8,3 | 3,6 | 0,527 | 2 [ 2; 2] | 2 [ 2; 2] | 0,5 (0,999) |
S. epidermidis | 0 | 3,6 | 0,507 | – | 2 [ 2; 2] | – |
S. coagulans | 0 | 3,6 | 0,507 | – | 2 [ 2; 2] | – |
S. aureus | 0 | 3,6 | 0,507 | – | 2 [ 2; 2] | – |
Micricoccus spp. | 0 | 7,1 | 0,342 | – | 2 [ 2; 2] | – |
Enterococcus spp. | 33,3 | 42,9 | 0,573 | 2 [ 2; 2] | 2 [ 2; 2,75] | 18,0 (0,286) |
Enterococcus undif. | 8,3 | 17,9 | 0,440 | 2 [ 2; 2] | 2 [ 2; 2,5] | 2,0 (0,655) |
E. faecalis | 16,7 | 25 | 0,563 | 2 [ 2; 2] | 2 [ 2; 4] | 5,0 (0,423) |
E. faecium | 8,3 | 7,1 | 0,896 | 2 [ 2; 2] | 2 [ 2; 2] | 1,0 (0,999) |
Enterobacterales | 41,7 | 32,1 | 0,563 | 5 [ 2,5; 5,5] | 5 [ 2; 6] | 22,5 (0,999) |
E. coli | 33,3 | 28,6 | 0,763 | 5 [ 2,75; 5,75] | 4 [ 2; 6] | 15,0 (0,859) |
Klebsiella spp. | 8,3 | 3,6 | 0,527 | 3 [ 3; 3] | 5 [ 5; 5] | 0,0 (0,317) |
P. aeruginosa | 0 | 3,6 | 0,507 | – | 2 [ 2; 2] | – |
C. tropicalis | 8,3 | 0 | 0,122 | 2 [ 2; 2] | – | – |
Lactobacillus spp. | 0 | 3,6 | 0,507 | – | 2 [ 2; 2] | – |
Bifidobacterium spp. | 0 | 3,6 | 0,507 | – | 2 [ 2; 2] | – |
Propionibacterium spp. | 33,3 | 35,7 | 0,885 | 2 [ 2; 2] | 2 [ 2; 2] | 18,0 (0,527) |
Eubacterium spp. | 16,7 | 32,1 | 0,315 | 3 [ 2; 3] | 2 [ 2; 4] | 8,0 (0,784) |
Bacteroides spp. | 8,3 | 0 | 0,122 | 2 [ 2; 2] | – | – |
Peptococcus spp. | 41,7 | 60,7 | 0,267 | 2 [ 2; 2] | 2 [ 2; 2] | 42,5 (0,999) |
Peptostreptococcus spp. | 8,3 | 3,6 | 0,527 | 2 [ 2; 2] | 3 [ 3; 3] | 0,0 (0,317) |
Anaerococcus spp. | 41,7 | 14,3 | 0,057 | 2 [ 2; 2] | 2 [ 2; 2,75] | 7,5 (0,264) |
Fusobacterium spp. | 8,3 | 7,1 | 0,896 | 2 [ 2; 2] | 2 [ 2; 2] | 0,5 (0,999) |
Veillonella spp. | 8,3 | 3,6 | 0,527 | 2 [ 2; 2] | 2 [ 2; 2] | 0,5 (0,999) |
Megasphaera spp. | 0 | 3,6 | 0,507 | – | 2 [ 2; 2] | – |
Примечание. * — уровень значимости для критерия хи-квадрат Pearson / Fisher Note. * — the significance level for the Pearson chi-square / Fisher | ||||||
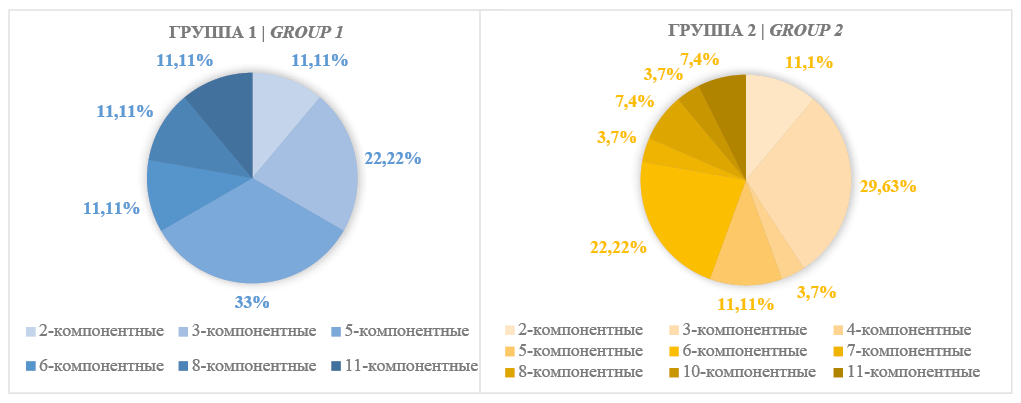
Рисунок 1. Структура бактериальных ассоциаций мочи
Figure 1. Pattern of bacterial urine associations
Таблица 2. Статистически значимые связи между частотами таксонов мочи у детей с ПМР
Table 2. Statistically significant relationships between the frequencies of urine taxa
Микроорганизмы | Microorganisms | Группа 1 | Group 1 | Группа 2 | Group 2 |
Corynebacterium spp. | – | S. lentus КП = 0,414 (р = 0,016) |
S. haemolyticus | S. saprophyticus КП = 0,559 (р = 0,020) Propionibacterium spp. КП = 0,535 (р = 0,028) Bacteroides spp. КП = 0,559 (р = 0,020) | S. coagulans КП=0,382 (р = 0,029) E. faecalis КП = 0,353 (р = 0,046) Peptococcus spp. КП = 0,351 (р = 0,047) Veillonella spp. КП = 0,382 (р = 0,029) Megasphaera spp. КП = 0,382 (р = 0,029) |
S. saprophyticus | E. faecalis КП = 0,559 (р = 0,020) Bacteroides spp. КП = 0,707 (р = 0,001) | S. aureus КП = 0,486 (р = 0,003) Peptococcus spp. КП = 0,396 (р = 0,023) Peptostreptococcus spp. КП = 0,486 (р = 0,003) |
S. lentus | S. warneri КП = 0,707 (р = 0,001) E. faecium КП = 0,707 (р = 0,001) | Peptococcus spp. КП = 0,421 (р = 0,014) Veillonella spp. КП = 0,707 (р = 0,001) Fusobacterium spp. КП = 0,707 (р = 0,001) |
S. epidermidis | – | Enterococcus undif. КП = 0,382 (р = 0,029) Anaerococcus spp. КП = 0,426 (р = 0,013) |
S. coagulans | – | Enterococcus undif. КП = 0,382 (р = 0,029) Megasphaera spp. КП = 0,707 (р < 0,001) |
S. aureus | – | Peptostreptococcus spp. КП = 0,707 (р < 0,001) |
Micrococcus spp. | – | Veillonella spp. КП = 0,570 (р < 0,001) |
Enterococcus undif. | Eubacterium spp. КП = 0,559 (р =0,020) | Lactobacillus spp. КП = 0,382 (р = 0,029) Propionibacterium spp. КП = 0,396 (р = 0,023) Megasphaera spp. КП = 0,382 (р = 0,029) |
E. faecalis | Bacteroides spp. КП = 0,559 (р = 0,020) | |
E. faecium | Veillonella spp. КП = 0,707 (р = 0,001) Fusobacterium spp. КП = 0,707 (р = 0,001) | – |
Propionibacterium spp. | Eubacterium spp. КП = 0,535 (р = 0,028) Peptococcus spp. КП =0,513 (р = 0,038) | |
Fusobacterium spp. | Veillonella spp. КП = 0,707 (р = 0,001) | |
Примечание. КП — приведены коэффициенты взаимной сопряжённости Pearson с расчётом уровней значимости по методу Monte Carlo (10000 выборок, 99% доверительный уровень) Note. КП — Pearson's coefficients of mutual conjugacy are given with the calculation of significance levels using the Monte Carlo method (10,000 samples, 99% confidence level) | ||
Таблица 3. Частоты обнаружения микроорганизмов в моче
Table 3. Detection frequency of microorganisms in urine
Микроорганизмы Microorganisms | Частоты обнаружения (%) Detection frequencies (%) | Р* | Частоты обнаружения (%) Detection frequencies (%) | Р* | ||
мальчики | boys | девочки | girls | |||||
группа 1 group 1 | группа 3 group 3 | группа 2 group 2 | группа 4 group 4 | |||
Corynebacterium spp. | 25,0 | 38,9 | 0,721 | 46,4 | 57,1 | 0,726 |
CoNS: | 25,0 | 72,2 | 0,038 | 53,6 | 50,0 | 0,851 |
S. haemolyticus | 16,7 | 27,8 | 0,544 | 17,9 | 14,3 | 0,232 |
S. saprophyticus | 8,3 | 5,6 | 0,483 | 10,7 | 7,1 | 0,385 |
S. lentus | 8,3 | 38,9 | 0,047 | 25,0 | 21,4 | 0,93 |
S. warneri | 8,3 | 11,1 | 0,527 | 3,6 | 21,4 | 0,032 |
S. epidermidis | 0 | 11,1 | 0,734 | 3,6 | 7,1 | 0,434 |
S. coagulans | 0 | 0 | 0 | 3,6 | 0 | 0,326 |
S. aureus | 0 | 5,6 | 0,37 | 3,6 | 14,3 | 0,027 |
Micrococcus spp. | 0 | 0 | 0 | 7,1 | 0 | 0,39 |
Enterococcus spp. | 33,3 | 38,9 | 0,537 | 42,9 | 64,3 | 0,328 |
Enterococcus undif. | 8,3 | 11,1 | 0,358 | 17,9 | 42,9 | 0,040 |
E. faecalis | 16,7 | 27,8 | 0,234 | 25,0 | 28,6 | 0,851 |
E. faecium | 8,3 | 11,1 | 0,524 | 7,1 | 0 | 0,39 |
Enterobacterales: | 41,7 | 16,7 | 0,041 | 32,1 | 35,7 | 0,391 |
E. coli | 33,3 | 16,7 | 0,039 | 28,6 | 35,7 | 0,432 |
Klebsiella spp. | 8,3 | 0 | 0,38 | 3,6 | 0 | 0,31 |
P. aeruginosa | 0 | 0 | 0 | 3,6 | 0 | 0,31 |
C. tropicalis | 8,3 | 0 | 0,38 | 0 | 7,1 | 0,392 |
C. krusei | 0 | 0 | 0 | 0 | 7,1 | 0,437 |
Lactobacillus spp. | 0 | 5,6 | 0,35 | 3,6 | 7,1 | 0,348 |
Bifidobacterium spp. | 0 | 0 | 0 | 3,6 | 0 | 0,31 |
Propionibacterium spp. | 33,3 | 27,8 | 0,522 | 35,7 | 57,1 | 0,278 |
Eubacterium spp. | 16,7 | 50 | 0,032 | 32,1 | 78,6 | 0,047 |
Bacteroides spp. | 8,3 | 0 | 0,38 | 0 | 0 | 0 |
Peptococcus spp. | 41,7 | 61,1 | 0,852 | 60,7 | 71,4 | 0,235 |
Peptostreptococcus spp. | 8,3 | 38,9 | 0,026 | 3,6 | 28,6 | 0,025 |
Anaerococcus spp. | 41,7 | 0 | 0,49 | 14,3 | 0 | 0,25 |
Fusobacterium spp. | 8,3 | 5,6 | 0,483 | 7,1 | 0 | 0,392 |
Veillonella spp. | 8,3 | 16,7 | 0,038 | 3,6 | 0 | 0,31 |
Megasphaera spp. | 0 | 0 | 0 | 3,6 | 0 | 0,31 |
Prevotella spp. | 0 | 5,6 | 0,37 | 0 | 0 | 0 |
Примечание. * — уровень значимости для критерия хи-квадрат Pearson / Fisher Note. * — the significance level for the Pearson chi-square / Fisher | ||||||
Таблица 4. Уровни бактериурии
Table 4. Bacteriuria levels
Микроорганизмы Microorganisms | Уровень бактериурии (Me [LQ; UQ], КОЕ/мл) | Bacteriuria level (Me [LQ; UQ], CFU/ml) | |||||
мальчики | boys | девочки | girls | |||||
группа 1 group 1 | группа 3 group 3 | U Манна-Уитни (р) U Mann-Whitney (p) | группа 2 group 2 | группа 4 group 4 | U Манна-Уитни (р) U Mann-Whitney (p) | |
Corynebacterium spp. | 2 [ 2; 2] | 2,43 [ 2; 3] | 6,0 (0,199) | 2 [ 2; 2] | 2,13 [ 2; 2] | 49,5 (0,722) |
CoNS | 2 [ 2; 2] | 2 [ 2; 2] | 19,5 (0,999) | 2 [ 2; 2] | 2 [ 2; 2] | 49,0 (0,495) |
S. haemolyticus | 2 [ 2; 2] | 2 [ 2; 2] | 5,0 (0,999) | 2 [ 2; 2,5] | 2 [ 2; 2] | 4,0 (0,527) |
S. saprophyticus | 2 [ 2; 2] | 2 [ 2; 2] | 0,5 (0,999) | 2 [ 2; 2] | 2 [ 2; 2] | 1,4 (0,999) |
S. lentus | 2 [ 2; 2] | 2 [ 2; 2] | 3,5 (0,999) | 2 [ 2; 2] | 2 [ 2; 2] | 10,5 (0,999) |
S. warneri | 2 [ 2; 2] | 2 [ 2; 2] | 1,0 (0,999) | 2 [ 2; 2] | 2 [ 2; 2] | 1,5 (0,999) |
S. epidermidis | 0 | 2 [ 2; 2] | – | 2 [ 2; 2] | 2 [ 2; 2] | 0,5 (0,999) |
S. coagulans | 0 | 0 | – | 2 [ 2; 2] | 0 | – |
S. aureus | 0 | 2 [ 2; 2] | – | 2 [ 2; 2] | 2 [ 2; 2] | 1,0 (0,999) |
Micrococcus spp. | 0 | 0 | – | 2 [ 2; 2] | 0 | – |
Enterococcus spp. | 2 [ 2; 2] | 2 [ 2; 2] | 14,0 (0,999) | 2 [ 2; 2,75] | 2 [ 2; 2] | 40,5 (0,115) |
Enterococcus undif. | 2 [ 2; 2] | 2 [ 2; 2] | 1,5 (0,999) | 2 [ 2; 2,5] | 2 [ 2; 2] | 10,0 (0,317) |
E. faecalis | 2 [ 2; 2] | 2 [ 2; 2] | 5,0 (0,999) | 2 [ 2; 4] | 2 [ 2; 2] | 10,0 (0,262) |
E. faecium | 2 [ 2; 2] | 2 [ 2; 2] | 1,0 (0,999) | 2 [ 2; 2] | 0 | – |
Enterobacterales | 5 [ 2,5; 5,5] | 2 [ 2; 2] | 2,5 (0,122) | 5 [ 2; 6] | 2 [ 2; 2] | 7,5 (0,026) |
E. coli | 5 [ 2,75; 5,75] | 2 [ 2; 2] | 2,0 (0,138) | 4 [ 2; 6] | 2 [ 2; 2] | 7,5 (0,036) |
Klebsiella spp. | 3 [ 3; 3] | 0 | – | 5 [ 5; 5] | 0 | – |
P. aeruginosa | 0 | 0 | – | 2 [ 2; 2] | 0 | – |
C. tropicalis | 2 [ 2; 2] | 0 | – | 0 | 3 [ 3; 3] | – |
C. krusei | 0 | 0 | – | 0 | 3 [ 3; 3] | – |
Lactobacillus spp. | 0 | 2 [ 2; 2] | – | 2 [ 2; 2] | 4 [ 4; 4] | 0,0 (0,317) |
Bifidobacterium spp. | 0 | 0 | – | 2 [ 2; 2] | 0 | – |
Propionibacterium spp. | 2 [ 2; 2] | 2 [ 2; 2] | 10,0 (0,999) | 2 [ 2; 2] | 2 [ 2; 2] | 36,0 (0,371) |
Eubacterium spp. | 3 [ 2; 3] | 2,78 [ 2; 3,5] | 8,0 (0,796) | 2 [ 2; 4] | 2,18 [ 2; 2] | 40,0 (0,341) |
Bacteroides spp. | 2 [ 2; 2] | 0 | – | 0 | 0 | – |
Peptococcus spp. | 2 [ 2; 2] | 2 [ 2; 2] | 27,5 (0,999) | 2 [ 2; 2] | 2,2 [ 2; 2] | 85,0 (0,999) |
Peptostreptococcus spp. | 2 [ 2; 2] | 2 [ 2; 2] | 3,5 (0,999) | 3 [ 3; 3] | 2,25 [ 2; 2,75] | 0,5 (0,221) |
Anaerococcus spp. | 2 [ 2; 2] | 0 | – | 2 [ 2; 2,75] | 0 | – |
Fusobacterium spp. | 2 [ 2; 2] | 2 [ 2; 2] | 1,0 (0,999) | 2 [ 2; 2] | 0 | – |
Veillonella spp. | 2 [ 2; 2] | 2 [ 2; 2] | 3,0 (0,999) | 2 [ 2; 2] | 0 | – |
Megasphaera spp. | 0 | 0 | – | 2 [ 2; 2] | 0 | – |
Prevotella spp. | 0 | 2 [ 2; 2] | – | 0 | 0 | – |
Таблица 5. Статистически значимые связи между микроорганизмами мочи у здоровых детей
Table 5. Statistically significant associations between urine microorganisms in healthy children
Микроорганизмы | Microorganisms | Группа 3 | Group 3 | Группа 4 | Group 4 |
Corynebacterium spp. | – | Propionibacterium spp. КП = 0,578 (р = 0,026) |
S. haemolyticus | S. lentus КП = 0,463 (р = 0,048) | E. coli КП = 0,480 (р = 0,040) Lactobacillus spp. КП = 0,562 (р = 0,011) C. tropicalis КП = 0,562 (р = 0,011) |
S. saprophyticus | – | S. lentus КП = 0,469 (р = 0,047) |
S. lentus | Propionibacterium spp. КП = 0,443 (р = 0,036) Eubacterium spp. КП = 0,495 (р = 0,016) | – |
S. warneri | Fusobacterium spp. КП = 0,566 (р = 0,004) | Lactobacillus spp. КП = 0,469 (р = 0,047) C. tropicalis КП = 0,469 (р = 0,047) |
S. epidermidis | Lactobacillus spp. КП = 0,566 (р = 0,004) | S. aureus КП = 0,562 (р = 0,011) |
S. aureus | Enterococcus undif. КП = 0,566 (р = 0,004) Veillonella spp. КП = 0,477 (р = 0,021) Prevotella spp. КП = 0,707 (р < 0,001) | Peptostreptococcus spp. КП = 0,542 (р = 0,016) S. epidermidis КП = 0,562 (р = 0,011) |
E. faecalis | E. faecium КП = 0,495 (р = 0,016) Eubacterium spp. КП = 0,527 (р = 0,031) Peptococcus spp. КП = 0,463 (р = 0,026) Peptostreptococcus spp. КП = 0,443 (р = 0,036) | – |
E. faecium | Propionibacterium spp. КП = 0,495 (р = 0,016) | – |
Lactobacillus spp. | – | C. tropicalis КП = 0,707 (р < 0,001) |
Propionibacterium spp. | Peptostreptococcus spp. КП = 0,443 (р = 0,036) | – |
Eubacterium spp. | Peptococcus spp. КП = 0,495 (р = 0,016) | C. krusei КП = 0,469 (р = 0,047) |
Veillonella spp. | Prevotella spp. КП = 0,477 (р = 0,021) C. tropicalis КП = 0,477 (р = 0,021) | – |
Примечание. КП — приведены коэффициенты взаимной сопряжённости Pearson с расчётом уровней значимости по методу Monte Carlo (10000 выборок, 99% доверительный уровень) Note. КП — Pearson's coefficients of mutual conjugacy are given with the calculation of significance levels using the Monte Carlo method (10,000 samples, 99% confidence level) | ||
Обсуждение
Первичный ПМР может осложняться ИМП у детей любого возраста. С другой стороны, рецидивирующие ИМП нередко обусловливают развитие вторичного ПМР. Так или иначе, ПМР и ИМП являются взаимообусловленными заболеваниями [3][4].
В этой связи продолжают обсуждаться различные аспекты ИМП: эффективность антибиотикопрофилактики при стерильном ПМР [10][15], риски развития ИМП при мониторировании стерильного ПМР [16], выбор антибиотика при эмпирическом лечении симптомной ИМП, в том числе при остром пиелонефрите [5][17], и так далее. При этом в одних исследованиях обосновываются необходимость и целесообразность непрерывной пролонгированной антибиотикопрофилактики [9][10], в других — отрицаются [10][18] или ставятся под сомнение [1][4][19][20]. Вместе с тем подчёркиваются негативные последствия антибиотикопрофилактики в виде дисбиоза кишечного микробиома и культивирования в моче штаммов микроорганизмов с высокой антибиотикорезистентностью [7][12][15][21].
В этой связи подчёркивается необходимость разработки индивидуальных подходов к использованию АБП и оценки рисков рецидивов ИМП [20][22].
Итак, выявление инфекционного фактора при наличии ПМР является краеугольным камнем в выборе тактики ведения ребёнка [23][24]. Бактериологическое исследование мочи в этих случаях является основополагающим методическим подходом [8]. Но стандартные питательные среды нацелены на выявление довольно узкого круга уропатогенов. Это представители порядка Enterobacterales, энтерококки и несколько таксонов грампозитивной микробиоты [25][26].
Вместе с тем уже более десяти лет хорошо известно, что мочепузырная моча здоровых людей, в том числе детей различных возрастных групп, содержит широкий спектр аэробных и анаэробных бактерий [26], которые обладают рядом патогенных свойств при полном благополучии макроорганизма.
В связи с этим наше исследование было нацелено на выявление микробиоты мочепузырной мочи перед предстоящим хирургическим вмешательством по поводу ПМР у детей. Исследование выявило нестерильность мочи во всех 40 изученных случаях. При этом в моче доминировали вовсе не бактерии из порядка Enterobacterales и энтерококки, а коагулазоотрицательные стафилококки, коринебактерии, анаэробы. Спектр микробиоты мальчиков и девочек имел чёткие гендерные характеристики. Сравнение микробиоты мочи детей с ПМР и здоровых детей позволило обнаружить ряд достоверных отличий как по спектру микробиоты, так и по уровням бактериурии некоторых представителей аэробов и анаэробов. Потенциальные уропатогены в моче мальчиков и девочек имели достоверные и оригинальные взаимосвязи между собой в ассоциациях.
Важно обратить внимание на то, что подавляющее большинство таксонов микробиоты мочи у мальчиков и девочек имело уровень бактериурии 10² КОЕ/мл, который не выявляется при стандартном бактериологическом анализе. Тем не менее хорошо известно, что аэробы и анаэробы при бактериурии 10² КОЕ/мл способны вызывать острый пиелонефрит при обструкции верхних мочевых путей [27].
Таким образом, наше исследование вносит ценную информацию о том, что эндоскопическое лечение ПМР у детей происходит в условиях бактериальной обсеменённости мочи различными вариантами микробных ассоциаций, в основном аэробно-анаэробных. Данный факт важен и с той точки зрения, что более чем в 60% случаев у детей перед операцией имеется дисбиоз мочепузырной мочи.
Такая ситуация является тревожной, имея в виду возможные риски инфекционно-воспалительных осложнений после хирургии ПМР и при дальнейшем мониторинге больных.
И все-таки остаётся неясным вопрос о том, каково клиническое значение новых знаний о микробиоте мочи при хирургическом лечении ПМР. Хочется надеяться, что дальнейшие исследования позволят сформулировать доказательства необходимости селективной антибиотикопрофилактики в проблеме ПМР: когда, кому и какая АБП.
Заключение
Мочепузырная моча у детей с ПМР характеризуется как нестерильная среда с присутствием в ней широкого ряда аэробных и анаэробных таксонов. Являются ли ассоциации бактерий при бактериурии 10² КОЕ/мл фактором риска ИМП при хирургии ПМР, предстоит ещё выяснить. Бесспорно, что дисбиоз мочепузырной мочи перед оперативным вмешательством следует изучать в будущем как фактор риска ИМП.
Список литературы
1. Mattoo TK, Shaikh N, Nelson CP. Contemporary Management of Urinary Tract Infection in Children. Pediatrics. 2021;147(2):e2020012138. Erratum in: Pediatrics. 2022;150(4):e2022059259. DOI: 10.1542/peds.2020-012138
2. Millner R, Becknell B. Urinary Tract Infections. Pediatr Clin North Am. 2019;66(1):1-13. DOI: 10.1016/j.pcl.2018.08.002
3. Lotfollahzadeh S, Leslie SW, Aeddula NR. Vesicoureteral Reflux. 2024. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025. PMID: 33085409
4. Miyakita H, Hayashi Y, Mitsui T, Okawada M, Kinoshita Y, Kimata T, Koikawa Y, Sakai K, Satoh H, Tokunaga M, Naitoh Y, Niimura F, Matsuoka H, Mizuno K, Kaneko K, Kubota M. Guidelines for the medical management of pediatric vesicoureteral reflux. Int J Urol. 2020;27(6):480-490. DOI: 10.1111/iju.14223
5. Thergaonkar RW, Hari P. Current Management of Urinary Tract Infection and Vesicoureteral Reflux. Indian J Pediatr. 2020;87(8):625-632. DOI: 10.1007/s12098-019-03099-9
6. Hewitt IK, Roebuck DJ, Montini G. Conflicting views of physicians and surgeons concerning pediatric urinary tract infection: a comparative review. Pediatr Radiol. 2023;53(13):2651-2661. DOI: 10.1007/s00247-023-05771-x
7. Läckgren G, Cooper CS, Neveus T, Kirsch AJ. Management of Vesicoureteral Reflux: What Have We Learned Over the Last 20 Years? Front Pediatr. 2021;9:650326. DOI: 10.3389/fped.2021.650326
8. Olson P, Dudley AG, Rowe CK. Contemporary Management of Urinary Tract Infections in Children. Curr Treat Options Pediatr. 2022;8(3):192-210. DOI: 10.1007/s40746-022-00242-1
9. Damm T, Mathews R. The RiVUR Study Outcomes and Implications on the Management of Vesicoureteral Reflux. Arch Nephrol Ren Stud. 2022;2(1):1-5. PMID: 35928985; PMCID: PMC9348554
10. Morello W, Baskin E, Jankauskiene A, Yalcinkaya F, Zurowska A, Puccio G, Serafinelli J, La Manna A, Krzemień G, Pennesi M, La Scola C, Becherucci F, Brugnara M, Yuksel S, Mekahli D, Chimenz R, De Palma D, Zucchetta P, Vajauskas D, Drozdz D, Szczepanska M, Caliskan S, Lombet J, Minoli DG, Guarino S, Gulleroglu K, Ruzgiene D, Szmigielska A, Barbi E, Ozcakar ZB, Kranz A, Pasini A, Materassi M, De Rechter S, Ariceta G, Weber LT, Marzuillo P, Alberici I, Taranta-Janusz K, Caldas Afonso A, Tkaczyk M, Català M, Cabrera Sevilla JE, Mehls O, Schaefer F, Montini G; PREDICT Study Group. Antibiotic Prophylaxis in Infants with Grade III, IV, or V Vesicoureteral Reflux. N Engl J Med. 2023;389(11):987-997. DOI: 10.1056/NEJMoa2300161
11. Garin EH. Primary vesicoureteral reflux; what have we learnt from the recently published randomized, controlled trials? Pediatr Nephrol. 2019;34(9):1513-1519. DOI: 10.1007/s00467-018-4045-9
12. Morello W, D'Amico F, Serafinelli J, Turroni S, Abati I, Fiori J, Baskin E, Yalcinkaya F, Jankauskiene A, Pennesi M, Zurowska A, Becherucci F, Drozdz D, Mekahli D, Krzemien G, La Scola C, Taranta-Janusz K, Mehls O, Schaefer F, Candela M, Montini G. Low-Dose Antibiotic Prophylaxis Induces Rapid Modifications of the Gut Microbiota in Infants With Vesicoureteral Reflux. Front Pediatr. 2021;9:674716. DOI: 10.3389/fped.2021.674716
13. Клинические рекомендации «Бактериологический анализ мочи». М.; 2014.
14. Коган М.И., Набока Ю.Л., Гудима И.А., Рымашевский А.Н., Воробьева Н.В., Рымашевский М.А. Микробиота свежевыделенной средней порции мочи у женщин в I триместре беременности (пилотное исследование). Проблемы репродукции. 2023;29(5):73 78. DOI: 10.17116/repro20232905173
15. Autore G, Bernardi L, Ghidini F, La Scola C, Berardi A, Biasucci G, Marchetti F, Pasini A, Capra ME, Castellini C, Cioni V, Cantatore S, Cella A, Cusenza F, De Fanti A, Della Casa Muttini E, Di Costanzo M, Dozza A, Gatti C, Malaventura C, Pierantoni L, Parente G, Pelusi G, Perrone S, Serra L, Torcetta F, Valletta E, Vergine G, Antodaro F, Bergomi A, Chiarlolanza J, Leoni L, Mazzini F, Sacchetti R, Suppiej A, Iughetti L, Pession A, Lima M, Esposito S, The Uti-Ped-Er Study Group. Antibiotic Prophylaxis for the Prevention of Urinary Tract Infections in Children: Guideline and Recommendations from the Emilia-Romagna Pediatric Urinary Tract Infections (UTI-Ped-ER) Study Group. Antibiotics (Basel). 2023;12(6):1040. DOI: 10.3390/antibiotics12061040
16. Lee JN, Byeon KH, Woo MJ, Baek HS, Cho MH, Jeong SY, Lee SM, Ham JY, Ha YS, Kim HT, Yoo ES, Kwon TG, Chung SK. Susceptibility of the Index Urinary Tract Infection to Prophylactic Antibiotics Is a Predictive Factor of Breakthrough Urinary Tract Infection in Children with Primary Vesicoureteral Reflux Receiving Continuous Antibiotic Prophylaxis. J Korean Med Sci. 2019;34(21):e156. DOI: 10.3346/jkms.2019.34.e156
17. Yang SS, Tsai JD, Kanematsu A, Han CH. Asian guidelines for urinary tract infection in children. J Infect Chemother. 2021;27(11):1543-1554. DOI: 10.1016/j.jiac.2021.07.014
18. Ammenti A, Alberici I, Brugnara M, Chimenz R, Guarino S, La Manna A, La Scola C, Maringhini S, Marra G, Materassi M, Morello W, Nicolini G, Pennesi M, Pisanello L, Pugliese F, Scozzola F, Sica F, Toffolo A, Montini G; Italian Society of Pediatric Nephrology. Updated Italian recommendations for the diagnosis, treatment and follow-up of the first febrile urinary tract infection in young children. Acta Paediatr. 2020;109(2):236-247. DOI: 10.1111/apa.14988
19. Chang CL, Yang SS, Hsu CK, Chen CH, Chang SJ. Effectiveness of various treatment modalities in children with vesicoureteral reflux grades IIIV: a systematic review and network meta-analysis. BMJ Paediatr Open. 2023;7(1):e002096. DOI: 10.1136/bmjpo-2023-002096
20. Faiz S, Zaveri MP, Perry JC, Schuetz TM, Cancarevic I. Role of Antibiotic Prophylaxis in the Management of Antenatal Hydronephrosis, Vesicoureteral Reflux, and Ureterocele in Infants. Cureus. 2020;12(7):e9064. DOI: 10.7759/cureus.9064
21. Meena J, Hari P. Vesicoureteral reflux and recurrent urinary tract infections. Asian Journal of Pediatric Nephrology. 2019;2(2):61-70. DOI: 10.4103/AJPN.AJPN_26_19
22. Edwards A, Peters CA. Managing vesicoureteral reflux in children: making sense of all the data. F1000Res. 2019;8:F1000 Faculty Rev-29. DOI: 10.12688/f1000research.16534.1
23. Xie M, Xu X, Cao Z, Xiao H. Do Various Treatment Modalities of Vesicoureteral Reflux Have Any Adverse Effects in Pediatric Patients? A MetaAnalysis. Urol Int. 2021;105(11-12):1002-1010. DOI: 10.1159/000518603
24. Meena J, Hari P. Continuous Antibiotic Prophylaxis in Infants with Grade III, IV, or V Vesicoureteral Reflux: Pediatric Nephrologist's Viewpoint. Indian Pediatr. 2024;61(3):258-259. PMID: 38469843
25. Landau Z, Cherniavsky E, Abofreha S, Linder I, Leibovitz R, Roif-Kaminsky D, Friger M, Bilenko N, Leibovitz E. Epidemiologic, microbiologic and imaging characteristics of urinary tract infections in hospitalized children < 2 years of age diagnosed with anatomic abnormalities of the urinary tract. Pediatr Neonatol. 2022;63(4):402-409. DOI: 10.1016/j.pedneo.2022.01.005
26. Wu TH, Huang FL, Fu LS, Chou CM, Chien YL, Huang CM, Lin CF, Chen PY. Treatment of recurrent complicated urinary tract infections in children with vesicoureteral reflux. J Microbiol Immunol Infect. 2016;49(5):717-722. DOI: 10.1016/j.jmii.2014.08.024
27. Набока Ю.Л. Вирусо-бактериальный спектр мочи у детей из группы риска и второй группы здоровья. Сибирь – Восток. Всероссийский медицинский научно-производственный журнал. 2004;(7):13-15.
28. Kogan MI, Maslyakova, GN, Napsheva A, Bedjanian S, Pasechnik D, Naboka Y, Gudima I. Acute obstructive pyelonephritis can be caused by E. coli at ≤104 bacteriuria level (experimental model). European Urology Supplements. 2018;17.
Об авторах
Ю. Л. НабокаРоссия
Юлия Лазаревна Набока — д-р мед. наук, профессор
Ростов-на-Дону
В. В. Сизонов
Россия
Владимир Валентинович Сизонов — д-р мед. наук, профессор
Ростов-на-Дону
Е. М. Котиева
Россия
Елизавета Михайловна Котиева
Ростов-на-Дону
В. В. Глухова
Россия
Валентина Владимировна Глухова
Ростов-на-Дону
И. А. Гудима
Россия
Ирина Александровна Гудима — д-р мед. наук, профессор
Ростов-на-Дону
Е. В. Кудря
Россия
Елена Васильевна Кудря — канд. мед. наук
Ростов-на-Дону
А. И. Анопко
Россия
Ростов-на-Дону
Р. А. Родина
Россия
Роза Алексеевна Родина
Ростов-на-Дону
М. И. Коган
Россия
Михаил Иосифович Коган — д-р мед. наук, профессор, заслуженный деятель науки РФ
Ростов-на-Дону
Рецензия
Для цитирования:
Набока Ю.Л., Сизонов В.В., Котиева Е.М., Глухова В.В., Гудима И.А., Кудря Е.В., Анопко А.И., Родина Р.А., Коган М.И. Микробиота мочепузырной мочи у детей с пузырномочеточниковым рефлюксом перед его оперативным лечением. Вестник урологии. 2025;13(1):27-38. https://doi.org/10.21886/2308-6424-2025-13-1-27-38
For citation:
Naboka Yu.L., Sizonov V.V., Kotieva E.M., Glukhova V.V., Gudima I.A., Kudryya E.V., Anopko A.I., Rodina R.A., Kogan M.I. Bladder urine microbiota in children with vesicoureteral reflux: preoperative values. Urology Herald. 2025;13(1):27-38. (In Russ.) https://doi.org/10.21886/2308-6424-2025-13-1-27-38













































